播散性胞内鸟分枝杆菌感染一例
王春又,翟志芳,郝 飞,杨希川,张 琬,钟白玉
临床资料

图1 播散性胞内鸟分枝杆菌感染患者四肢及腹股沟皮损
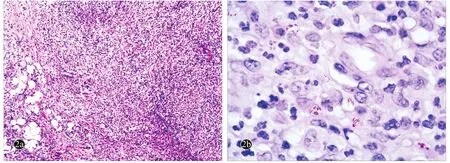
图2 播散性胞内鸟分枝杆菌感染患者左侧髋部结节组织病理
患者,女,60岁。因全身红斑、结节伴疼痛6个月,于2012年12月7日就诊。6个月前,患者左下肢出现3个蚕豆大红色结节,伴肿痛,无畏寒、发热、关节痛、咳嗽、咳痰等不适;结节逐渐增大,表面破溃,可挤出黄色脓液;5个月前患者出现反复寒战、发热,体温最高达38.9℃,无咳嗽、咳痰,体温可自行降至正常(具体热型不详),发热症状持续2个月余。此后双下肢、左上肢及腹部相继出现大小不等的疼痛性红斑、结节,部分破溃、结痂。患者先后就诊于当地多家医院,给予系统抗生素治疗(具体药名及用法不详),无好转。患者既往体健,发病前1个月因车祸致左下肢外伤并行手术局部清创治疗。自起病以来,患者体重下降15 kg。否认系统疾病史,否认发病前特殊接触史,家族中无类似疾病患者。体格查体:体温:36.2℃,慢性病容,贫血貌,精神差,营养欠佳,心、肺、腹查体无明显异常。皮肤科情况:额部可扪及散在绿豆至蚕豆大小肤色结节,质地较硬,活动度欠佳;左手腕部、前臂、左大腿伸侧、腹股沟、双小腿、足背散在40余个直径1~4 cm暗红色结节,界清,质硬,表面皮温、高,触痛明显;左侧腹股沟区可扪及手掌大小斑块,质硬,无明显压痛(图1);双下肢中度凹陷性水肿;左侧耳前、耳后、右侧颈前、右侧腋窝、双侧腹股沟处可扪及数个绿豆至鸽蛋大小淋巴结,表面无破溃,部分与周围组织粘连、轻微压痛。实验室及辅助检查:白细胞27.68×109/L [正常值(4~10)×109/L],中性粒细胞百分比90.4 %(50%~70%),动态红细胞沉降率120 mm/h(0~20 mm/h);血清碱性磷酸酶190 IU/L(34~114 IU/L),白蛋白18.7 g/L (38~51 g/L),球蛋白41.7 g/L(25~38 g/L),白球比值0.45(1.2~2.5), C反应蛋白94 mg/L(0~3 mg/L),人免疫球蛋白IgG 20.9 g/L(7.82~16.8 g/L),肾功能、免疫缺陷病毒(HIV)抗体、甲苯胺红不加热血清试验(TRUST)、抗链球菌溶血素等检测均无异常。结核菌素试验阴性。结核感染T细胞检测:抗原A斑点数(+)30个,抗原B斑点数(+)8个。多次脓液细菌及真菌培养均阴性。胸腹部CT示:双侧颈部、腋窝、左侧腹股沟多发淋巴结增大,右肺中叶、双肺下叶钙化灶,主动脉硬化,肝右叶钙化灶,盆腔少量积液。骨髓穿刺示:粒系增生,血小板明显增多。骨髓细菌培养阴性。骨髓活检结果示:造血组织增生明显活跃,以粒系增生为主,未见明显异常细胞及分布;中性粒细胞碱性磷酸酶(NAP)阳性率92%(10%~40%),积分308分(40~80分)。切取左侧髋部结节(约1.5 cm×1 cm,深达脂肪层)行组织病理检查示:表皮缺失,真皮及皮下脂肪组织内可见大片密集的中性粒细胞、淋巴细胞、组织细胞及浆细胞浸润,见较多红细胞溢出(图2a)。抗酸染色:组织细胞内外见大量抗酸杆菌(图2b)。PAS染色阴性。组织真菌培养阴性。皮损组织分枝杆菌聚合酶链式反应(PCR)证实胞内鸟分枝杆菌。结合患者病史、临床表现及组织病理等明确诊断为播散性胞内鸟分支杆菌感染。
治疗:首先给予利福平0.45 g +异烟肼0.3 g +吡嗪酰胺0.75 g每日1次、盐酸米诺环素100 mg、复方磺胺甲恶唑片2片每日2次口服。20 d后,患者未再出现发热,部分结节渐缩小。但用药至3个月时,患者左上肢出现新发结节并再次出现发热,遂调整方案为四联抗感染治疗:米诺环素100 mg、克拉霉素500 mg 每日2次口服,阿米卡星0.4 g 每日2次肌内注射,盐酸莫西沙星400 mg 每日1次静脉滴注治疗15 d。15 d后患者体温降至正常,无新发损害,药物调整为阿米卡星 0.4 g 每日2次静脉滴注,盐酸莫西沙星0.4 g每日1次口服,克拉霉素0.1 g 每日2次口服;1个月后停用阿米卡星,盐酸莫西沙星及克拉霉素口服6个月后停药。6个月后,患者全身皮损逐渐消退。1年后随访,患者全身未再出现新发结节及不明原因发热。
讨论
胞内分枝杆菌(Mycobacterium intracellulare)因与鸟分枝杆菌(Mycobacterium avium)是密切相关且难以区分,因此,通常称为鸟细胞内分枝杆菌(Mycobacterium avium intracellulare,MAI)或胞内鸟分枝杆菌复合群(Mycobacterium avium complex,MAC)[1]。这些抗酸杆菌多存在于土壤、淡水、海水、乳制品、动物组织和屋尘[2]中,属于机会致病菌。主要在HIV感染或其他原因引起的免疫功能受损患者体内致病。其进入机体最主要的途径是通过支气管或肠黏膜。当前认为消化道传播是MAC感染AIDS患者的主要途径,呼吸道途径则次之。对于非免疫功能抑制的患者可由吸入含有MAC的空气或外伤而继发感染,同时暴露的强度、年龄、免疫系统、HIV并发感染、遗传因素、预防接种情况以及社会经济因素等均是造成感染的易感因素[3]。
MAC感染最常见表现为肺部疾病、菌血症和淋巴结炎,累及皮肤较为罕见,而单纯累及皮肤更为罕见,这通常与传播的途径有关。累及皮肤时,皮损多表现为孤立或多个皮下结节、鳞屑性斑块、臁疮样皮损、疣状溃疡、结节和窦道,多伴有疼痛。常见于四肢,少数可发生在面部、颈部、背部和腹股沟,而掌跖部较为罕见[4]。
组织病理学上胞内鸟分枝杆菌感染后常规HE染色可见到中性粒细胞、淋巴细胞、多核巨细胞、浆细胞浸润,泡沫细胞及嗜酸粒细胞等混合性炎性细胞浸润。PAS染色及抗酸染色在泡沫细胞内可见大量粗短弯曲杆菌[5]。诊断该病的金标准依赖于病原学检查,如组织培养或PCR检测。对于局限性的皮肤胞内鸟分枝杆菌感染可采取手术局部切除[6],而播散性皮损应给予系统抗感染药物治疗。胞内鸟分枝杆菌感染的治疗较为困难,易对抗生素产生耐药。克拉霉素、利福平、卷曲霉素、乙胺丁醇、利奈唑胺、阿米卡星、莫西沙星等药物在不同的个案报道中被认为有效,其中克拉霉素、利福平和卷曲霉素表现出对胞内分枝杆菌有更好的抗菌活性[7]。以皮肤感染为主要表现的胞内鸟分枝杆菌易被误诊为以下几种肉芽肿性疾病:海鱼分枝杆菌感染、麻风、皮肤结核、结节病等。
本例患者免疫系统正常,但发病前的车祸外伤史可能是导致其感染的主要原因之一。外伤后机会致病菌接种传播,导致全身皮肤出现播散性损害,而未出现肺部及消化道病变,在临床上较为少见。结合该患者的临床特点、组织病理学及病原学检查,胞内鸟分枝杆菌感染诊断明确。在患者的治疗过程中出现了病情的反复,可能与分枝杆菌产生耐药性有关。因此,对于此类感染,应予以联合、足量、足疗程治疗,一般推荐多种药物联合治疗,对于播散性感染或伴有免疫抑制的患者治疗疗程应更长。在用药期间应警惕药物引起的不良反应,如药物性肝炎、肾毒性、白细胞减少等。若条件允许可在经验性用药的同时尽快进行体外药敏试验,根据药敏结果选择敏感药物。
【参 考 文 献】
[1] 朱学骏, 王宝玺, 孙建方. 皮肤病学 [M]. 2版. 北京:北京大学医学出版社, 2015:1261.
[2] Kayal JD, Mccall CO. Sporotrichoid cutaneousMycobacteriumavium complex infection [J]. J Am Acad Dermatol, 2002, 47(5):S249-250.
[3] Biet F, Boschiroli ML, Thorel MF, et al. Zoonotic aspects of Mycobacterium bovis andMycobacterium avium-intracellulare complex(MAC) [J]. Vet Res, 2005, 36(3): 411-436.
[4] Lugojaner G, Cruz A, Sanchez JL, et al. Disseminated cutaneous infection caused byMycobacterium avium Complex[J]. Arch Dermatol, 1990, 126(8): 1108-1110.
[5] 徐文漭, 李霞, 王媛媛, 等. 鼻腔及面部鸟型胞内分枝杆菌感染一例 [J]. 中华病理学杂志, 2012, 41(4):281-282.
[6] Cole GW, Gebhard JF.Mycobacterium aviuminfection of the skin resembling lepromatous leprosy [J]. Br J Dermatol, 1979,101(1):71-74.
[7] Zhao X, Wang Y, Pang Y, et al. Antimicrobial susceptibility and molecular characterization of Mycobacterium intracellularein China[J]. Infect Genet Evol, 2014:332-338.

