全柱成像毛细管等电聚焦电泳分析蛋白质药物电荷异质性
孟晓光,甄 里,刘悦玫,侯利平,刘 丹,李 斌,欧阳伟民,魏开华,5*
(1.北京正旦国际科技有限责任公司,北京 102206;2.北京蛋白质组研究中心,蛋白质组学国家重点实验室,国家蛋白质科学中心(北京),北京 102206;3.江汉大学 护理与医学技术学院,湖北 武汉 430056;4.北京绿绵科技有限公司,北京 100080;5.军事医学科学院 放射与辐射医学研究所,北京 100850)
全柱成像毛细管等电聚焦电泳分析蛋白质药物电荷异质性
孟晓光1,2,甄 里3,刘悦玫1,2,侯利平1,2,刘 丹1,2,李 斌4,欧阳伟民4,魏开华1,2,5*
(1.北京正旦国际科技有限责任公司,北京 102206;2.北京蛋白质组研究中心,蛋白质组学国家重点实验室,国家蛋白质科学中心(北京),北京 102206;3.江汉大学 护理与医学技术学院,湖北 武汉 430056;4.北京绿绵科技有限公司,北京 100080;5.军事医学科学院 放射与辐射医学研究所,北京 100850)
评价了cIEF-WCID检测多肽与蛋白质药物等电点的应用效果。测定标准多肽的等电点,验证了cIEF-WCID具有高的准确度和良好的重复性(相对标准偏差<0.50%)。人血红蛋白的4种主要异构体实现了基线分离;甘赖胰岛素的重复测试均只检出单一特征峰(pI 5.95±0.01);比较重组人生长激素原液和成品,等电点特征峰比例差异明显,且成品有新特征峰出现;对比进口及国产贝伐单抗,发现厂家1、3与原研药基本一致,厂家1的主成分迁移规律与原研药高度一致,厂家2的重链C末端K缺失、N末端焦谷氨酸环化或脱酰胺修饰影响了电荷异质性;通过考察尿素浓度、电解质范围和聚焦时间,优化了检测重组人促卵泡素等电点条件:2 mol/L尿素,两性电解质pH 2.5~5.0与pH 3.0~10.0按1∶1混合,聚焦电压1 000 V(1 min)~1 800 V(4 min)~2 200 V(1 min)。cIEF-WCID可快速、准确测定具有电荷异质性的蛋白类药物等电点,分辨率和重复性好,尤其是可以跟踪聚焦过程中样本的迁移特征,特别适合蛋白类药物复杂电荷异质性的检测。
全柱成像毛细管等电聚焦电泳;电荷异质性;重组蛋白质药物;抗体;药学研究
等电点(Isoelectric point,pI)反映了蛋白质药物电荷与空间构象的均一性,是蛋白质药物质量控制的必不可少的项目。全柱成像毛细管等电聚焦电泳(Capillary iso-electric focusing electrophoresis-whole column imaging detection,cIEF-WCID)是20世纪90年代Pawliszyn等开发出的一种新型生物大分子检测技术,采用一个动态检测器对整个毛细管分离柱内进行实时检测,不仅能对样品进行常规的分离,并且在分离的同时可提取出有关动态过程的动力学参数进行分析,从而获取多肽与蛋白质药物电荷与空间结构相关的更丰富信息[1-2]。Randall[3]成功解析了血红蛋白的主要电荷异构体,最近,Pawliszyn等[4]将硼酸亲和富集糖蛋白再通过cIEF-WCID成功检测到糖蛋白的电荷异构体精细分布,还通过傅立叶变换分析建立了扩散系数精确分析技术,使得cIEF-WCID开始向理论研究进展[5]。cIEF-WCID弥补了传统cIEF的不足,为生物大分子药物测定精确pI创造了有利条件,在分辨率、准确性和重复性等方面优势突出,适用于蛋白质分析的基础研究、质量标准和法规检测。
目前,关于cIEF-WCID对蛋白质聚焦过程的跟踪还鲜有报道,本研究采用cIEF-WCID分析不同分子量、不同复杂程度的蛋白质药物样本,包括甘赖脯胰岛素、重组人生长激素(rhGH)、重组人促卵泡激素(rhFSH)、贝伐单抗与Avastin,并实时跟踪抗体等药物的聚焦过程,观察到多数蛋白质具有“双轨迹聚焦”的共同特征,从而对于更精细评价蛋白质药物的电荷异质性提供了一种新方法。
1 实验部分
1.1 材料与仪器
甘赖脯胰岛素、rhGH、rhFSH、贝伐单抗均为国内公司生产,纯度均>99%。Avastin由国内企业外购(Roche,纯度>99%)。Hemoglobin human购自Sigma公司,纯度均>98%;WCID-FC毛细管柱(加拿大Advanced Electrophoresis Solutions,简写AES,100 μm×35 cm,有效长度5 cm);载体两性电解质HR AESlyte 3~10,HR AESlyte 6~10与SR AESlyte 2.5~5(AES,Lot#:101016,101027,101013);1%甲基纤维素(MC,AES),标准品(pI 4.65,5.12,5.91,6.14,6.61,7.05,7.40,7.65,7.90,8.18,8.71,9.22,9.33,AES,Lot#:P07-111714),尿素(AMRESCO),阴极电解液(0.1 mol/L NaOH)和阳极电解液(0.08 mol/L H3PO4)为分析纯,购自国药集团化学试剂北京有限公司;高速冷冻离心机3-30 K购自Sigma公司,实验用水为Milli-Q(Millipore公司)制备。
1.2 实验方法
cIEF-WCID为CEInfinite C01型(AES)。将待测样本配制成10 mg/mL水溶液,取2 μL与100 μL电泳缓冲液混合(含4%两性电解质3~10,2 mol/L尿素,0.25%MC,体积比),加入合适的等电点标准品各0.75 μL,充分混匀,10 000 r/min离心3 min后取上清进样。手动进样方式进样,单次进样量3 μL。根据样本特性设置适当的聚焦参数,一般为:1 000 V(1 min)~2 000 V(1 min)~3 000 V(4 min)。用CEInsight软件采集CMOS全柱成像图并自动转换为色谱图,检测波长280 nm。
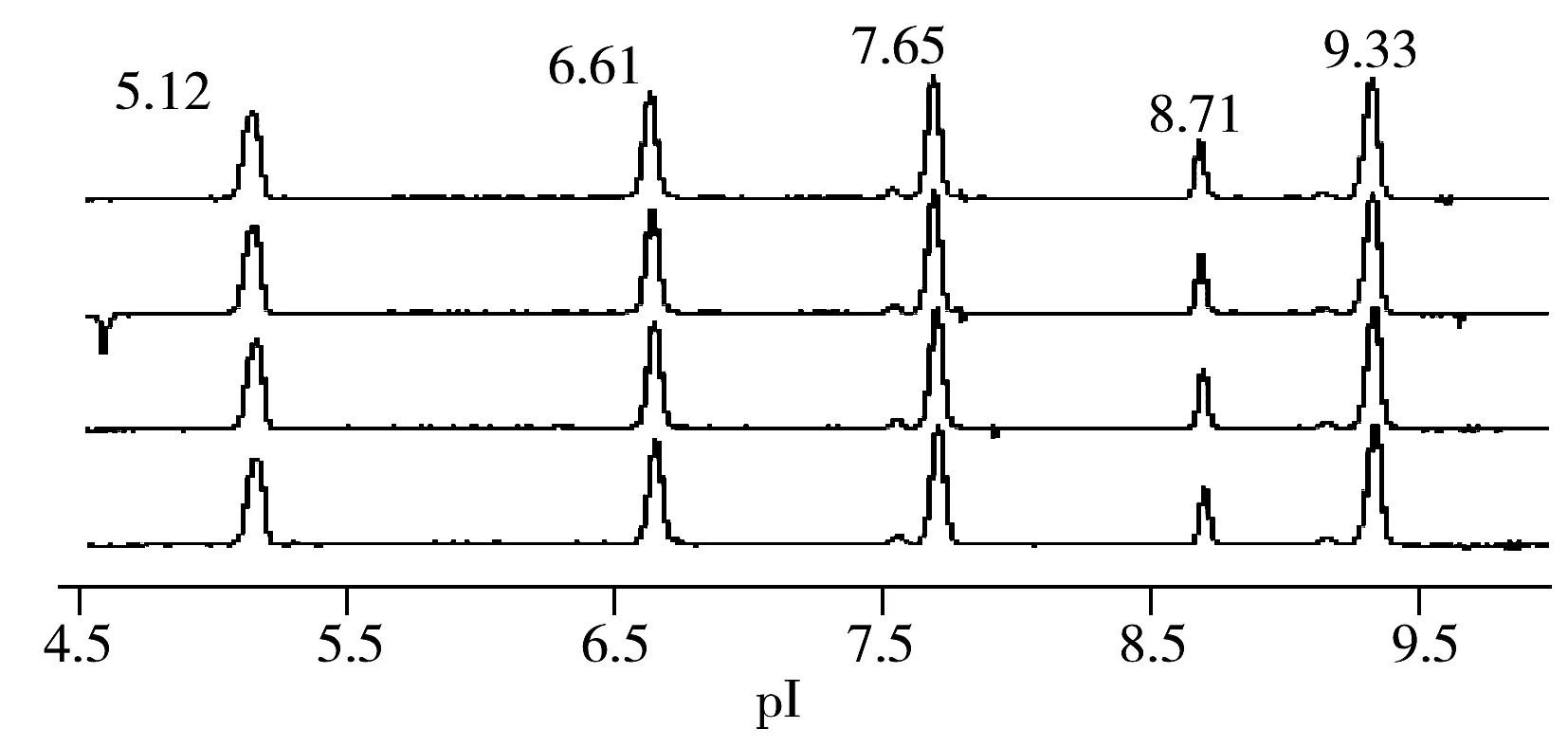
图1 等电点标准品连续进样4次的cIEF-WCID等电聚焦图Fig.1 Isoelectric focusing results of pI standards detected by cIEF-WCID for 4 times
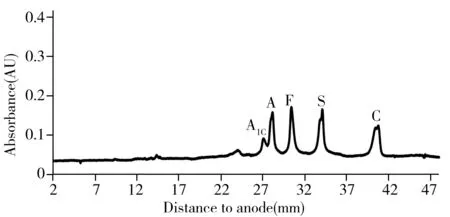
图2 人血红蛋白的cIEF-WCID等电聚焦图Fig.2 Isoelectric focusing results of hemoglobin human detected by cIEF-WCID
2 结果与结论
2.1 准确度
将2种标准品(pI 6.61,5.12)进行等电点测定,重复3次,测定平均值分别为pI 6.62和pI 5.10,等电点的平均值相对标准偏差小于0.50%,准确度良好。
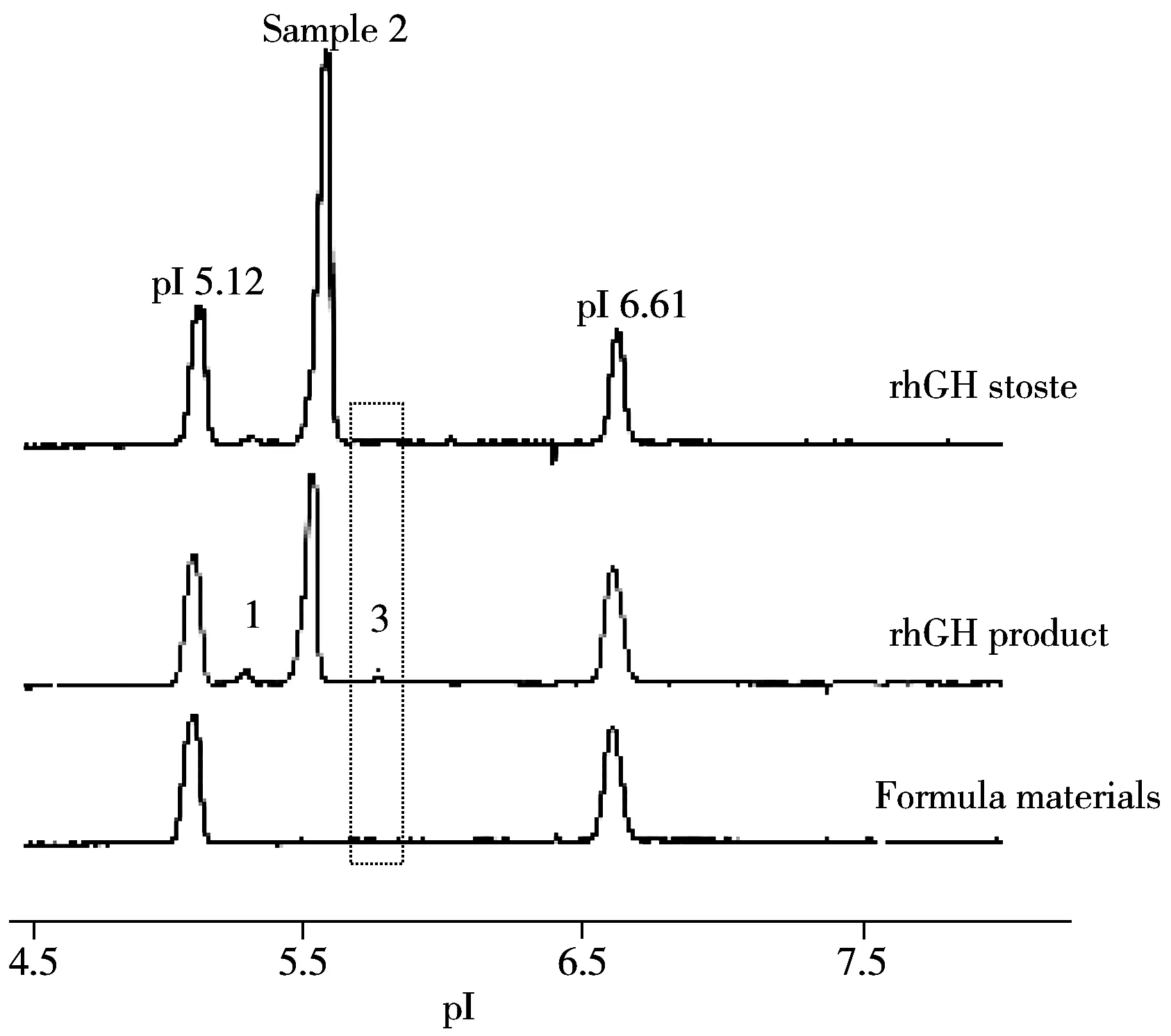
图3 rhGH原液与成品的cIEF-WCID等电聚焦图Fig.3 Isoelectric focusing results of rhGH stoste and product detected by cIEF-WCID
2.2 重复性
将等电点标准品(pI 5.12,6.61,7.65,8.71,9.33)与两性电解质混合后连续进样4次,结果见图1。各标准品峰形和等电点基本一致,相对标准偏差小于0.50%,重复性良好。
2.3 分离能力
通过血红蛋白(Hemoglobin human)异构体峰A,F,S,C的分离情况来考察本系统的分离能力。血红蛋白与两性电解质混合溶液的cIEF-WCID等电聚焦电泳图(图2)显示,A1C(pI 6.94)与A(pI 6.97),F(pI 7.06),S(pI 7.21),C(pI 7.44)基本达到基线分离,且实测各峰的等电点与文献一致[3,5],说明本方法的分离能力和准确度极高。
2.4 重组药物电荷异质性分析
2.4.1 甘赖脯胰岛素 甘赖脯胰岛素是国内原创的一种新型胰岛素类降糖药,采用cIEF-WCID考察其批间一致性和聚焦特性。选用标准品pI 5.12和pI 6.61,连续进样3次,测定结果均为单峰,等电点分别为5.95,5.95和5.96,相对标准偏差为0.10%,单次检测仅需6 min。
2.4.2 重组人生长激素原液与成品的比对 rhGH是由191个氨基酸残基或N端有一甲硫氨酸的192个氨基酸残基组成的蛋白,有调整内分泌系统、激活并维护免疫系统正常工作等作用。rhGH成品包含泊洛沙姆188、氯化钠、柠檬酸钠和苯酚等有机小分子和盐等添加物,有机酸、赋形剂和较高的离子强度可能影响rhGH电荷特性,通过cIEF-WCID可快速分析原液与成品的电荷差异,结果见图3。由图3可见,测得rhGH原液的等电点为5.31(相对含量1.4%)、5.57(相对含量98.6%),rhGH成品的等电点为5.29(7.1%)、5.54(88.4%)和5.77(4.4%)。尽管原液和成品的共有组分等电点极为接近(相对标准偏差为0.38%),但相对含量有一定差异,且成品中多1个峰(峰3)。通过对成品的辅料进行cIEF-WCID分析,并未检出峰3,提示成品中可能含有rhGH相关的电荷异质物质,因此本品质量控制需重点关注。
2.5 国内外贝伐单抗的比对
阿瓦斯汀(Avastin)化学名“贝伐单抗”,是一种阻碍血管生成的药物,抑制肿瘤产生、扩散和转移。该药物被美国FDA批准用于肺癌、结肠癌、直肠癌和乳腺癌的治疗,是癌症治疗畅销药物,国内多家药企进行了仿制。本文对国内3家仿制品及国外1家原研药进行了cIEF-WCID比对,比较其等电点及各电荷异构体的迁移过程差异。
图4为3个厂家仿制药与原研药Avastin的等电聚焦图,等电点结果见表1。结果表明,3个厂家贝伐单抗与Avastin均检测到5个等电点,位于8.24~8.60,各等电点的相对标准偏差均小于0.15%,国内贝伐单抗与国外Avastin的等电点分布一致。但各等电点的相对含量略有差异(表2),厂家1与厂家3各组分的相对含量与Avastin均一致,厂家2等电点1,4,5虽与Avastin差异不大,但峰形不同,推测主要由重链C末端K缺失、N末端焦谷氨酸环化或脱酰胺修饰存在微量差异等原因导致,提示其各修饰体含量可能与Avastin略有不同。
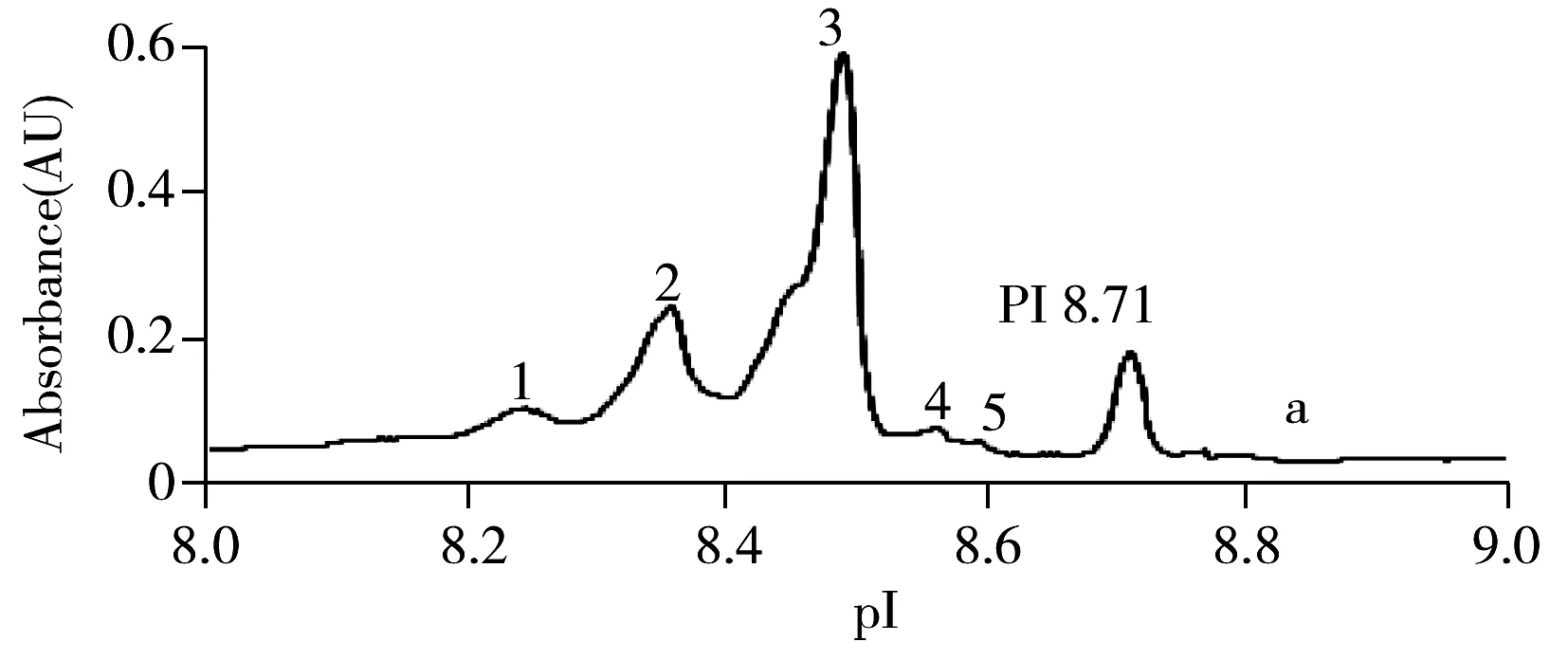
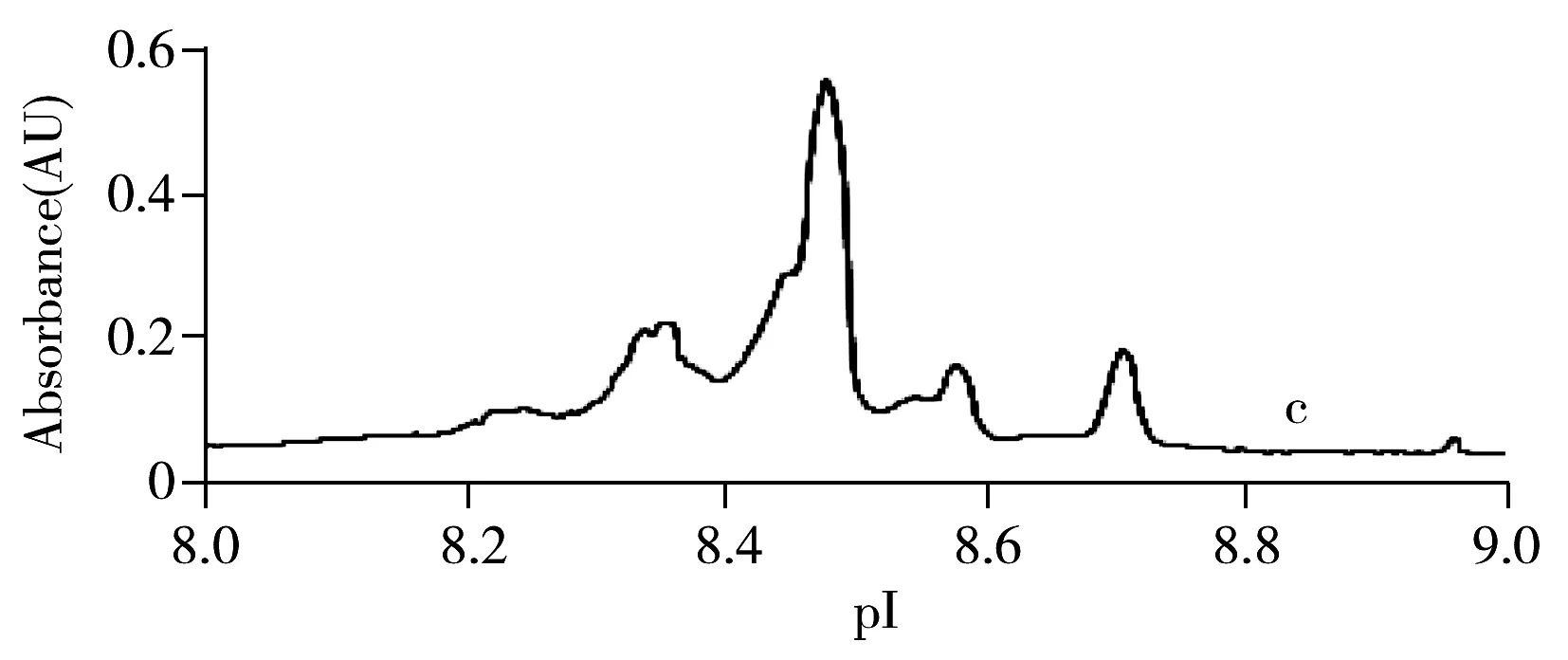
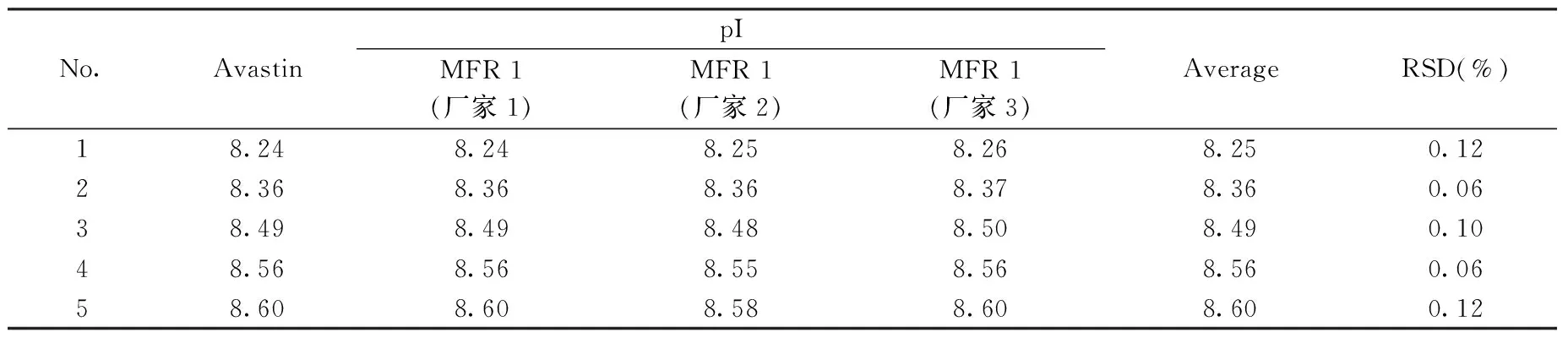
表1 Avastin与多个厂家仿制药的cIEF-WCID等电聚焦结果Table 1 cIEF-WCID results of Avastin and biosimilars from different manufacturers

表2 cIEF-WCID测定Avastin与多个厂家仿制药的相对含量Table 2 cIEF-WCID quantitation results of Avastin and biosimilars from different manufacturers
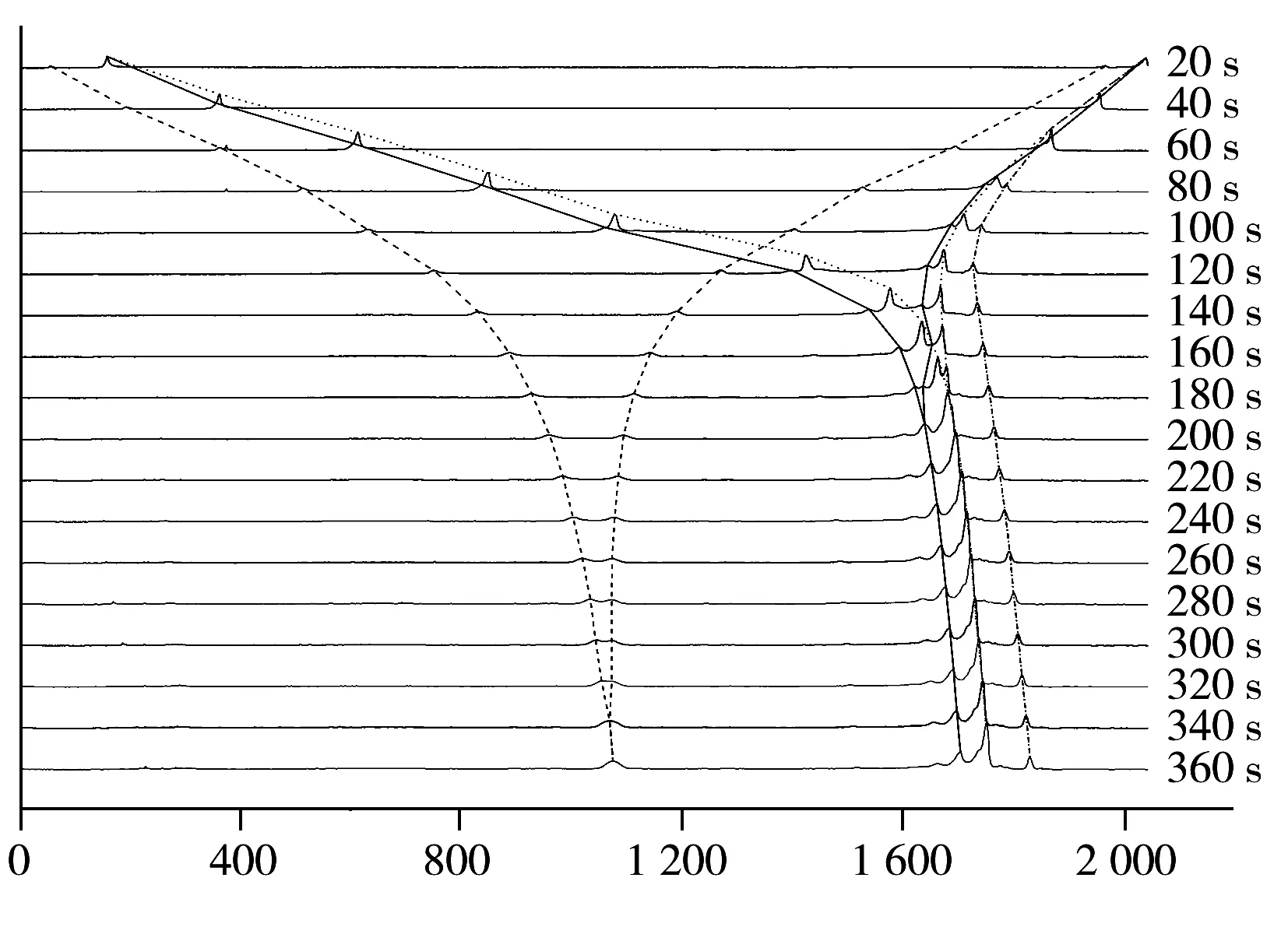
图5 cIEF-WCID监测Avastin等电聚焦图的动态过程Fig.5 Dynamic focusing process of Avastin monitored by cIEF-WCID
图5为Avastin的动态聚焦过程。由图可知,聚焦开始时,电压1 000 V,Avastin与标准品同时从两极向中部移动,暂未分离。随着聚焦时间延长、电压升高,Avastin与等电点标准品出现分离,分别向其pI移动(见图5移动趋势线)。聚焦到一定程度时为单一色谱峰,且随聚焦时间延长峰形未发生明显改变,此时聚焦完成。该位置即为其pI。
以Avastin的聚焦过程为基准,选取主成分X1与X2,比较国内厂家贝伐单抗与Avastin的聚焦规律。明显得出,厂家1 X1与X2的聚焦过程几乎与Avastin一致。厂家2 X1与X2的聚焦过程与Avastin存在一定差异。厂家3 X1与X2的聚焦过程与Avastin存在轻微差异,但整体趋势接近一致。综上所述,通过cIEF-WCID技术可明显得出厂家1所提供贝伐单抗的等电点、相对含量以及主成分迁移规律与Avastin极为接近。
2.6 重组人促卵泡激素等电点条件优化
rhFSH是由α,β两个亚基通过非共价键形成的异源二聚体糖蛋白。在临床上用于治疗不孕不育,前景广泛。rhFSH是由不同的异构体构成。由于糖链以及糖链分支顶端唾液酸残基的差异,使rhFSH的电荷异质性较复杂。rhFSH糖基化的差异产生多种异构体,每种异构体对生物学活性贡献不同,如何有效控制各种异构体的含量成为rhFSH生产的关键,而rhFSH质量控制是确保各种异构体的含量达到一定的比例。cIEF-WCID技术为分析糖基化以及差异的产生多种异构体提供了可能,为rhFSH质量控制提供了有效手段。
2.6.1 尿素摩尔浓度 由于高浓度的rhFSH样品在缓冲溶液中溶解性不好,需在样品中添加适量的助溶剂尿素等。本实验选择在样品测定液中加入不同浓度的尿素后上样,以确定尿素最佳浓度,结果见图6A。由图6A可知,样品缓冲液中不加入尿素,分离过程会出现部分沉淀。加入一定浓度的尿素可以增加样品的稳定性,提高分离度。尿素浓度达到2 mol/L时,分离效果最佳,4 mol/L时峰形混乱,推测样本空间结构已被破坏,故尿素浓度选择2 mol/L[6]。
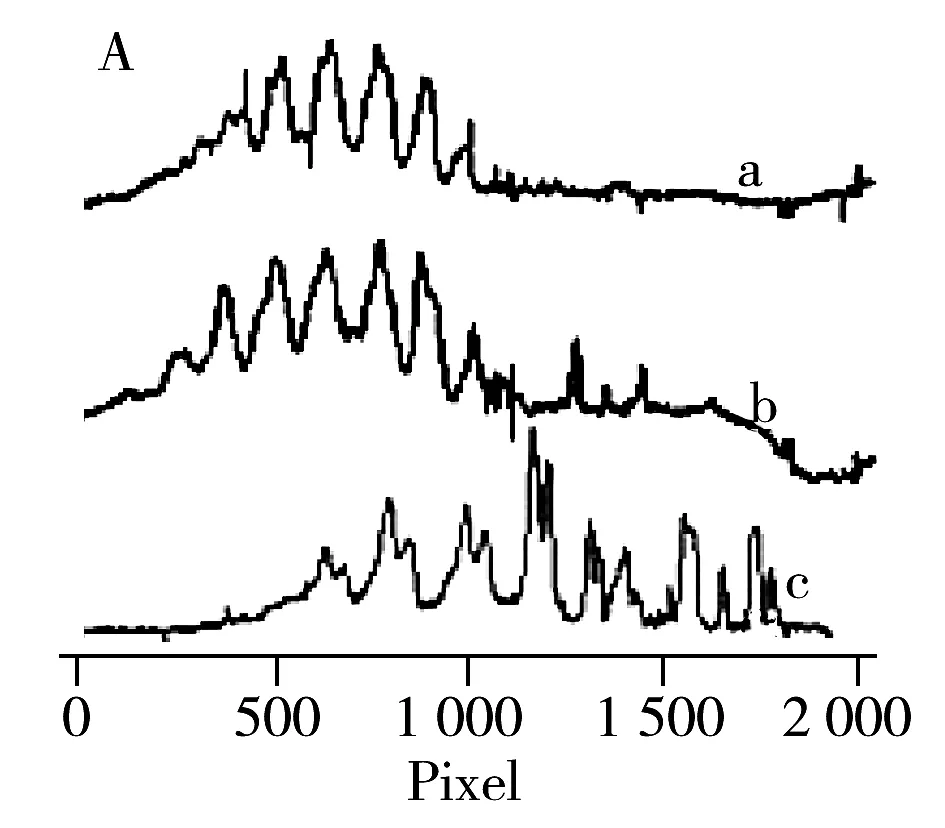



图6 cIEF-WCID测定rhFSH等电点条件考察Fig.6 cIEF-WCID optimization for rhFSH pI measurementsA:urea concentration(a-c):0,2,4 mol/L;B:pH range(a-b):pH 2.5~5.0∶pH 3.0~10.0=1∶1,pH 3.0~10.0;C:focusing time(a-e):2,3,4,5,6 min;D:focusing time(a-d):360,380,400,420 s
2.6.2 两性电解质 选择2种范围的两性电解质(pH 3.0~10.0与pH 2.5~5.0)。pH 3.0~10.0两性电解质单独使用时,rhFSH样品会在靠近酸性端位置聚焦,异构体未完全分开且无法加入适宜等电点标准品;pH 2.5~5.0两性电解质单独使用时,由于与rhFSH主成分的等电点范围较接近,导致样本各电荷异构体在成像范围内呈现连续宽峰,两者单独使用时的分离度均低于pH 3.0~10.0与pH 2.5~5.0混合使用(体积比1∶1),故确定pH 3.0~10.0与pH 2.5~5.0同时使用(体积比1∶1)[6]。具体结果见图6B。
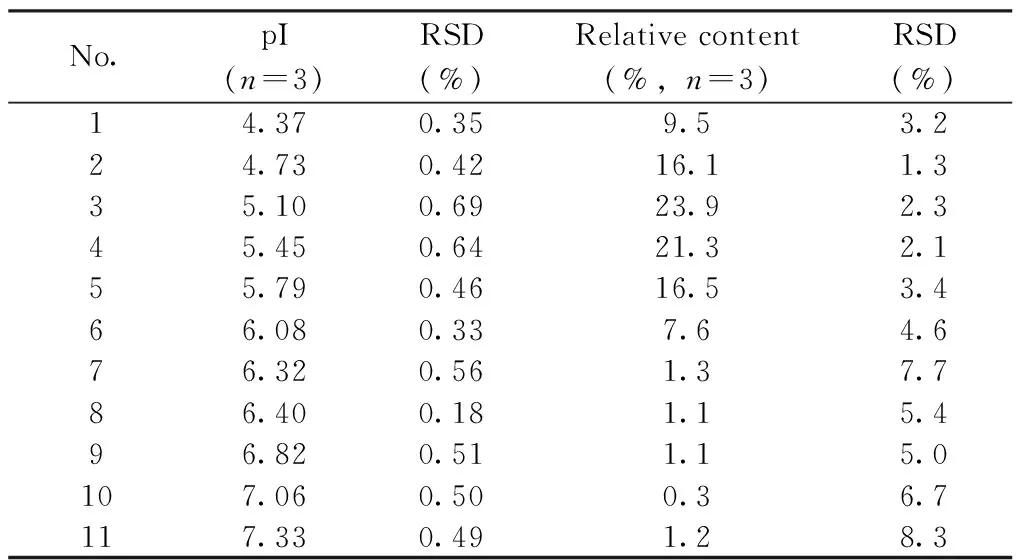
表3 rhFSH的cIEF-WCID等电聚焦结果Table 3 cIEF-WCID results of rhFSH
2.6.3 聚焦时间 由图6C~D可知,实时跟踪rhFSH聚焦过程,6~7 min时主成分峰形与迁移距离已无明显改变,因此选择聚焦时间为6 min[7]。通过尿素浓度、两性电解质、聚焦时间和电压等条件的优化,最终确定cIEF-WCID测定rhFSH等电点的最佳实验条件为:2 mol/L尿素,两性电解质pH 2.5~5.0与pH 3.0~10.0按1∶1混合,聚焦时间6 min,聚焦电压1 000 V(1 min)~1 800 V(4 min)~2 200 V(1 min)。rhFSH的cIEF-WCID等电聚焦结果见表3。结果表明,rhFSH等电点分布范围为4.37~7.33,主成分等电点分布范围为4.37~6.08,主成分合计含量约94.9%。3次测定所得等电点相对标准偏差均小于1%,对应等电点相对含量,相对标准偏差大部分均小于5%,个别小于10%,说明样本和实验重复性良好。各组分等电点分布范围宽,推测与rhFSH高度复杂的糖修饰相关。
3 讨 论
cIEF-WCID技术结合毛细管等电聚焦的高效与全柱成像技术的创新,检测过程无需推动毛细管柱内样本即可实现实时成像。通过动态聚焦过程,可快速确定最佳聚焦时间,检测结果更接近样本的真实状态,大大提高了结果的可靠性[7]。本研究采用标准品研究cIEF-WCID技术的准确性、重复性和分离能力,效果良好。借助cIEF-WCID技术分析显示甘赖脯氨胰岛素、重组人生长激素、贝伐单抗(Avastin)的结构修饰对电荷异质性有显著影响[8]。优化出cIEF-WCID分析重组人促卵泡激素等电点的关键条件为2 mol/L尿素,两性电解质pH 2.5~5.0与pH 3.0~10.0按1∶1混合,聚焦电压1 000 V(1 min)~1 800 V(4 min)~2 200 V(1 min)时,方法的准确性及分离能力良好。cIEF-WCID可快速、准确测定具有电荷异质性的蛋白类药物等电点,分辨率和重复性良好,相比现有技术具有高通量的优势,该技术将为国内外药厂在蛋白类药物质量控制与新药申报环节提供更为真实、高效和快速的新途径[9]。
最值得关注的是,本方法的原位成像技术能实时采集样本聚焦过程的迁移情况,无需将聚焦好的样本推出分离柱直到检测器进行检测,避免了扩散等问题。大量实验结果显示,许多蛋白质和一些有机物是从电极两端分别向中部迁移,从而提供了样本左右两条迁移轨迹——双轨迹聚焦曲线,这种轨迹可以更精细地判别样本的电荷特征,是本方法最独特的优势。然而,电泳起始时样本并非均匀分布在溶液中,原因可能是由于本方法不是固定化的胶条(如IPG),尽管柱内纤维素增加了溶液粘度,但两性电解质仍有一定流动性,受电极液强酸或强碱影响,电极附近的柱内溶液pH值会形成比较明显的梯度,因此,靠近电极附近的样本在加电后迅速在电极附近被临时聚焦,而柱中部的样本仍为近溶液状态,不能形成聚焦带(色谱峰)。随着聚焦的进行,电极附近的pH值逐步向中部迁移直至左右重合,此时应该停止聚焦,否则,样本和柱内pH值将继续迁移,导致过聚焦。但由于本系统是实时采集聚焦过程,即使最后一张电泳图过聚焦,仍然可以从采集数据中轻易获得聚焦的图,从而不影响等电点和纯度分析。
[1] Wu J,Pawliszyn J.Anal.Chem.,1992,64(2):219-224.
[2] Wu J,Pawliszyn J.Anal.Chim.Acta,1995,299(3):337-342.
[3] Randall D.Electrophoresis,2000,21:743-748.
[4] Li L,Xia Z,Pawliszyn J.Anal.Chim.Acta,2015,30,886:83-90.
[5] Zarabadi A S,Pawliszyn J.Anal.Chem.,2015,87(4):2100-2106.
[6] Wang L,Zhou Y,Wang J Z.Chin.J.Pharm.Anal.(王丽,周勇,王军志.药物分析杂志),2014,34(6):1049-1056.
[7] Liu J X,Fang J J,Wang X Z,Li H J,Cheng J H,Wu S M,Dong F T.Lett.Biotechenol.(刘洁欣,方均建,王心正,李海静,程建华,吴胜明,董方霆.生物技术通讯),2014,25(3):381-384.
[8] Yu C F,Guo W,Wang L,Zhang F,Liu C,Wang W,Gao K.Chin.J.Pharm.Anal.(于传飞,郭玮,王兰,张峰,刘春雨,王文波,高凯.药物分析杂志),2014,34(7):1212-1215.
[9] Zhang K M,Pan Y B,Zhang A H.Chin.J.Biol.(张坤明,潘勇兵,张爱华.中国生物制品学杂志),2016,29(2):206-212.
Analysis of Peptide and Protein Drugs Isoelectric Point by Full Column Imaging cIEF-WCID
MENG Xiao-guang1,2,ZHEN Li3,LIU Yue-mei1,2,HOU Li-ping1,2,LIU Dan1,2,LI Bin4,OUYANG Wei-min4,WEI Kai-hua1,2,5*
(1.Beijing C&N International Sci-Tech Co.,Ltd.,Beijing 102206,China;2.National Center for Protein Sciences (Beijing),State of Key Laboratory of Proteomics,Beijing Proteome Research Center,Beijing 102206,China;3.School of Nursing & Medical Technology,Jianghan University,Wuhan 430056,China;4.Lumiere Tech Limited,Beijing 100080,China;5.Beijing Institute of Radiation Medicine,Military Medical Science Academy of PLA,Beijing 100850,China)
The application effect of isoelectric points(pI) of peptide and protein drugs containing different molecular weights and complex charge heterogeneity was evaluated by capillary isoelectric focusing electrophoresis-whole column imaging detection(cIEF-WCID ).The pI of standard polypeptide was mensured repeatedly to verify that cIEF-WCID had a high accuracy and a good repeatability(RSD<0.50%).Four serum protein isomers had achieved baseline separation.Gan Lai insulin was detected only a single characteristic peaks(pI 5.95±0.01) when repeating the test.The proportion differences of the characteristic peak’PI were significant,when comparing the recombinant human growth hormone bulk and final,and the final appeared new characteristic peaks.Comparing the imported and domestic Avastin,manufacturer 1 and 3 were found to be consistent with the innovator drug,and the migration behavior of main component in manufacturer 1 was highly consistent with the innovator drug,however,the charge heterogeneity of manufacturer 2 was influenced because of lose K,N-term pyro-Glu.The optimized pI detecting conditions of the recombinant human follicle stimulating hormone were obtained by studying co-solvent concentration,electrolyte and focusing time,namely Co-solvent:2 mol/L urea,ampholytes at pH 2.5-5.0 and pH 3.0-10.0 mixing by 1∶1,and focus voltage:1 000 V(1 min) to 1 800 V(4 min) and to 2 200 V(1 min).cIEF-WCID was fast and accurate,and it owned excellent resolution and reproducibility,especially,it could trace the focusing process of the analytes.Therefore,it was fit for analysing complex charge heterogeneity of protein drugs .
capillary isoelectric focusing electrophoresis-whole column imaging detection(cIEF-WCID);charge heterogeneity;recombinant protein drug;antibody;pharmaceutical research
10.3969/j.issn.1004-4957.2017.03.008
2016-08-09;
2016-11-19
国家高技术研究发展计划863项目(2014AA020906);国家科技部重大仪器专项(2012YQ18011710);蛋白质组学国家重点实验室课题(SKLP-O201412)
O657.8;O629.73
A
1004-4957(2017)03-0343-06
*通讯作者:魏开华,博士,研究员,研究方向:蛋白质组学与多肽组学,Tel:010-80727777,E-mail:wkh2006@126.com

