低温耐盐芘降解菌的筛选鉴定及降解特性研究
刁 硕,王红旗,许 洁,赵一村
(北京师范大学水科学研究院,北京 100875)
低温耐盐芘降解菌的筛选鉴定及降解特性研究
刁 硕,王红旗*,许 洁,赵一村
(北京师范大学水科学研究院,北京 100875)
低温条件(10℃)下,采用定时定量转接、间歇式逐步提高PAHs浓度的方法,从天津滨海湿地石油污染土壤中获得能以多环芳烃芘为唯一碳源和能源生长的菌群H和纯化菌株DYC-1,经生理生化和16S rDNA基因序列BLAST对比结果分析,菌株DYC-1属于红球菌属(Rhodococcus).降解特性分析结果表明,10℃低温条件下,红球菌DYC-1与菌群H降解能力相似,对20mg/L芘的15d降解率达到35%以上;红球菌DYC-1具有较好的耐盐能力和较广的降解底物谱,菌株DYC-1的最优降解条件为:低温10 ℃,盐度2%的条件下,在pH8,摇床转速为110r/min,接菌量为5%时,对于初始浓度为20mg/L的芘能达到35%以上的降解率.
低温;耐盐;芘;降解;红球菌DYC-1
多环芳烃(PAHs)作为典型的持久性有机污染物[1],不仅存在大气中,由于其自身的稳定性,进入土壤后便长期残留其中,在土壤中的半衰期为2~24个月[2],随着地表水及降水的冲刷,不断向地下水释放,对地下水环境造成了严重的污染和破坏[3].有研究表明,在PAHs污染土壤中,土著微生物对PAHs的转化能力显著高于外源微生物,转化率相差3000倍以上.同时,土著菌及混合菌对污染物具有更好的降解能力,对外界环境的变化(如温度、pH等)也有更好的适应性,易于在环境中保持竞争优势[4].因此,从长期受PAHs污染的土壤中分离筛选出高效PAHs降解菌,是生物修复PAHs污染土壤的第一步,也是关键的一步.
天津滨海湿地处于我国北方滨海地区,年平均温度多在15℃或以下.近年来滨海湿地由于油田开发等生产活动的进行,在经济快速增长的同时也造成了石油污染.PAHs是滨海湿地石油污染土壤中的主要污染物,其中含四个苯环的芘(Pyrene)是主要污染物之一.石油的生产多伴随着高盐环境的产生,降解芘的微生物在低温高盐条件下的生长和代谢都要受到一定程度的限制.Whyte等[5]指出,耐冷型假单胞菌在低温下(5~10℃)可降解萘,Deppe等[6]发现,北极的细菌共生体也可以在4℃降解萘.宋立超等[7]分离出一组菌群,在盐质量分数0~2%,15d后对菲、芘的降解率可达到92.1%和65.8%.张巧巧[8]研究发现,菌株SE12在液体培养条件下对芘的降解效果十分显著,在芘初始浓度为50,100,200mg/L的无机盐培养基中培养15d,降解率分别达到86.4%, 96.4%与79.6%.SE12能将初始浓度100mg/L的芘在15d几乎完全降解,但是当初始浓度低于或者高于100mg/L时降解率都有所降低.但目前针对低温高盐复合环境下PAHs芘降解菌的研究较少,其在低温高盐环境下的生长特性及对PAHs芘的降解特性尚不明确.本文可科学指导滨海湿地PAHs污染土壤的生物修复工作,也可为PAHs污染治理提供适宜菌株及理论依据.
1 实验材料与方法
1.1 样品来源
本研究所用土壤样品均采自天津滨海湿地石油污染地区(采样坐标N38°44′57.1″E117°29′51.1″)土壤表层10~15cm处,采取占地面积最大的盐渍化污染区域土壤样品后放于塑料自封袋中,封口,带回实验室后过2mm筛,放在4℃冰箱进行保存.理化性质如表1所示.
1.2 药品与试剂
本文所使用的主要药品及来源:芘、菲、苯并b荧蒽、苯并a蒽(分析纯,日本TCL公司);荧蒽、芴(分析纯,美国Sigma公司);Na2HPO4、KH2PO4、NH4Cl、MgSO4·7H2O、CaCl2、NaCl、NaNO3、FeSO4·7H2O、K2HPO4等、水杨酸、葡萄糖、牛肉膏、琼脂粉(分析纯,国药集团化学试剂北京有限公司);蛋白胨(分析纯,北京鼎国生物试剂公司);酵母粉(分析纯,OXOID公司);琼脂糖(分析纯,Spain公司);正己烷、乙腈、丙酮(分析纯,美国J.T.Baker公司).
试剂及来源:磷酸盐缓冲液(PBS)(pH7.4),醋酸铅滤膜,安捷伦小瓶.
1.3 培养基
无机盐培养基(MSM):K2HPO41.0g, NH4H2PO41.0g,(NH4)2SO41.0g,MgSO4·7H2O 0.2g,KNO33.0g,微量元素1.0mL(MnSO439.9mg,ZnSO4·H2O 42.8mg, (NH4)2MoO4·4H2O 34.7mg,蒸馏水1000mL),NaCl 20.0g(盐度为2%),琼脂15.0g(固体培养基)去离子水定容到1000mL,pH调为8.0,121℃高压蒸汽灭菌20min;
LB培养基:蛋白胨10.0g,酵母提取物5.0g,NaCl 20.0g(盐度为2%),琼脂15.0g(固体培养基),去离子水定容到1000mL,pH值调为8.0, 121℃高压蒸汽灭菌20min;
选择性无机盐液体培养基:无菌条件下,在已灭菌的无机盐培养基中加入一定量芘的丙酮溶液,使其达到预定浓度,置于恒温振荡器上以120r/min的振荡频率振荡24h,待丙酮完全挥发后使用;
选择性无机盐固体培养基:无机盐固体培养基121℃下高压灭菌20min,倒入平板,在其表面涂布芘的丙酮溶液,于超净台上待丙酮完全挥发后使用.
1.4 实验方法
1.4.1 筛选方法 在低于正常室温的10℃低温条件下,采用土壤菌悬液制备——初筛——保存混合菌及分离纯化——复筛——保藏菌株的方法获得芘降解菌群H和单菌DYC-1.
1.4.2 菌株鉴定 表型特征鉴定:参照伯杰氏手册第八版[9]细菌分类学进行相关实验.
分子生物学鉴定:利用16S rDNA 技术对其进行鉴定.采用北京博迈德生物技术有限公司合成的引物,以该菌株基因组DNA为模板,扩增出该菌株16S rDNA序列.PCR扩增反应体系为25μL:2×TaqPCR MasterMix 12.5μL (0.1U Taq Polymerase/μL;500μmol/L dNTP;20mmol/L Tris-H Cl (pH8.3);100mmol/L KCl;3mmol/L MgCl2),引物27F (10μmol/L)1μL,引物1492R (10μmol/ L)1μL,菌液模板1μL,ddH2O 9.5μL,总体积25μL. PCR扩增条件为: 94℃预变性2min;94℃变性30s,55℃复性430s, 72℃延伸1.5min,进行40个循环;最后72℃延伸10min,在4℃下保存.将PCR扩增产物送至测序公司进行纯化测序,测序结束后,将所测基因序列输入到NCBI网站的GenBank数据库中,用BLAST(Basic Local Alignment Search Tool)工具与已登录的16S rDNA序列进行同源性比对,从而确定微生物的种属.使用软件MEGA6.0进行序列同源性分析,构建菌株的系统发育树.
1.4.3 菌株生长曲线的测定 菌悬液的制备:从-20℃冰箱取出保存单菌及菌群的甘油管,分别移出200μL至2瓶灭菌的100mL LB培养基中,在10℃、110r/min的摇床振荡培养48h, 8000r/ min离心10min,弃去LB培养基,用无机盐培养基液洗涤3次,制成OD600=0.8的菌悬液,备用.
本研究采用光密度法测定菌群及单菌的生长曲线.在装有已灭菌的50mL无机盐液体培养基的150mL三角瓶中加入芘的丙酮溶液,使培养基中芘浓度为20mg/L,待丙酮挥发后,准确加入制备好的单菌及菌群的菌悬液2.5mL(接菌量5%),调节pH值为8.0,在温度设置为10℃的恒温振荡器上以110r/min的振荡频率振荡培养.每隔24h取发酵液进行分析,以无机盐培养基作为空白对照,用紫外分光光度计测定其OD600值来表征菌体的生长情况.以发酵液的培养时间为横坐标,以OD600值为纵坐标,绘制菌群及单菌的生长曲线.
1.4.4 芘降解能力的测定 在装有已灭菌的50mL无机盐液体培养基中加入一定量芘的丙酮溶液,使培养基中芘浓度为20mg/L,待丙酮挥发后,准确加入制备好的单菌及菌群的菌悬液2.5mL,设置不加菌作为对照组,调节pH值为8.0,在温度设置为10℃的恒温振荡器上以110r/min的振荡频率振荡培养,以考察菌株对芘的耐受性及降解能力.培养一段时间后,用高效液相色谱法(HPLC)测定芘的降解率,考察菌株降解能力.
1.4.5 高效液相(HPLC)分析水相中残留的芘 样品的前处理:采用高效液相法来分析水相中残留的芘.首先对锥形瓶中的样品进行残留芘的提取(总量50mL,整瓶萃取),加入等体积(50mL)的正己烷,在40Hz下超声萃取30min,静置20min后对有机相进行分离,重复萃取两次,合并有机相.用针管取2mL合并后的有机相,过0.2μm的醋酸铅滤膜后置于安捷伦小瓶中,待HPLC分析.
HPLC测定条件:采用高效液相对安捷伦小瓶中萃取液进行分析,分析仪器为配有自动进样器的德国戴安公司U3000液相色谱仪,色谱柱为PAHs专用高效液相分析柱(安捷伦, 250mm×4.6mm,5μm),流动相为乙腈/水(65:35),流速为1.2mL/min,检测波长为254nm,柱温25℃,进样体积为20μL.
1.4.6 菌株对不同底物的利用能力 准备装有无机盐培养基的三角瓶,分别加入浓度为100mg/L的碳源物质:邻苯二甲酸、菲、芴、苯酚、荧蒽、邻苯二酚、苯并[b]荧蒽、苯并[a]蒽、水杨酸,再分别加入5%菌悬液,在10℃,110r/min的摇床中振荡培养.依据相关研究选择的9种碳源物质(见3.5),每种做3个平行,共27瓶培养基.培养10d,考察红球菌DYC-1对不同底物的利用情况.
1.4.7 降解菌的耐盐特性研究 本研究立足滨海湿地现状,选择2%盐度为筛选菌株条件,并探索筛选出的单菌DYC-1的耐盐特性.
不同NaCl浓度对降解菌生长状况的影响:将DYC-1接种到LB液体培养基中,调整NaCl浓度分别为0%、0.5%、1%、2%、3%、5%、8%、10%、15%、20%,检测菌株是否生长.
降解菌分别在5%、10%、15%盐度条件下的降解效果:将筛选出的单菌DYC-1接种在NaCl浓度分别为5%、10%、15%,芘浓度为20mg/L的无机盐培养基中,观察菌株的生长特性,测定菌株对四环PAHs芘的降解率,考察其对盐的耐受性及对高分子量PAHs的降解能力.
1.4.8 摇瓶降解实验设计 不同初始浓度对芘降解效能的影响:准备150mL的三角瓶,灭菌后在无菌操作台上每瓶加入已灭菌的50mL无机盐培养基,分别加入不同量芘的丙酮溶液,使芘的浓度分别为20,50,80,100,150,200,300,500mg/L,待丙酮挥发后,各加入制备好的菌液2.5mL(接种量为5%),调节pH值为8.0,在温度设置为10℃的恒温振荡器上以110r/min的振荡频率培养,定期取样,测定芘降解率.
pH值变化对降解效果的影响:准备150mL的三角瓶,灭菌后在无菌操作台上每瓶加入已灭菌的50mL无机盐培养基,加入芘的丙酮溶液,使芘的初始浓度为20mg/L,待丙酮挥发后,加入制备好的菌液2.5mL(接种量为5%),调节pH值分别为5.0,6.0,7.0,8.0,9.0,10.0.在温度设置为10℃的恒温振荡器上以110r/min的振荡频率培养,考察菌株DYC-1对芘的降解率.
转速变化对降解效果的影响:由于摇床转速直接反应水中溶解氧的含量,因此在其他条件不变的情况下,以摇床转速来控制溶解氧的含量,设摇床转速分别为80,110,140,170,200r/min,考察红球菌DYC-1对芘的降解能力.
不同接种量对降解效果的影响:在其他条件不变的情况下,将菌悬液按照0.5%、1%、3%、5%、8%、10%、15%的接种量接入到含芘的无机盐培养基中,考察红球菌DYC-1对芘的降解能力.
2 结果与讨论
2.1 筛选驯化菌株过程中反应体系变化情况
锥形瓶中加入PAHs芘作为唯一碳源和能源进行富集培养,15d内培养液颜色出现如下变化:乳白色(透明无色的无机盐培养基加入一定浓度芘后变为乳白色),出现白色混浊,变成淡黄色-最后稳定不变.可能是因为芘的生物降解过程中会产生某种中间产物,而在随后各阶段的富集培养中,变化过程会再次出现且所需时间逐渐缩短,表明微生物的酶体系适应了芘存在的环境,可将其作为生长基质.
2.2 菌株DYC-1的鉴定结果
2.2.1 菌株DYC-1的生理生化实验结果 菌株DYC-1的菌落呈淡黄色,圆形,直径约3mm,表面湿润,不透光,边缘光滑,未向四周扩散.相关实验结果见表2.

表2 红球菌DYC-1生理生化特性Table 2 Physical and biochemical characteristics of Rhodococcus sp. DYC-1
由表2的细菌生理生化反应总特征,相关的文献以及伯杰氏手册[9],初步鉴定筛选出的芘降解单菌为红球菌属.
2.2.2 序列分析与系统发育树构建 采用较易操作的16S rDNA分析方法对菌株进行同源性序列分析.BLAST工具的对比结果表明,实验所用菌种为红球菌(Rhodococcussp.),在GenBank中挑选与DYC-1同源性达99%的菌种,利用MEGA6.0做红球菌DYC-1的基因发育进化树(图1),结果表明DYC-1与红球菌最为接近,说明实验所用的菌种的确为红球菌,课题组将其命名为红球菌DYC-1(Rhodococcussp. DYC-1, GenBank Entry:KR029576;保藏编号:CGMCC 10289).
红球菌属目前被认为是可参与共代谢降解,且能降解芘效果较好的菌属.
2.3 菌株DYC-1及菌群的生长曲线
在10℃,2%盐度条件下筛选出的菌群记为H,菌株DYC-1及菌群H的生长曲线如图2所示.
单菌DYC-1与菌群H的生长曲线趋势大致相同,0~2d为停滞期.单菌DYC-1在3~8d期间处于对数生长期,而菌群H在3~11d期间处于对数生长期.菌群相对于单菌对数期较长,进入稳定期较慢,可能由于不同菌株之间竞争营养元素,拮抗作用所致.也可能由于不同菌株之间的促进作用减缓了衰亡进程,菌群在15d之后进入衰亡期,而单菌DYC-1则衰亡得比较快,在12d之后已经进入衰亡期.
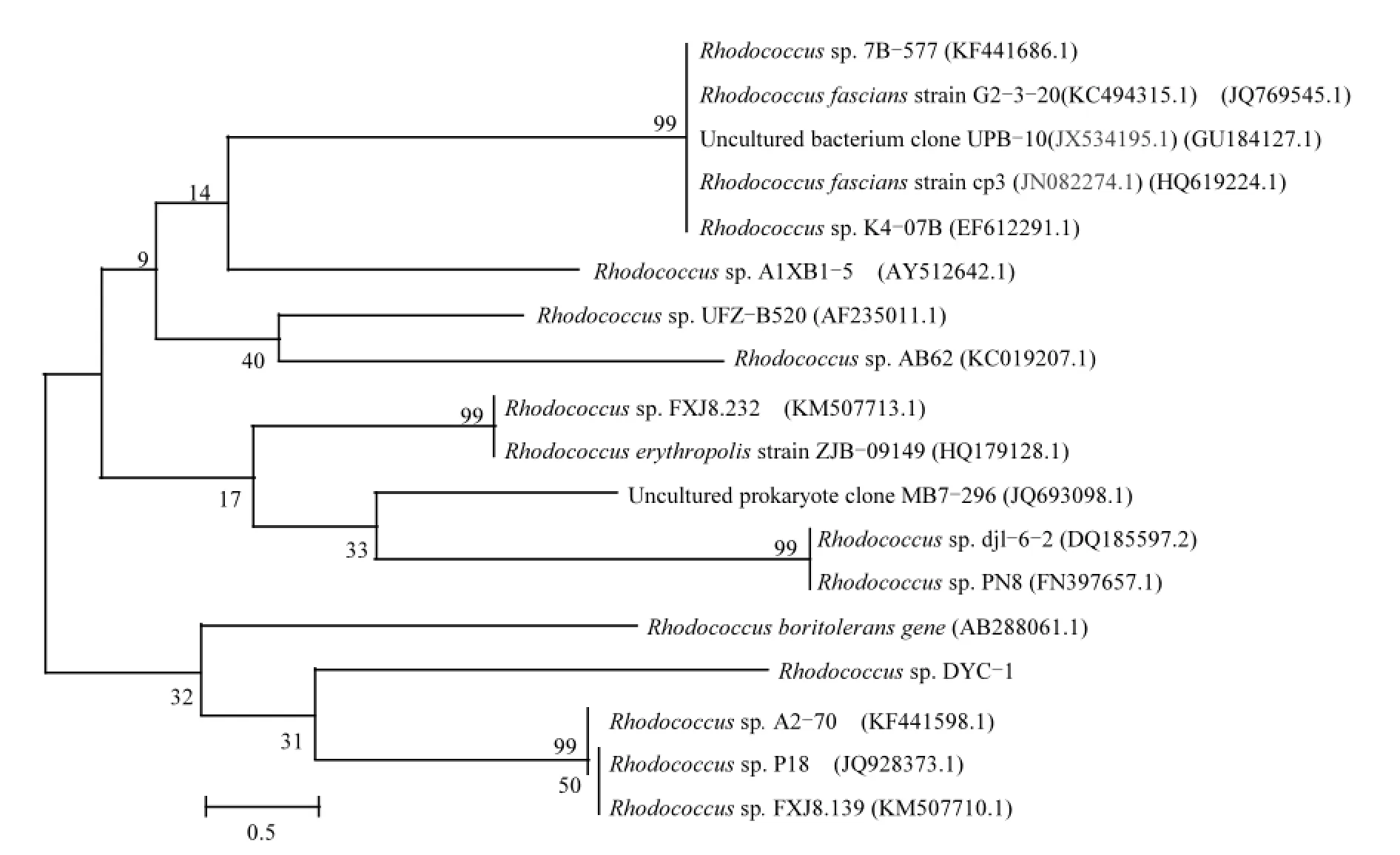
图1 菌株DYC-1系统发育树Fig.1 Phylogenetic tree of Rhodococcus sp. DYC-1
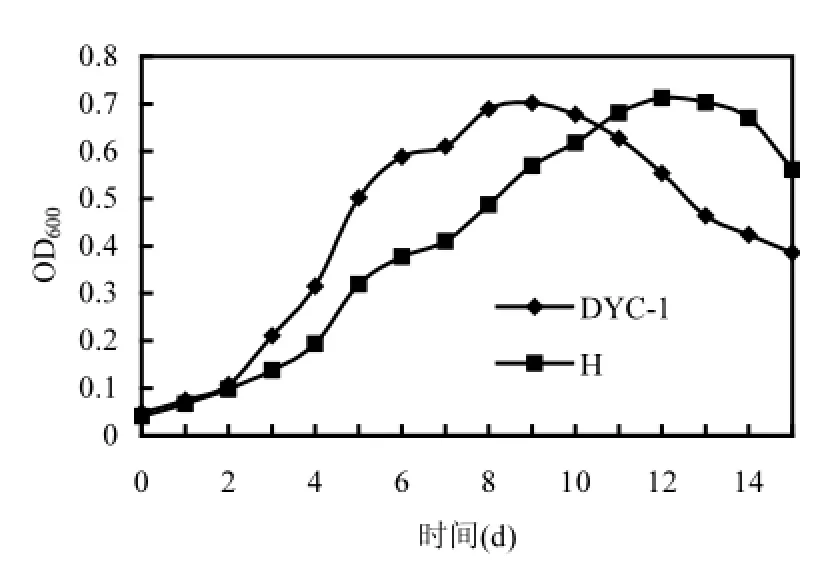
图2 菌株DYC-1及菌群H的生长曲线Fig.2 Growth curve of Rhodococcus sp. DYC-1and mixed culture H
综上所述,如果把菌株用于以后的降解试验时,菌液的发酵时间定为8~11d之间比较合适.
2.4 单菌及菌群对芘的降解能力分析
菌群H由于含多种菌株理论上降解能力会高于单菌,但从图3可以看出,菌群的降解能力与单菌DYC-1的降解能力相当,只是略高于单菌.这可能是由于不同菌株之间拮抗作用所致.因此后续实验中只考察单菌DYC-1对芘的降解情况.
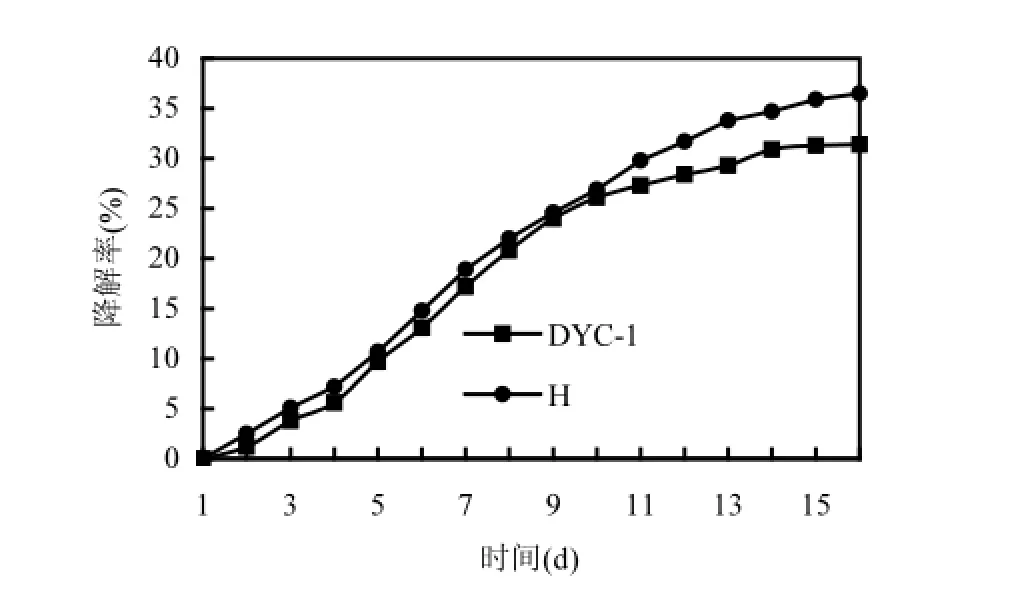
图3 菌株DYC-1及菌群H的降解曲线Fig.3 Degradation curve of Rhodococcus sp. DYC-1and mixed culture H
2.5 菌株对不同底物的利用
考查菌株DYC-1对不同底物利用情况时,因其对四环芳烃芘具有一定降解能力,故分别选定低环芳烃菲、芴,高环芳烃荧蒽、苯并[b]荧蒽、苯并[a]蒽,苯系物苯酚作为底物,而邻苯二甲酸、邻苯二酚、水杨酸均为芘的中间代谢产物[10-12],因而也选定为底物.菌株对不同底物的利用情况见表3.可知,菌株DYC-1对邻苯二甲酸、水杨酸、邻苯二酚都可以降解,可能是由于它们是PAHs代谢中间产物,对菲、芴低环PAHs可以降解,对五环荧蒽也可以降解,但却难以降解苯并[b]荧蒽和苯并[a]蒽.

表3 菌株DYC-1对不同底物的利用情况Table 3 The utilization of different substrates
2.6 不同NaCl浓度对降解菌生长效果的影响
本研究实验样品采自天津滨海湿地石油污染区土壤,滨海盐土的特点是盐分组成单一,以氯化物占绝对优势;土壤表层含盐量多为0.6%~1.0% 部分区域高达2%~3%,除南方滨海地区“咸酸田”呈强酸性反应外,一般pH值为8.0-8.5.天津滨海新区滨海盐土(0~30cm)土壤含盐量大于0.6%的土壤面积占总面积的43.9%[13].因此改变LB培养基的盐度,测试所筛选出的降解菌DYC-1耐盐特性.结果表明,芘降解菌DYC-1在0%~10%的盐度范围内都可以生长,盐度升高至15%时,因OD600数值低于0.02,认定为不能生长,盐度耐受范围相对较宽.
红球菌DYC-1具有较强的耐盐特性,证明它在高盐条件下能够保持酶活,可为其在高盐条件下去除环境中PAHs提供基础生境条件.

表4 菌株DYC-1耐盐特性Table 4 The salt resistance of Rhodococcus sp. DYC-1
2.7 不同盐度条件下菌株DYC-1对芘的降解效果
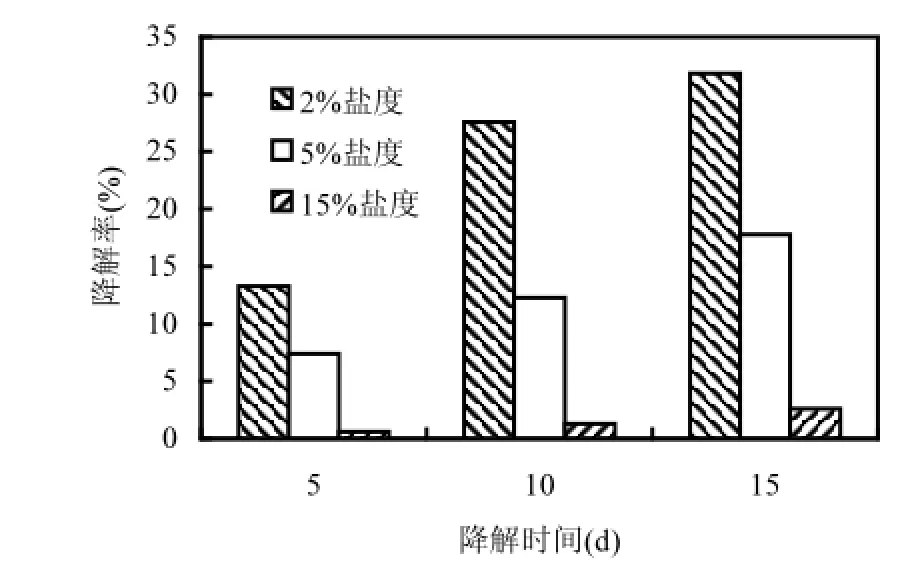
图4 不同盐度条件下菌株对芘的降解Fig.4 The degradation of pyrene in the condition of different salinity
研究表明,菌株对盐分有一定的适应范围,尤其是生长在盐碱土壤中的土著菌[14]. Kushner[15]认为中度嗜盐菌其生长最适NaCl浓度约为3%~15%,韩言柱等[16]分离出一株降解菲的中度嗜盐菌,其在pH中性条件下对菲的降解耐盐性达到15%.有学者发现,当盐度超过3%时,非嗜盐微生物因其代谢受到一定程度的抑制,使得生物修复效率明显降低,甚至丧失修复能力[17].而菌株DYC-1在5%盐度条件下仍表现出不错的降解能力,从而证明菌株DYC-1是一株能高效降解芘的耐盐菌.而当盐度达到15%时,菌株虽能降解芘,但降解能力非常微弱.总体来说,菌株DYC-1具有较好的耐盐性,这可能与其土壤来源有关,土壤取自天津滨海湿地,属于盐渍化土地,对天津滨海盐碱土壤14个样点的土壤盐分测定结果显示,土壤含盐量分布在0.049% ~1.85%之间.
2.8 不同初始浓度对芘降解效果的影响
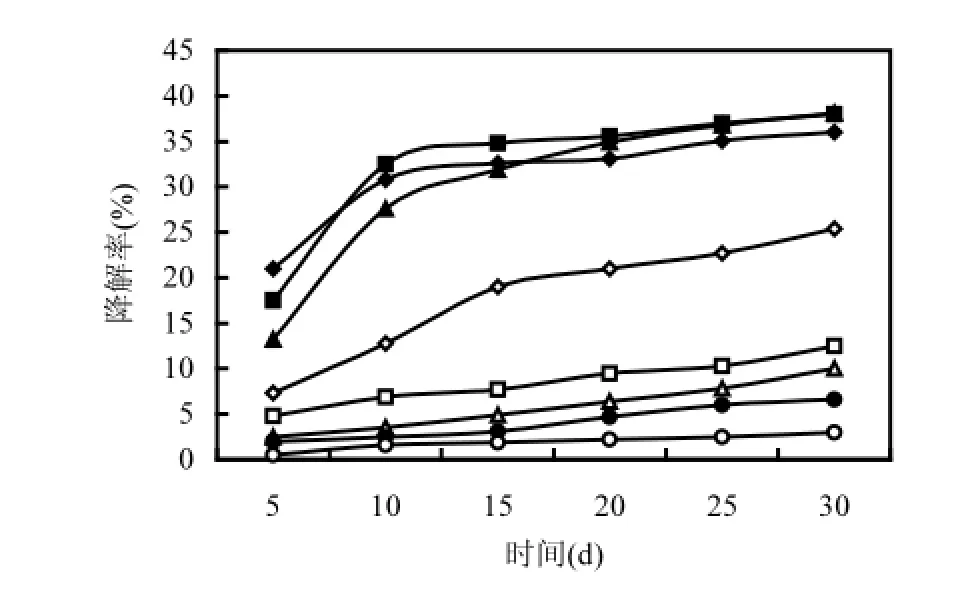
图5 不同初始浓度菌株芘的降解Fig.5 The degradation of pyrene in the condition of different initial concentration
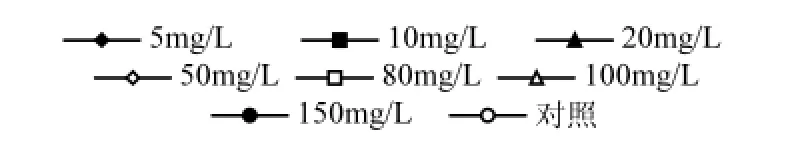
如果菌株能够降解高浓度的污染物,则说明该菌株具有很强的生物降解能力[18].本实验设计了5,10,20,50,80,100,150mg/L共7种浓度的液相好氧降解体系,如图5所示,芘的初始浓度在5,10, 20mg/L时,30d后总降解率虽相差不多,但降解速率却在明显增加,芘浓度为20mg/L时降解率可达到最高38.42%,说明在5~20mg/L的实验范围内,并未出现底物抑制现象,即芘作为唯一碳源和能源还不能完全满足微生物新陈代谢的需要.而当芘的初始浓度达到50mg/L时,降解率随着时间延长而增大,但并没有随着芘浓度的增大而升高,这可能是由于菌株DYC-1是在10℃、盐度为2%、芘的浓度为20mg/L的条件下筛选出来的,低温高盐的条件本就不适于微生物的生长,当芘的浓度升高至50mg/L,微生物降解PAHs的能力受到一定程度的限制.如果继续增大芘的初始浓度,降解率则几乎不增长,随着芘浓度的升高,降解率增更慢,这时的降解率与空白对照(不加微生物的芘无机盐培养基)相差不大,因此降解率多是由于芘的自然挥发所致,则芘的初始浓度高于100mg/L时,微生物无法对芘的降解发挥作用,可能是由于过高浓度的芘对菌株DYC-1产生毒害作用.由于低温耐盐等严苛的筛选条件及实验条件,本研究选定的芘浓度低于马姗姗[18]选定的80mg/L,定为20mg/L.
2.9 不同pH值对降解效果的影响
研究表明,细菌对PAHs降解的最适pH值为中性[14,19]. pH值变化对微生物降解PAHs的影响非常复杂,可以通过影响降解酶的活性还可通过影响氧化还原电位来影响降解率.另外微生物的新陈代谢活动与环境介质的pH值密切相关,在不同的pH值条件下,微生物对营养物质的利用及吸附作用、胞外酶的产生及分泌等均不相同.在其他条件相同的情况下,将无机盐培养基中的初始pH值分别调为5.0、6.0、7.0、8.0、9.0、10.0,分别接入红球菌DYC-1,10℃,110r/min振荡培养15d后测定剩余PAHs含量,计算降解率,结果如图6所示.
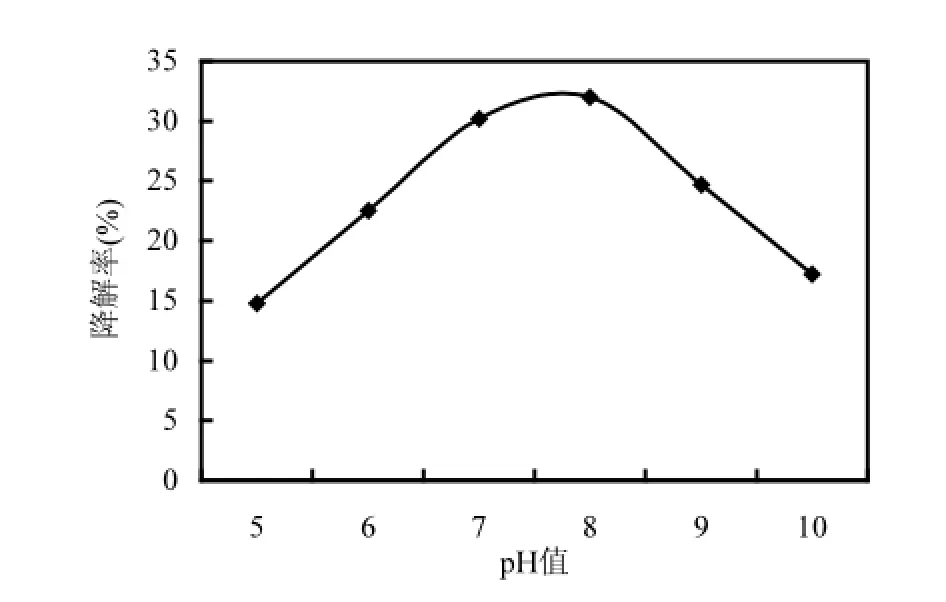
图6 不同pH值条件下菌株对芘的降解Fig.6 The degradation of pyrene in the condition of different pH
从图6可以看出,菌株DYC-1在pH值为7~9的范围内降解PAHs的能力较强,当pH值小于7或者大于9降解能力都明显减弱,这可能是由于每种微生物都有其生长的最适pH值,pH值过高或过低都会影响微生物酶的分泌及活性,从而抑制微生物对PAHs的降解.因此中性或弱碱性条件下最有利于菌株DYC-1发挥对芘的降解作用,本研究中选取pH值为8.
2.10 不同转速对降解效果的影响
由图7所示,随着摇床转速的升高,15d后菌株DYC-1对PAHs的降解率逐渐增高.但从80r/min升高至110r/min时,降解率显著增加,而从110r/min升高至200r/min的过程中降解率变化不大,这可能是由于溶解氧对于微生物降解污染物的促进作用是有一定范围的,当超过了这个范围,即使供氧量继续增加,对降解率的促进作用也是有限的,因此本研究将摇床转速控制为110r/min,既能促进菌株对PAHs的降解,又节省了能源.
图7 转速不同对菌株降解芘的影响Fig.7 The degradation of pyrene in the condition of different oxygen gas content
2.11 不同接种量对降解效果的影响
接种量的大小对缩短菌株在新环境中延滞期有一定作用,降解菌的生物量是影响污染物生物降解效率的重要因素之一[17,20].将菌悬液以不用的接种量接入到含芘的无机盐培养基中,15d后测定芘的降解速率(10℃,110r/min),考察初始不同接种量对菌株DYC-1降解芘的影响,结果见图8.总的来说,接种量与芘的降解率呈正相关:接种量在0.5%~5%之间,芘的降解率随着接种量的增加而增大,但随着接种量的进一步增加,降解率维持在32%左右,变化相差不大.由此可见,生物量的增加与降解率的提高并非呈线性关系,超出一定范围后,接种量的增加反而不利于菌体的新陈代谢及分泌表面活性剂[21].因此本研究选取5%的接种量.
芘作为一种稳定的四环高分子量PAHs,在室温低盐条件下仍然不易降解.段燕青等[22]通过实验证明了米曲霉以芘为单基质代谢时,降解率为33%;一些学者对菌株的选择更地域化,Patel等[23]验证了海洋微藻集胞藻对芘的降解率可达36%,陆泗进等[24]在实验中测定芽孢杆菌B6和假单孢菌B17对芘的降解效果,发现降解率为24.45%和18.77%.而本研究中,在相对低温高盐的环境下,红球菌DYC-1降解高浓度芘仍可达35%以上的降解率.
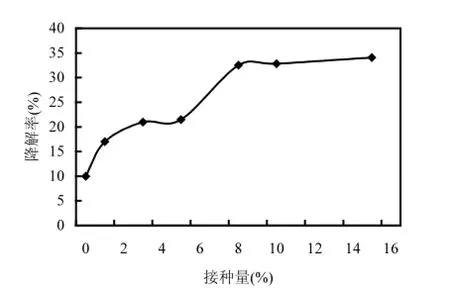
图8 不同接种量对菌株降解芘的影响Fig.8 The degradation of pyrene in the condition of different capacity of bacteria
后续将在改变降解温度或提供并改善共代谢降解环境方面进一步探索,还可对芘的降解途径、产物及芘污染土壤的实际修复效果方面深入开展研究,以期为石油烃污染土壤的生物修复技术提供优势菌株和理论支持.
3 结论
3.1 采用定时定量转接、间歇式逐步提高PAHs浓度的方法,从天津滨海湿地石油污染土壤中获得能以PAHs芘为唯一碳源和能源生长的菌株DYC-1,经生理生化和16S rDNA分析鉴定为红球菌(Rhodococcus sp. DYC-1).
3.2 红球菌DYC-1与菌群H降解能力相似,可能是各菌株之间的拮抗作用导致或者红球菌DYC-1是该菌群中的优势菌株.
3.3 红球菌DYC-1具有较好的耐盐能力,在10%盐度条件下仍可以生长,同时在5%盐度条件下仍可到达20%的芘降解率.
3.4 红球菌DYC-1具有较广的降解底物谱,可以降解低环PAHs菲、芴,可以降解代谢中间产物邻苯二甲酸、水杨酸、邻苯二酚,还可降解五环PAHs荧蒽,具有广泛的降解潜力.
3.5 通过单因素摇瓶实验,得到了菌株DYC-1的最优降解条件:菌株在低温10℃,盐度为2%的条件下,在pH值为8,初始浓度为20mg/L,摇床转速为110r/min,接菌量为5%时,能达到35%以上的降解率.
[1] Hua F, Wang H. Uptake modes of octadecane by Pseudomonas, sp. DG 17and synthesis of biosurfactant [J]. Journal of Applied Microbiology, 2012,112(1):25—37.
[2] Mackay D, Shiu W Y, Ma K C. Illustrated handbook of physical-chemical properties and environmental fate for organic chemicals. Volume 5: pesticide chemicals.[M]// Illustrated handbook of physical-chemical properties and environmental fate for organic chemicals /. Lewis Publishers, 1992:551-552.
[3] 张 旭,李广贺,黄 巍.包气带土层中石油污染物生物降解的温度效应 [J]. 环境科学, 2001,22(4):108-110.
[4] 温桂照,陈 敏.高效优势混合菌降解废水中的氯代芳香族化合物 [J]. 上海环境科学, 2000,(8):379-381.
[5] Whyte L G, Greer C W, Inniss W E. Assessment of the biodegradation potential of psychrotrophic microorganisms. [J]. Canadian Journal of Microbiology, 1996,42(2):99-106.
[6] Deppe U, RichnowH H, Michaelis W, et al. Degradation of crude oil by an arctic microbial consortium[J]. Extremophiles, 2005, 9(6):461-70.
[7] 宋立超,李培军,刘 宛,等.盐碱土壤PAHs降解菌的筛选鉴定及其降解特性 [J]. 微生物学通报, 2011,38(2):282-287.
[8] 张巧巧.芘降解菌株SE12的分离和鉴定及其降解效果研究[D]. 南京:南京农业大学, 2010.
[9] 布瑞德.伯杰氏系统细菌学手册 [M]. 8版.中国:科学出版社(译), 1984.
[10] 钟 鸣,张佳庆,吴小霞,等.芘高效降解菌的分离鉴定及其降解特性 [J]. 应用生态学报, 2010,21:1334-1338.
[11] 巩宗强,李培军,王 新,等.芘在土壤中的共代谢降解研究 [J].应用生态学报, 2001,(3):447-450.
[12] 周 乐,盛下放.芘降解菌株的筛选及降解条件的研究 [J]. 农业环境科学学报, 2006,25(6):1504-1507.
[13] 温 静.天津滨海新区盐碱地景观生态化设计研究 [D]. 保定:河北农业大学, 2008.
[14] 王震宇,赵 建,李锋民,等.盐渍化土壤中土著菌的石油烃降解潜力研究 [J]. 农业环境科学学报, 2009,(7):1416-1421.
[15] D J Kushner. Life in high salt and solute concentrations: halophilic bacteria [J]. Microbial life in extreme environments, 1978:317-368.
[16] 韩言柱,王立成,许学工,等.黄河三角洲土壤(潮土)石油类含量对小麦的影响研究 [J]. 环境科学与技术, 2000,(4):1-4.
[17] 马 静.多环芳烃降解菌的筛选、降解机理及降解性能研究[D]. 大连:大连理工大学, 2013:144.
[18] 马姗姗.一株芘高效降解菌的选育及降解特性、固定化研究[D]. 镇江:江苏科技大学, 2010,52.
[19] 姚治华,王红旗,刘敬奇,等.石油污染土壤中苯降解菌的筛选及降解特性研究 [J]. 农业环境科学学报, 2006,(6):1498-1503.
[20] 杨 乐.石油降解菌群的构建及其生物修复研究 [D]. 石河子:石河子大学, 2008:77.
[21] 谢丹平,尹 华,彭 辉.石油降解菌株的分离及其降解特性研究 [J]. 上海环境科学, 2003,(12):951-954.
[22] 段燕青,岳秀萍,白凡玉,等.耐受重金属的芘降解真菌的筛选及芘降解动力学研究 [J]. 环境工程学报, 2015,9(2):977-982.
[23] Patel J G, Kumar J I N, Kumar R N, et al. Enhancement of pyrene degradation efficacy of Synechocystis sp. by construction of an artificial microalgal-bacterial consortium[J]. Cogent Chemistry, 2015,1(1).
[24] 陆泗进,何立环,孙 聪.两株高效芘降解菌对土壤中芘的降解研究 [J]. 环境科学与管理, 2013,38(5):47-51.
Isolation, identification and analysis of degradation ability of a cold-resistant haloduric pyrene-degrading strains.
DIAO Shuo, WANG Hong-qi*, XU Jie, ZHAO Yi-cun
(College of Water Sciences, Beijing Normal University, Beijing 100875, China). China Environmental Science, 2017,37(2):667~685
The community H and single-strain DYC-1 was isolated by timing quantitative culture and domestication method of adding the concentration of PAHs gradatimfromTianjin coastal wetland petroleumcontaminated soil under the lowtemperature condition. The community H and single-strain DYC-1used pyrene as solo carbon source for growth. The bacteria were identified as Rhodococcus sp. based on the BLAST sequence analysis of 16s rDNA and its morphological and physio-biochemcial characteristics. Analysis results showed that the degrading ability of single-strain DYC-1 was similar to community H under the lowtemperature condition. The degradation rate of themwas above 35% at high concentrations of pyrene. The single-strain DYC-1 had more salt-resisting ability and wide substrate degradation ability. The optimal degradation conditions of single-strain DYC-1 was 2% salinity, pH8, 10℃, 110r/min rotate speed and 5% capacity of bacteria. The degradation rate of pyrene was high with 20mg/L initial concentration in the optimal degradation conditions.
cold-resistant;haloduric;pyrene;degradation;bioremediation
X172
A
1000-6923(2016)02-0677-09
刁 硕(1992-),女,山东荷泽人,北京师范大学硕士研究生,从事污染土壤修复与治理研究.
2016-04-10
国家自然科学基金面上项目(41372232);国家高技术研究发展计划(863)重大课题(2013AA 06A205);中国博士后科学基金第54批面上资助项目
* 责任作者, 教授, whongqi310@sohu.com

