血粉刺激修复DDTs污染农田土壤的现场实验
王 辉,王晓旭,孙丽娜,吴 昊,罗 庆,荣璐阁
(沈阳大学区域污染环境生态修复教育部重点实验室,辽宁沈阳 110044)
血粉刺激修复DDTs污染农田土壤的现场实验
王 辉,王晓旭,孙丽娜*,吴 昊,罗 庆,荣璐阁
(沈阳大学区域污染环境生态修复教育部重点实验室,辽宁沈阳 110044)
通过田间现场实验,研究了血粉激活土著微生物修复DDTs污染老化农田土壤的修复效果以及不同条件对血粉修复效果的影响,分析了DDTs 4种主要的同分异构体/同系物的降解特征.结果表明,添加血粉刺激土著微生物原位修复DDTs污染老化农田是切实可行的.与葡萄糖相比,血粉可以长期、有效的提高土壤过氧化氢酶和转化酶活性,进而刺激土著微生物更好的修复DDTs污染土壤.添加血粉辅以定期翻土后,DDTs的5个月降解效率提高到43.41%,同时PP’-DDE去除效果较好,环境风险得到显著降低.结果表明添加血粉辅以定期翻土在DDTs污染农田土壤原位修复中具有较大的应用前景.
血粉;滴滴涕;现场试验;老化污染农田土壤;生物刺激
由于滴滴涕(DDTs)具有难降解性、生物富集性,并对人类和其他生物具有潜在的毒性[1-2],所以DDTs污染倍受人们的关注[3].DDTs作为斯德哥尔摩大会首批提出的12种禁止使用的持久性有机污染物之一,1983年开始禁止作为农药使用,但直到2003年前仍被作为原材料大量生产[4-6].同时由于可以随着环境介质的变迁进行长距离的迁移[7],DDTs在各国的土壤中检出率很高[8-10].在沈阳市城郊土壤中DDTs污染的现象也是普遍存在的.通过调查发现沈阳市细河沿岸表层土壤中DDTs 浓度范围分别为9.06~111.6μg/ kg,平均浓度为37.08μg/kg[11].通过对沈阳郊区21个表层土壤样品中OC Ps的含量进行测定,在18个点位检出DDTs,存在一定的生态风险[12].虽然DDTs污染浓度相对不高,但DDTs污染是沈阳市城郊农田土壤普遍面临的一个生态环境问题,且DDTs具有较高的富集系数,对周边居民存在潜在的风险,因此急需对DDTs污染农田土壤进行修复研究.对于DDTs污染修复的研究国内外开展的较早,但相关研究多在实验室进行,与实际修复应用存在一定的差异,研究结果很难实际应用到修复工程中,对实际修复工程参考价值有限.同时农田土壤污染具有污染面积大、污染物浓度相对较低等特点,因此较适合使用原位刺激法进行修复.血粉作为一种非常规动物源性饲料,其粗蛋白含量可达80%~90%,高于鱼粉和肉粉.血粉中赖氨酸和亮氨酸,以及缬氨酸、组氨酸、苯丙氨酸、色氨酸的含量都很丰富,这些物质可以刺激土壤中微生物的增殖,进而促进污染物的降解.血粉作为一种微生物刺激物在美国已经开始用于异位处理八氯莰烯和DDTs的POPs污染土壤的生物修复,并取得了良好的修复效果[13].同时由于血粉可作为动物饲料无毒害作用,可以在污染农田土壤修复中作为一种微生物刺激物使用.
因此本研究选择原位刺激法,探讨使用血粉作为一种生物刺激添加物进行DDTs污染农田土壤原位修复的可能性.本研究在田间开展血粉刺激土著微生物修复DDTs污染试验,并对调整CNP比和定期翻土对于添加血粉修复效果和DDTs的同分异构体/同系物的降解影响进行研究,为促进我国农田土壤有机污染的修复提供科学依据和技术支撑.
1 材料和方法
1.1 试验材料和仪器
实验材料:葡萄糖购置于天津博迪化工股份有限公司;血粉购置于贵州金万和农业科技有限公司;分析纯正己烷和丙酮购置于天津市富宇精细化工有限公司;色谱纯正己烷购置于山东禹王实业有限公司化工分公司;DDTs标样(p,p’-DDE, p,p’-DDD,o,p’-DDT, p,p’-DDT)购置于百灵威科技有限公司.
实验仪器:加速溶剂萃取仪ASE300,购置于戴安中国有限公司;气相色谱CP-3800,购置于美国VARIAN INC.
1.2 修复现场与试验设计
现场试验在沈阳市沈北新区前进农场D3号大棚内开展,地理坐标为42°05′02.62″N, 123°31′42.79″E.在实验开始前,使用农机对土壤耕作层(0~20cm)进行翻土,使修复区域土壤混合均匀.把经平整混匀后的修复场地划分为1m×1m的地块,以便后期进行不同的实验操作.经测定土壤有机质含量为5.437%,阳离子交换量为13.09cmol/kg.使用Mastersizer 2000激光粒度仪对土壤粒径分布进行测定,其粘粒、粉粒和砂粒所占比例分别为 26.11%、72.82%、1.07%,对照国际制土壤质地分级标准,其土壤类型为粉砂质粘土,其pH值为6.87~7.17.供试土壤中DDTs的含量为47.94μg/kg.
为确保实验数据的准确性和可信性,每个实验操作设置3个平行样,本研究中所有结果均为3个平行样的算术平均值.在本修复试验中共设计以下3组试验:(1)不同添加物刺激土著微生物修复DDTs试验:分别以5g血粉(X 5)、5g葡萄糖(T5)为添加物,添加到土壤耕作层中混合均匀,用于激活土著微生物活性,强化其修复土壤中的DDTs的能力,同时设置空白对照组(CK)研究血粉作为添加物对土壤中DDTs降解效果的影响.(2)调整碳氮磷比和定期翻土对土著微生物修复DDTs的影响:在添加5g血粉的基础上,以磷酸钠作为P源,硫酸铵作为N源添加到土壤耕作层中混合均匀,调整土壤C:N:P为100:15:1,作为调整C:N:P比组(X5NP),研究调整C:N:P比对于血粉刺激土著微生物修复DDTs效率的影响;在添加5g血粉的基础上,每周对土壤耕作层进行翻土,研究定期翻土(X5F)对于血粉刺激土著微生物修复DDTs效率的影响.(3)不同条件下DDTs同分异构体/同系物的降解特征研究:对比空白对照组(CK)、调整C:N:P比(X5NP)、定期翻土(X5F)中DDTs主要的同分异构体/同系物(p,p’-DDE, p,p’-DDD,o,p’-DDT, p,p’-DDT)的降解情况.
对每块实验场地采用对角线采样法进行土壤样品的采集,采样深度为耕作层.分别对各地块与初始时间、处理1个月、3个月、5个月后采集土壤样品,土壤样品风干后去除植物残渣和石块等杂物,经粉碎研磨后过60目筛待测.
1.3 样品的测定
精确称取5.00g风干粉碎并过60目筛的土壤样品,使用加速溶剂萃取仪(ASE300)进行萃取,萃取液为1:1(V:V)的正己烷和丙酮的混合液[14].萃取后的溶液参照《土壤中六六六和滴滴涕测定的气相色谱法(GB/T 14550-2003)》[15]使用浓硫酸磺化法对萃取液进行净化,然后使用氮吹法使样品近干后,用色谱纯正己烷定容到1mL后转移到气相进样瓶中待测.
使用气相色谱仪对土壤中DDTs含量进行测定,气相色谱分析条件:色谱柱为CP-sill 8CB型石英毛细管柱(30m×0.32mm×0.25um);色谱柱升温程序:初始温度120℃并保持1min,以25℃/min升至230℃,再以3℃/min升至255℃,最后以20℃/min升至280℃保持5min,进样口温度250℃,检测器温度300℃.载气、辅助气均为氮气,纯度为99.99%,载气流速为0.6mL/min(恒流).进样方式:脉冲不分流进样,脉冲压力为276kPa、保持0.75min,进样量1uL;尾吹30mL/min.以保留时间定性,外标法定量.
样品在测试过程中进行空白样品和基质加标回收率测定,方法回收率为89.2%~107.1%.在测试过程中随机抽取样品进行重复测试,当重复测试误差大于10%时,需对设备进行调试和校正.
1.4 土壤酶活性的测定
为了研究不同添加物对土壤中微生物活性的影响,土壤样品经风干后测定其中的过氧化氢酶和转化酶活性,每个样品设置3个平行样[16].过氧化氢酶使用KMnO4滴定法[17].将3g土样加入40mL蒸馏水后,再加入5mL H2O2(1%)25℃下反应20min,然后加入5mL 3mol/L H2SO4用以固定未分解的H2O2[18],最后用0.02mol/L KMnO4标准溶液进行滴定[16,19],过氧化氢酶活性用消耗的KMnO4标准溶液体积表示.转化酶活性使用分光光度法测定[17].首先把0.2mL甲苯加入到3g土样中在25℃下反应15min,然后加入15mL糖溶液(18%)和5mL磷酸-柠檬酸缓冲液(pH5.5) ,在30℃下反应24h,过滤待测[18].在50mL比色管中移入1mL滤液后添加3mL3,5-二硝基水杨酸后在水浴锅中加热5min,冷却后使用分光光度计(CARY50,美国VARIAN)在波长508nm下进行测定.
2 结果和讨论
2.1 添加营养物对土著微生物修复DDTs的影响
微生物分布广泛、代谢类型丰富、适应突变能力强,任何存在污染的地方都有相应降解作用强弱不一的降解微生物[20].大量研究者也分别从土壤中分离出了DDTs降解微生物,如:铜绿假单胞菌的DDTs降解菌DH-7[21]、白腐真菌Phlebia lindtneriGB1027[22]、产碱菌属的DDT高效降解细菌KK[20]、短波单胞菌属的细菌W-1[23],以及共代谢降解DDT的Pseudomonassp.菌[24]和ITRC-4[25].这些研究表明土壤中广泛存在DDT降解微生物.在本研究中,对照组(CK)、添加血粉组(X5)、添加葡萄糖组(T5)修复修复1个月、3个月、5个月后土壤样品中DDTs的降解率见图1.与CK相比较,X5和T5组土壤中DDTs降解率显著提高,这证明了土壤中含有可以降解DDTs的微生物,添加营养物刺激土著微生物原位修复DDTs污染是切实可行的.
修复1个月后T5组平均降解率最高,而从第1个月到第5个月T5组降解率增长幅度较小,仅增长了1.76%,而X5组降解率同期增长了12.08%,修复3个月和5个月后,X5组DDTs降解率明显高于T5组.葡萄糖是一种可以被微生物快速利用的营养物质,添加到土壤中会刺激土著微生物较快的大量增加,而大量增加的微生物数量使得土壤中DDTs的降解率显著增加,因此修复1个月后T5组土壤中DDTs的降解率最高.但葡萄糖的溶解度较高,在修复过程中会由于灌溉等原因大量流失,进而导致土壤中微生物由于营养物质缺乏而数量减少,因而第1个月到第5个月T5组降解率增长幅度较小,降解率增长与CK组接近.而血粉为颗粒状,在水中溶解性差,可以较好的吸附到土壤颗粒中,不易随土壤溶液所流失,能够较稳定的促进土壤中微生物的生长.这可能是造成X5组土壤中DDTs的浓度持续降低,修复3个月和5个月后,X5组DDTs降解率明显高于T5组的重要原因.

图1 添加不同添加物修复土壤中DDTs的降解率Fig.1 The degradation rate of DDTs in different conditions

图2 添加不同添加物后土壤酶活性Fig.2 The soil enzyme activities in different conditions
为了进一步分析不同添加物对土壤中DDTs降解差异的原因,以土壤过氧化氢酶和转化酶活性为代表对土壤中微生物活性进行了研究,结果见图2.从图2中可以看出,添加血粉和葡萄糖后,土壤过氧化氢酶和转化酶活性均有显著提高,土壤微生物活性得到显著提升.土壤过氧化氢酶和转化酶活性在一个月达到最大值,然后开始降低,但X5组酶活性的降低速度明显低于T5组,即与葡萄糖相比较,血粉能够更长效的刺激土著微生物提高其活性,更有利于土著微生物修复DDTs污染土壤.
综上所述,添加血粉可以有效的提高土著微生物活性,刺激土著微生物降解土壤中的DDTs,其修复效果优于添加葡萄糖的降解效果.
2.2 不同条件对血粉原位刺激修复土壤中DDTs的影响

图3 不同条件下血粉原位刺激修复后土壤中DDTs浓度Fig.3 The concentration of DDTs in the soil after remediation using blood meal in different conditions
N、P是微生物生长的必须元素,对微生物的生长情况和微生物活性具有较大的影响,而定期翻土能够提高土壤中氧含量,有利于好氧微生物的生存,同时由于修复实验是在大棚中进行,温度相对稳定,因此在研究不同条件对血粉原位刺激修复土壤中DDTs的影响中主要考察了调整C:N:P比和定期翻土的影响.调整C:N:P比组(X5NP)、定期翻土(X5F)组和添加血粉组(X5)修复后土壤中DDTs残留浓度见图3.X5、X5NP、X5F组处理后,土壤中DDTs的浓度均有所下降,5个月后土壤中残留量分别为(32.51±3.44)、(33.12±2.97)和(27.13±2.72)µg/kg,平均降解率分别为32.18%、30.91%、43.41%.处理1个月、3个月、5个月后,土壤中DDTs浓度在X5F组浓度均最低,X5NP和X5组浓度相差较小,即在定期翻土处理中DDTs的降解效率最高.综上所述,定期翻土起到土壤通气的作用,有利于土壤中空气流通,而空气中的氧气可以作为污染物氧化分解的最终电子受体[26],同时土壤微生物活性得到显著提高,为土著微生物在好氧状态下分解DDTs创造了有利环境,这在一定程度上对于DDTs的微生物降解起到了促进作用.
为确定调整C:N:P比或定期翻土对于血粉刺激土著微生物修复DDTs效率是否存在显著影响,将调整C:N:P比、定期翻土条件下血粉刺激土著微生物修复5个月后土壤中DDTs浓度与对照组进行成对的T检验,T检验结果见表1.在成对的T检验中,X5NP-X5之间的Sig值大于0.05,说明X5NP和X5组修复后土壤中DDTs浓度无显著差异,即调整C:N:P比并没有显著的提高土著微生物修复DDTs的效率; X5F—X5之间的Sig值小于0.05,说明X5F和X5组修复后土壤中DDTs浓度差异显著,同时X5F处理后土壤中DDTs浓度较低,即定期翻土可以显著提高血粉刺激土著微生物修复土壤中DDTs的效率;X5F—X5NP之间的Sig值小于0.05,说明X5F和X5NP组修复后土壤中DDTs浓度差异显著,同时X5F处理后土壤中DDTs浓度较低,即与调整C:N:P比相比,定期翻土可以显著提高血粉刺激土著微生物修复的效率.综上所述,调整C:N:P比没有显著的提高土著微生物修复DDTs的效率,而定期翻土可以显著提高血粉刺激土著微生物修复土壤中DDTs的效率,因此在修复现场可以在添加血粉刺激土著微生物修复土壤中DDTs的同时辅以定期翻土以提高修复效率,修复5个月后平均降解率可达43.41%.
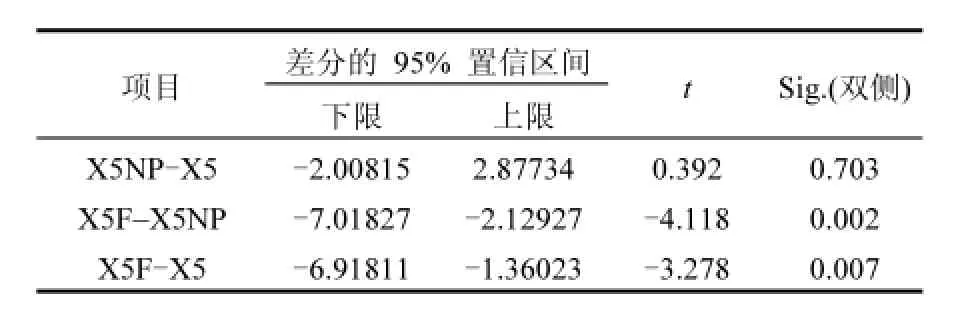
表1 不同条件下血粉原位刺激修复5个月后土壤中DDTs浓度的T检验结果Table 1 The result of T test on the DDTs concentration after five month remediation using blood meal in different conditions
2.3 不同条件下土壤中DDTs同分异构体/同系物的降解情况
添加不同营养物、调整C:N:P比、定期翻土修复后,土壤中DDTs主要同分异构体/同系物(p,p’-DDE、p,p’-DDD、o,p’-DDT、p,p’-DDT)平均残留浓度见图4.由图4a中可以看出土壤中p,p’-DDT残留浓度随着降解时间的增加不断降低,T5组从第1个月后降解速度显著降低,X5NP和X5F组中p,p’-DDT残留浓度较低,但X5NP组从第3个月后p,p’-DDT残留浓度趋于平衡,与X5组对比可以看出调整C:N:P比和定期翻土在血粉作为投加营养源的情况下可以加快p,p’-DDT的降解.图4b为不同条件下土壤中o,p’-DDT残留浓度,不同条件对o,p’-DDT降解情况的影响与p,p’-DDT相类似,但不同处理的影响程度不同,其中定期翻土在血粉作为投加营养源的情况下对o,p’-DDT降解情况的影响最为显著,能够明显加快o,p’-DDT的降解.图4c为不同条件下土壤中p,p’-DDD残留浓度图,与其它组分相比, p,p’-DDD浓度下降较缓慢,这主要是由于DDD在厌氧条件下易于还原脱氯成DDMS和DDNU[27],而耕作层以好氧条件为主,不利于DDD的进一步降解,因此不同条件下土壤中p,p’-DDD浓度下降较缓慢.图4d为不同条件下土壤中p,p’-DDE残留浓度图,与o,p’-DDT、p,p’-DDT相比较, p,p’-DDE残留浓度降低幅度相对较低,这主要是由于p,p’-DDT在好氧环境(耕作层)中主要降解为p,p’-DDE[23],生成的p,p’-DDE不断补充土壤中降解掉的p,p’-DDE,因此使得土壤中p,p’-DDE浓度下降较慢. p,p’-DDE在环境中持久性更强[28],同时p,p’-DDE在水中溶解度(0.12mg/L)大于p,p’-DDT溶解度(0.025mg/L)[29],当p,p’-DDT降解为p,p’-DDE后其更易于随着食物链进行富集,对人体和其他生物的危害性更大,因此去除环境中残留的p,p’-DDE比p,p’-DDT 更加重要.对比不同条件下土壤中p,p’-DDE残留浓度可以看出X5F组中残留浓度最低,因此添加血粉辅以定期翻土的条件下刺激土著微生物修复土壤中DDTs的修复效果最好,同时修复后的环境风险也较小.

图4 不同处理对土壤中DDTs主要同分异构体/同系物平均残留量的影响Fig.4 The effect on the concentration of DDTs isomers and homologues in different conditions
3 结论
3.1 土壤中含有可以降解DDTs的微生物,添加营养物刺激土著微生物原位修复DDTs污染是切实可行的.
3.2 葡萄糖可以在短时间内刺激土著微生物数量迅速增加,但同时葡萄糖易于流失导致降解效果显著降低;血粉可以吸附到土壤颗粒中稳定存在,添加血粉可以长期、有效的提高土壤过氧化氢酶和转化酶活性,刺激土著微生物修复DDTs污染土壤.
3.3 添加血粉刺激土著微生物修复土壤中DDTs污染时,调整C:N:P比对提高土著微生物修复DDTs的效率影响不显著,而定期翻土可以显著提高土壤酶活性,使5个月DDTs降解率达到43.41%,同时对于土壤中p,p’-DDE去除效果较好,有利于降低DDTs和场地修复后的环境风险,在实际修复场地中具有较好的应用前景.
[1] Li F B, Li X M, Zhou S G, et al. Enhanced reductive chlorination of DDT in an anaerobic systemof dissimilatory ironreducing bacteria and iron oxide [J]. Environmental Pollution, 2010,158: 1733-1740.
[2] Hinck J E, NorstromR J, Orazio C E, et al. Persistence of organochlorine chemical residues in fish fromthe Tombigbee River (Alabama, USA): continuing risk to wildlife froma former DDT manufacturing facility [J]. Environmental Pollution, 2009, 157:582-591.
[3] El-Temsah Y S, Oughton D H, Joner E J. Effects of nano-sized zero-valent iron on DDT degradation and residual toxicity in soil: a column experiment [J]. Plant and Soil, 2013,368:189-200.
[4] Calle E E, Frumkin H, Henley S J, et al. Organochlorines and breast cancer risk [J]. CA: A Cancer Journal for Clinicians, 2002, 52(5):301-309.
[5] Tang ML, Zhao MR, Zhou S S, et al. Assessing the underlying breast cancer risk of Chinese females contributed by dietary intake of residual DDT fromagricultural soils [J]. Environment International, 2014,73:208-215.
[6] Wang F, Jiang X, Bian Y R, et al. Organochlorine pesticides in soils under different land usage in the Taihu Lake region, China [J]. journal of environmental sciences-China, 2007,19(5):584-590.
[7] Cheng D X, Yu J T, W ang T T, et al. Adsorption characteristics and mechanisms of organochlorine pesticide DDT on farmland soils [J]. Polish Journal of Environmental Studies, 2014,23(5):1527-1535.
[8] Feng X, Li J, Teng Y G, et al. Residues and health risk assessment of organochlorine pesticides in soils on the Shore of Songhua River in Jilin city, China [J]. Environmental Chemistry, 2011,30(9):1604-1610.
[9] Gonzalez M, Miglioranza K S, Aizpun J E, et al. Assessing pesticide leaching and desorption in soils with different agricultural activities fromArgentina (Pampa and Patagonia) [J]. Chemosphere, 2010,81(3):351-358.
[10] Crowe A S, Smith J E. Distribution and persistence of DDT in soil at a sand dune-marsh environment: Point Pelee [J]. Canadian Journal of Soil Science, 2007,87(3):315-327.
[11] 薛 源,杨永亮,万奎元,等.沈阳市细河周边农田土壤和大气中有机氯农药和多氯联苯初步研究 [J]. 岩矿测试, 2011,30(1): 27-32.
[12] 崔 健,王晓光,都基众,等.沈阳郊区表层土壤有机氯农药残留特征及风险评价 [J]. 中国地质, 2014,41(5):1705-1715.
[13] US-EPA. Anaerobic Bioremediation Using Blood Meal for Treatment of Toxaphene in Soil and Sediment [EB/OL]. https://clu-in.org/download/remed/542r05006/blood_meal.pdf2012-10-3.
[14] 张 岩,张景发,陈艳梅,等.加速溶剂萃取-气相色谱法测定土壤中有机氯农药和多氯联苯 [J]. 岩矿测试, 2010,29(5):491-496.
[15] GB/T 14550-2003土壤中六六六和滴滴涕测定的气相色谱法[S].
[16] Wang W W, Page-Dumroese D, Lv R H, et al. Soil Enzyme Activities in Pinus tabuliformis (Carriére) Plantations in Northern China [J]. Forests, 2016,7:112-123.
[17] 许光辉,郑洪元.土壤微生物分析方法手册 [M]. 北京:农业出版社, 1986:251-269.
[18] Wang C P, Yu L, Zhang Z Y, et al. Tourmaline combined with phanerochaete chrysosporiumto remediateagricultural soil contaminated with PAHs and OC Ps [J]. Journal of Hazardous Materials, 2014,264:439–448.
[19] Trasar-Cepeda C, Camina F, Leiros MC, et al. An improved method to measure catalase activity in soils [J]. Soil Biology & Biochemistry, 1999,31:483–485.
[20] 徐琦峰.DDT降解细菌KK的分离鉴定及其降解特性研究 [D].泰安:山东农业大学, 2008.
[21] 李红权,马珦玻,李红梅,等.DDT降解菌DH-7的分离鉴定与降解特性研究 [J]. 安徽农业科学, 2009,37(13):5851-5852,5863.
[22] 肖鹏飞,李玉文,KONDO R. Tween60 和SDS强化白腐真菌修复DDT污染土壤 [J]. 中国环境科学, 2015,35(12):3737-3743.
[23] 顾立锋,何 健,张明星,等.DDT降解细菌W-1的分离鉴定及其降解特性研究 [J]. 农业环境科学学报, 2007,26(2):568-571.
[24] Chandrappa MK, Harichandra Z N. Biodegradation of DDT by a Pseudomonas Species [J]. Current Microbiology, 2004,48:10-13.
[25] Rajiv A, Ashwani K. Metabolismof DDT 1,1,1-Trichloro-2, 2-bis(4-chlorophenyl)ethane by Alcaligenes denitrificans ITRC-4Under Aerobic and Anaerobic Conditions [J]. Current Microbiology, 2003,44:65-69.
[26] 杨乐巍.土壤通气-微生物降解耦合修复现场石油烃污染土壤研究 [D]. 天津:天津大学, 2010.
[27] 洪 青,蒋 新,李顺鹏.微生物降解DDT研究进展 [J]. 土壤, 2008,40(3):329-334.
[28] 谢 慧.土壤中DDT和DDE的生物强化降解及对土壤微生物群落结构的影响 [D]. 泰安:山东农业大学, 2013.
[29] Wang X T, Chu S G, Xu X B. Organochlorine pesticide residues in water fromGuanting reservoir and Yongding River, china [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 70:351-358.
致谢:本实验的样品采集和分析工作由沈阳大学区域污染环境生态修复教育部重点实验室全体实验员老师等协助完成,在此表示感谢.
Field test on biostimu lation to remediation DDTs in contaminated farmland soil using b lood meal.
WANG Hui,WANG Xiao-xu, SUN Li-na*, WU Hao, LUO Qing, RONG Lu-ge
(Key Laboratory of Regional Environment and Eco-remediation, Ministry of Education, Shenyang University, Shenyang 110044, China). China Environmental Science, 2017,37(2):654~660
The remediation effect of DDTs in aged contaminated farmland soil using blood meal was investigated in the field test. Meanwhile, the effects of remediation conditions and degradation characteristics of DDTs isomers and homologues were studied in this paper. The results showed that the method of biostimulation using blood meal was a practical way to remediate the DDTs aged contaminated farmland soil. Compared with glucose, the blood meal was a long termeffective method on stimulating indigenous microorganisms to degrade DDTs in the soil, and the soil catalase activity and invertase activity were greatly improved. To plowthe land once a week was helpful to remediate the contaminated soil by biostimulating using blood meal. At the same time, as the high toxicity homologues DDTs, PP’-DDE was effectively degraded, and the potential environmental risks reduced significantly. Hence, the present study demonstrated that biostimulation using blood meal supplemented by plowing the soil once a week had the great potential application for remediating the DDTs contaminated farmland soil.
blood meal;DDTs;field test;aged contaminated farmland soil;biostimulation
X53
A
1000-6923(2017)02-0654-07
王 辉(1981-),男,辽宁辽阳人,副教授,博士,主要从事污染修复和环境评价研究.发表论文10余篇.
2016-06-19
国家重点基础研究发展计划项目 (2014CB441106);沈阳市科学事业费竞争性选择项目(城市生态环境风险管理及其修复技术研究);沈阳市科技计划项目(F14-133-9-00)
* 责任作者, 教授, Sln629@163.com

