抑毒调肝合剂抗大鼠肝纤维化的作用及机制研究Δ
罗宏丽,肖顺林,余欣(西南医科大学附属医院药学部,四川 泸州 646000)
抑毒调肝合剂抗大鼠肝纤维化的作用及机制研究Δ
罗宏丽*,肖顺林,余欣(西南医科大学附属医院药学部,四川 泸州 646000)
目的:研究抑毒调肝合剂抗大鼠肝纤维化的作用及机制。方法:将60只SD大鼠随机分为正常组、模型组、秋水仙碱组(阳性对照,0.2 mg/kg)和抑毒调肝合剂低、中、高剂量组(2.7、5.4、10.8 mL/kg)。除正常组外,其余各组大鼠均复制肝纤维化模型,并于造模同时ig相应药物,每天1次,连续8周。检测大鼠血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)、基质金属蛋白酶组织抑制因子1(TIMP-1)、基质金属蛋白酶1(MMP-1)、MMP-2、MMP-13、转化生长因子β1(TGF-β1)、肿瘤坏死因子α(TNF-α)水平和肝组织中羟脯氨酸(Hyp)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、TGF-β1、TNF-α水平。结果:与正常组比较,模型组大鼠血清中ALT、AST、HA、PCⅢ、CⅣ、TIMP-1、MMP-2、TGF-β1、TNF-α水平显著升高,MMP-1、MMP-13水平显著降低(P<0.05);肝组织中Hyp、TGF-β1、TNF-α、MDA水平显著升高,SOD、GSH-Px、CAT水平显著降低(P<0.05)。与模型组比较,抑毒调肝合剂中、高剂量组和秋水仙碱组大鼠血清中ALT、AST、HA、PCⅢ、CⅣ、TIMP-1、TNF-α水平以及肝组织中Hyp、TGF-β1、TNF-α、MDA水平均显著降低(P<0.05);抑毒调肝合剂高剂量组和秋水仙碱组大鼠血清中MMP-1、MMP-13水平以及肝组织中CAT水平均显著升高(P<0.05),且血清中MMP-2、TGF-β1水平显著降低(P<0.05);抑毒调肝合剂低剂量组大鼠上述指标差异均无统计学意义(P>0.05)。结论:抑毒调肝合剂抗大鼠肝纤维化的作用机制可能与调节TIMP/MMP平衡、抗氧化应激、降低TGF-β1水平和减少细胞外基质沉积有关。
抑毒调肝合剂;肝纤维化;大鼠
肝纤维化是多种慢性肝病共有的病理变化,表现为以胶原为主的细胞外基质(Extracellular matrix,ECM)在肝脏内的过度沉积[1]。研究证实,通过积极有效地对原发病和肝纤维化进行治疗可预防肝纤维化发展为肝硬化或肝癌[2],因此肝纤维化的早期诊断和有效治疗显得尤其重要。由于肝纤维化的行成过程具有多因素、多步骤、多环节的特征,虽然临床上也使用秋水仙碱、青霉胺等药物进行治疗,但毒副作用大,其治疗方法尚未有突破。而中药具有多靶点、多环节、多层次的作用特点,近年来中药单味及复方制剂在抗肝纤维化治疗中已显示出明显优势[3-4]。抑毒调肝合剂是由西南医科大学附属医院自主研发生产的医院制剂,由虎杖、丹参、党参、绵马贯众、黄精等5味中药材组成,在临床主要用于治疗慢性肝炎,症见疲乏无力、不思饮食、肝区隐痛、自汗者,但在肝纤维化方面应用较少。笔者在前期研究中已对该方的制剂工艺进行了优化,建立了其质量标准,并证实了其具有一定抗肝纤维化作用[5-6],但具体作用机制尚不明确。本研究在此基础上进一步探讨抑毒调肝合剂对大鼠肝纤维化的作用机制,为其临床合理用药提供实验依据。
1 材料
1.1 仪器
KS604721放射免疫分析仪(北京科思佳科技有限责任公司);FA1004电子分析天平(上海精科天平厂);AMS-18A全自动生化分析仪(北京奥普森科技有限公司);MK3酶标仪[热电(上海)仪器有限公司]。
1.2 药品与试剂盒
抑毒调肝合剂(西南医科大学附属医院中药制剂室自制,批准文号:川药制字Z20070510,批号:150217,规格:20 mL/支,每1 mL含生药约1.12 g);秋水仙碱片(云南植物药业有限公司,批号:20150504,规格:0.5 mg/片);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、羟脯氨酸(Hyp)试剂盒(南京建成生物工程研究所);透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)放射免疫试剂盒(北京华英生物技术研究所);基质金属蛋白酶组织抑制因子1(TIMP-1)、基质金属蛋白酶1(MMP-1)、MMP-2、MMP-13、转化生长因子β1(TGF-β1)、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试剂盒(上海西唐生物科技有限公司)。
1.3 动物
清洁级成年健康SD大鼠60只,♀♂各半,体质量180~200 g,由西南医科大学实验动物中心提供,动物合格证号为SYXK(川)2013-065。
2 方法
2.1 分组、造模与给药
将60只SD大鼠随机分为正常组、模型组、秋水仙碱组(阳性对照,0.2 mg/kg,相当于成人临床用量的6倍剂量)和抑毒调肝合剂低、中、高剂量组(2.7、5.4、10.8 mL/kg,分别相当于成人临床用量的3、6、12倍剂量),每组10只。除正常组大鼠sc橄榄油溶液外,其余各组大鼠均sc 40%CCl4橄榄油溶液(首次剂量为5 mL/kg,以后每次剂量为3 mL/kg),每周2次,连续8周;造模开始前2周给予高脂饮食(80%玉米粉+20%猪油),以后改用普通饲料,造模期间以10%乙醇为饮用水。自造模第1天起,各给药组大鼠ig相应药液,每天1次;正常组大鼠ig等体积蒸馏水。每天观察大鼠一般活动情况。
2.2 指标测定
2.2.1 血清指标 末次给药后24 h,称大鼠体质量,麻醉,腹主动脉取血,以离心半径为10 cm、3 000 r/min离心10 min(下同),分离血清。采用全自动生化分析仪测定血清中ALT、AST水平,采用放射免疫法测定血清中HA、PCⅢ、CⅣ水平,采用ELISA法测定血清中TIMP-1、MMP-1、MMP-2、MMP-13、TGF-β1、TNF-α水平,实验操作严格按照相应试剂盒说明书进行。
2.2.2 肝脏指标 取血后处死大鼠,摘取肝脏,冷生理盐水漂洗,冰浴中制成10%肝组织匀浆,离心,取上清。分别采用碱水解法、硫代巴比妥酸法(TBA法)、黄嘌呤氧化法测定肝组织中Hyp、MDA、SOD水平,采用比色法测定肝组织中GSH-Px、CAT水平,采用ELISA法测定肝组织中TGF-β1、TNF-α水平,实验操作严格按照相应试剂盒说明书进行。
2.3 统计学方法
3 结果
3.1 一般情况观察结果
正常组大鼠皮毛光滑润泽,活动及饮食基本正常,无死亡。模型组大鼠随给药时间的延长,进食和活动逐渐减少,皮毛干涩、枯乱,反应迟钝,分别于造模第6周和第7周各死亡1只。抑毒调肝合剂低剂量组大鼠的一般状态与模型组无明显区别,死亡1只。抑毒调肝合剂中、高剂量组大鼠的饮食情况较模型组改善,毛色逐渐趋于正常,活动度较好。秋水仙碱组大鼠整体情况与抑毒调肝合剂高剂量组相似,但有轻微腹泻症状。
3.2 血清中ALT、AST、HA、PCⅢ、CⅣ水平和肝组织中Hyp水平测定结果
与正常组比较,模型组大鼠血清中ALT、AST、HA、PCⅢ、CⅣ水平和肝组织中Hyp水平均显著升高(P<0.05),提示造模成功。与模型组比较,抑毒调肝合剂中、高剂量组和秋水仙碱组大鼠上述指标水平均显著降低(P<0.05),提示抑毒调肝合剂和秋水仙碱具有一定抗肝纤维化作用。与秋水仙碱组比较,抑毒调肝合剂高剂量组大鼠上述指标均无显著变化(P>0.05),结果详见表1。
3.3 血清中TIMP-1、MMP-1、MMP-2、MMP-13水平测定结果
与正常组比较,模型组大鼠血清中TIMP-1、MMP-2水平均显著升高(P<0.05),MMP-1、MMP-13水平均显著降低(P<0.05)。与模型组比较,抑毒调肝合剂高剂量组和秋水仙碱组大鼠上述指标均显著改善(P<0.05)。与秋水仙碱组比较,抑毒调肝合剂高剂量组大鼠血清中MMP-1、MMP-2、MMP-13水平均无显著差异(P>0.05),结果详见表2。
表1 各组大鼠血清中ALT、AST、HA、PCⅢ、CⅣ水平和肝组织中Hyp水平测定结果(±s)Tab 1 The levels ofALT,AST,HA,PCⅢ,CⅣin serum and Hyp in liver tissue of rats in each group(±s)

表1 各组大鼠血清中ALT、AST、HA、PCⅢ、CⅣ水平和肝组织中Hyp水平测定结果(±s)Tab 1 The levels ofALT,AST,HA,PCⅢ,CⅣin serum and Hyp in liver tissue of rats in each group(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与秋水仙碱组比较,ΔP<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;vs. colchicine group,ΔP<0.05
?
表2 各组大鼠血清中TIMP-1、MMP-1、MMP-2、MMP-13水平测定结果(±s,μg/L)Tab 2 The serum levels of TIMP-1,MMP-1,MMP-2 and MMP-13 of rats in each group(±s,μg/L)
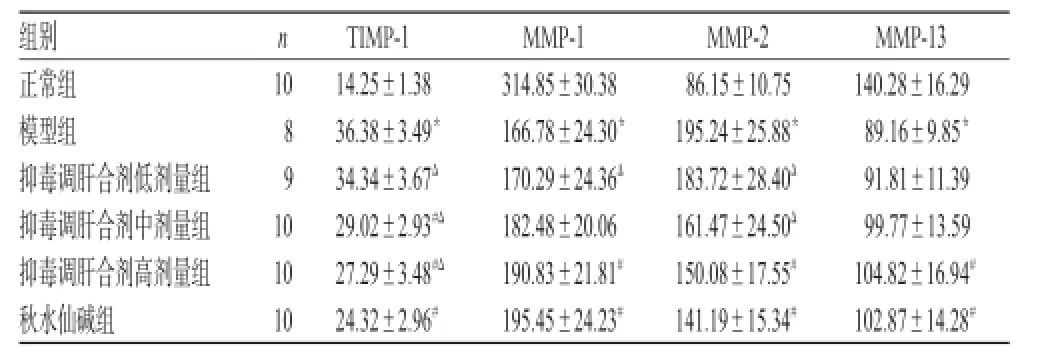
表2 各组大鼠血清中TIMP-1、MMP-1、MMP-2、MMP-13水平测定结果(±s,μg/L)Tab 2 The serum levels of TIMP-1,MMP-1,MMP-2 and MMP-13 of rats in each group(±s,μg/L)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与秋水仙碱组比较,ΔP<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;vs. colchicine group,ΔP<0.05
?
3.4 血清和肝组织中TGF-β1、TNF-α水平测定结果
与正常组比较,模型组大鼠血清和肝组织中TGF-β1、TNF-α水平均显著升高(P<0.05)。与模型组比较,抑毒调肝合剂中、高剂量组和秋水仙碱组大鼠血清和肝组织中TNF-α水平均显著降低(P<0.05);抑毒调肝合剂高剂量组和秋水仙碱组大鼠血清和肝组织中TGF-β1水平以及抑毒调肝合剂中剂量组大鼠肝组织中TGF-β1水平均显著降低(P<0.05)。与秋水仙碱组比较,抑毒调肝合剂中、高剂量组大鼠上述指标均无显著差异(P>0.05),结果详见表3。
3.5 肝组织中SOD、GSH-Px、CAT、MDA水平测定结果
与正常组比较,模型组大鼠肝组织中SOD、GSHPx、CAT水平均显著降低(P<0.05),MDA水平显著升高(P<0.05)。与模型组比较,抑毒调肝合剂中、高剂量组和秋水仙碱组大鼠肝组织中SOD、GSH-Px水平以及抑毒调肝合剂高剂量组和秋水仙碱组大鼠肝组织中CAT水平均显著升高(P<0.05),MDA水平均显著降低(P<0.05)。与秋水仙碱组比较,抑毒调肝合剂中、高剂量组大鼠上述指标均无显著差异(P>0.05),结果详见表4。
表3 各组大鼠血清和肝组织中TGF-β1、TNF-α含量测定结果(±s,μg/L)Tab 3 The contents of TGF-β1and TNF-α in serum and liver tissue of rats in each group(±s,μg/L)
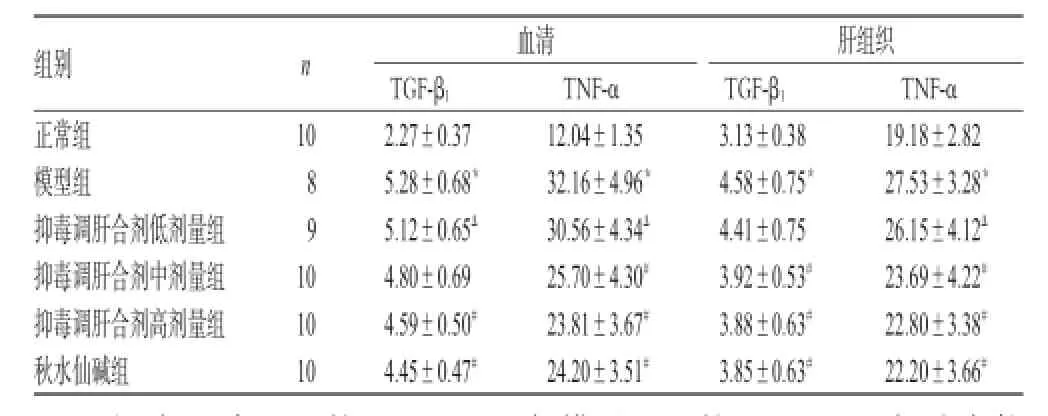
表3 各组大鼠血清和肝组织中TGF-β1、TNF-α含量测定结果(±s,μg/L)Tab 3 The contents of TGF-β1and TNF-α in serum and liver tissue of rats in each group(±s,μg/L)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与秋水仙碱组比较,ΔP<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;vs. colchicine group,ΔP<0.05
?
表4 各组大鼠肝组织中SOD、GSH-Px、CAT、MDA水平测定结果(±s)Tab 4 The levels of SOD,GSH-Px,CAT and MDA in liver tissue of rats in each group(±s)
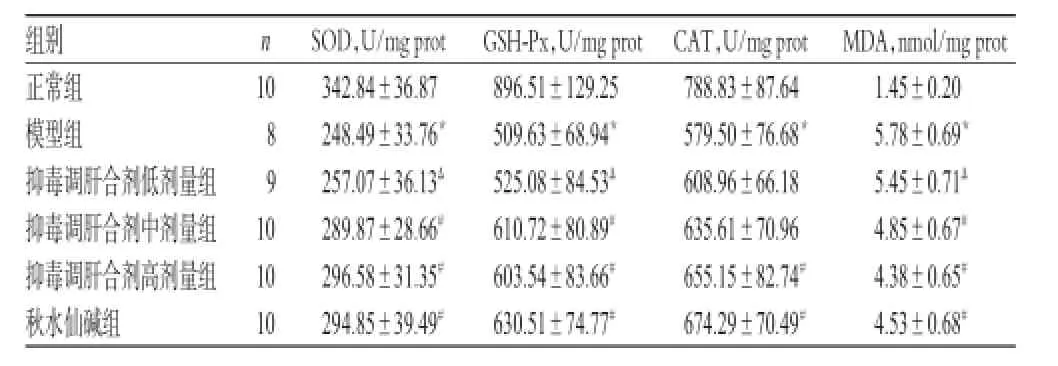
表4 各组大鼠肝组织中SOD、GSH-Px、CAT、MDA水平测定结果(±s)Tab 4 The levels of SOD,GSH-Px,CAT and MDA in liver tissue of rats in each group(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与秋水仙碱组比较,ΔP<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;vs. colchicine group,ΔP<0.05
?
4 讨论
临床上常用的肝纤维化诊断方法有血清学指标(胶原及其代谢产物HA、LN、PCⅢ、CⅣ等)、肝穿刺病理学及B超瞬时弹性检测。胶原纤维主要由胶原蛋白构成,而Hyp又是胶原蛋白的特有成分,因此测定肝组织总Hyp含量可间接反映肝纤维化的程度[7]。本研究结果显示,模型组大鼠肝组织中Hyp、HA、PCⅢ、CⅣ水平明显升高,表明肝纤维化大鼠模型制备成功;而预防性给予抑毒调肝合剂后,上述指标均显著降低,表明该中药复方可通过降低肝组织中Hyp含量、抑制胶原纤维合成,从而发挥抗纤维化作用。
MMP和TIMP是ECM合成和降解调节中的两个重要因子。目前发现有20多种MMP,其中MMP-1主要降解Ⅰ、Ⅲ型胶原,减少ECM的沉积;MMP-2降解细胞间基质成分和ECM CⅣ,并参与纤维结缔组织的重建、炎症反应等;MMP-13需锌离子的激活并参与肝内ECM的降解,在肝损伤等状态下表达降低[8]。TIMP是组织中MMP的内源性抑制因子,可与活性MMP结合,抑制其对ECM的降解活性,从而导致ECM在肝脏内的过度沉积,促使肝纤维化形成。目前发现有4种TIMP,肝脏中主要存在TIMP-1和TIMP-2。其中TIMP-1可抑制除MMP-14、MMP-19外的所有MMP,通过其N-末端特异性地与MMP-1催化活性中心的锌离子结合,从而封闭其催化活性,使MMP-1失活[9]。TIMP-1对肝纤维化的诊断特异性和敏感性高于TIMP-2,其表达在肝纤维化过程中逐渐增强,到肝硬化阶段达到高峰,增加的程度可反映肝纤维化的严重程度。因此,本实验设计检测MMP-1、MMP-2、MMP-13、TIMP-1等指标,以评价模型复制是否成功和探讨药物的作用机制。结果发现,造模8周后模型组大鼠血清中TIMP-1、MMP-2水平显著升高,MMP-1、MMP-13水平则显著降低;预防性给予抑毒调肝合剂后,血清中TIMP-1、MMP-2水平显著降低,MMP-1、MMP-13水平则显著升高,提示抑毒调肝合剂能明显升高肝纤维化大鼠血清中MMP-1、MMP-13水平并下调血清中TIMP-1、MMP-2水平,使TIMP表达下降并解除对MMP的抑制,从而增加ECM的降解。
不论何种病因引起的肝纤维化,肝细胞损害是共同的始动因子,而临床研究和动物实验均提示肝纤维化的发生发展直接或间接与氧化应激、氧自由基损伤、脂质过氧化有关[10-11]。抑毒调肝合剂中多种成分具有清除氧自由基、抑制脂质过氧化的药理作用[12-13]。MDA是脂质过氧化反应的终末产物,其高低间接反映了机体细胞受自由基攻击的严重程度。本研究发现,CCl4复合因素作用后,在大鼠肝纤维化形成的同时,肝组织中MDA水平显著升高,这表明肝纤维化形成与氧化应激有关。而SOD、GSH-Px、CAT等氧化指标水平显著降低,则更加证实了这点。预防给予抑毒调肝合剂后,显著降低了大鼠血清中ALT、AST水平和肝组织中MDA水平,提高了肝组织中SOD、GSH-Px、CAT的水平,提示抑毒调肝合剂对肝细胞的保护作用与抑制氧化应激及脂质过氧化反应有关。
TGF-β1、TNF-α主要由肝星状细胞(HSC)、库普弗细胞等产生。研究表明,TGF-β1在ECM的合成和降解过程起关键调节作用。TGF-β1对肝纤维化的调控主要是通过TGF-β1/Smad信号传导通路实现的,可促进ECM的合成,增加ECM的沉积,还可通过抑制MMP等多种水解酶的产生与活性、增加TIMP的表达,从而减少ECM的降解。TNF-α能明显抑制活化HSC凋亡,直接刺激HSC增殖和胶原合成,还能增强TGF-β1对HSC增殖和胶原合成的刺激作用[14]。本研究发现,抑毒调肝合剂高剂量组大鼠血清和肝组织中TGF-β1和TNF-α水平均较模型组降低,提示TGF-β1、TNF-α表达减少可能是抑毒调肝合剂抗肝纤维化的分子机制之一,与TGF-βl/ Smad信号传导通路下游的关系将是笔者下一步研究的方向。
综上所述,抑毒调肝合剂能明显改善大鼠肝功能,具有一定的抗肝纤维化作用。其作用机制可能与抗氧化应激、抑制脂质过氧化反应、抑制HSC活化、降低TGF-β1水平、调节TIMP/MMP平衡、减少ECM沉积等有关。但其更多分子乃至基因水平的作用机制还有待进一步研究。
[1] Mormone E,George J,Nieto N.Molecular pathogenesis of hepatic fibrosis and current therapeutic approaches[J].Chem Biol Interact,2011,193(3):225-231.
[2] Fallowfield JA,Iredale JP.Reversal of liver fibrosis and cirrhosis:an emerging reality[J].Scott Med J,2004,49(1):3-6.
[3] 李光全,刘慧敏,崔鹤蓉,等.苷泰胶囊对四氯化碳诱导的大鼠肝纤维化的治疗作用[J].中国实验方剂学杂志,2016,22(18):127-131.
[4] 周学东,刘庆涛.荔枝核总黄酮对肝纤维化模型大鼠肝细胞损伤的改善作用[J].中国药房,2015,26(22):3099-3102.
[5] 罗宏丽,肖顺林,冯碧敏.RP-HPLC法测定抑毒调肝合剂中丹参酮ⅡA的含量[J].中国药房,2012,23(35):3342-3343.
[6] 罗宏丽,冯碧敏,肖顺林.反相高效液相色谱法测定抑毒调肝合剂中丹参素钠含量[J].中国药业,2012,21(11):29-30.
[7] 杨莉,刘莲,冯爱东,等.软肝化坚颗粒对肝纤维化C57小鼠体内羟脯氨酸的影响[J].河北中医,2014,36(4):589-591.
[8] 孙妩戈,桂双英,吴丽,等.芍芪多苷对肝纤维化大鼠肝脏星状细胞基质金属蛋白酶13及组织金属蛋白酶抑制因子1表达的影响[J].中国中药杂志,2010,35(11):1447-1451.
[9] 谢玉梅,聂青和,周永兴,等.肝硬化患者肝组织中TIMP-1,TIMP-2表达[J].第四军医大学学报,2000,21(7):790-792.
[10] Lee KS,Lee SJ,Park HJ,et al.Oxidative stress effect on the activation of hepatic stellate cells[J].Yonsei Med J,2001,42(1):1-8.
[11] Hoek JB,Pastorino JG.Ethanol,oxidative stress,and cytokine-induced liver cell injury[J].Alcohol,2002,27(1):63-68.
[12] 杨亚军.丹参素通过调控FoxO/Wnt通路抑制氧化应激介导骨质疏松的作用及机制研究[D].广州:南方医科大学,2014.
[13] 刘永刚,陈厚昌,蒋毅萍.丹参酮ⅡA对四氯化碳致大鼠肝纤维化的实验研究[J].中药材,2002,25(1):31-33.
[14] Migita K,Maeda Y,Abiru S,et al.Immunosuppressant FK506 inhibits matrix metalloproteinase-9 induction in TNF-alpha-stimulated human hepatic stellate cells[J].Life Sci,2006,78(21):2510-2515.
Study on Anti-hepatic Fibrosis Effects of Yidu Tiaogan Mixture on Rats and Its Mechanism
LUO Hongli,XIAO Shunlin,YU Xin(Dept.of Pharmacy,the Affiliated Hospital of Southwest Medical University,Sichuan Luzhou,646000,China)
OBJECTIVE:To study the anti-hepatic fibrosis effects of Yidu tiaogan mixture on rats and its mechanism.METHODS:60 SD rats were randomly divided into normal group,model group,colchicine group(positive control,0.2 mg/kg)and Yidu tiaogan mixture low-dose,medium-dose and high-dose groups(2.7,5.4,10.8 mL/kg).Except for normal group,liver fibrosis model was induced in other groups,and they were given relevant medicine intragastrically during modeling,once a day,for 8 weeks.Serum levels of ALT,AST,HA,PCⅢ,CⅣ,TIMP-1,MMP-1,MMP-2,MMP-13,TGF-β1and TNF-α and the levels of Hyp,SOD,GSH-Px,CAT,MDA,TGF-β1and TNF-α in liver tissue were detected in rats.RESULTS:Compared with normal group,the serum levels of ALT,AST,HA,PCⅢ,CⅣ,TIMP-1,MMP-2,TGF-β1and TNF-α were increased significantly in model group,while the serum levels of MMP-1 and MMP-13 were decreased significantly(P<0.05);the levels of Hyp,TGF-β1,TNF-α and MDA in liver tissue were increased significantly,while the levels of SOD,GSH-Px and CAT were decreased significantly(P<0.05).Compared with model group,the serum levels of ALT,AST,HA,PCⅢ,CⅣ,TIMP-1 and TNF-α as well as the levels of Hyp,TGF-β1,TNF-α and MDA in liver tissue were all decreased significantly of rats in Yidu tiaogan mixture mediumdose,high-dose and colchicine groups(P<0.05);the serum levels of MMP-1 and MMP-13 as well as the level of CAT in liver tissue were increased significantly in Yidu tiaogan mixture high-dose group and colchicine group(P<0.05),while the serum levels of MMP-2 and TGF-β1were decreased significantly(P<0.05).There was no statistical significance in above indexes in Yidu tiaogan mixture low-dose group(P>0.05).CONCLUSIONS:Yidu tiaogan mixture exerts protective effects on liver fibrosis of rat through regulating TIMP/MMP balance,suppressing oxidative stress,decreasing the level of TGF-β1and reducing deposition of extracellular matrix in liver.
Yidu tiaogan mixture;Liver fibrosis;Rat
R285.5
A
1001-0408(2017)04-0501-04
泸州市科技计划项目[No.2015-S-45(3/5)]
*副主任药师,硕士。研究方向:中药药理学、临床药学。E-mail:luohongli@stu.xjtu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.04.19

