Faecalibacteriumprausnitzii对LFA-1基因敲除的结肠炎小鼠中Treg细胞和细胞因子的影响*
张 敏 李媛媛 张东波 于成功,#
南京中医药大学中西医结合鼓楼临床学院1(210008) 南京大学医学院附属鼓楼医院消化内科2 南京大学医学院消化科3
Faecalibacteriumprausnitzii对LFA-1基因敲除的结肠炎小鼠中Treg细胞和细胞因子的影响*
张 敏1李媛媛2张东波3于成功1,2#
南京中医药大学中西医结合鼓楼临床学院1(210008) 南京大学医学院附属鼓楼医院消化内科2南京大学医学院消化科3
背景:Faecalibacteriumprausnitzii(Fp)可促进Treg细胞的分化,淋巴细胞功能相关抗原-1(LFA-1)亦参与Treg细胞的分化调节。目的:探讨Fp对LFA-1基因敲除(LFA-1-/-)的结肠炎小鼠中Treg细胞和细胞因子的影响。方法:将同样遗传背景下野生型小鼠和LFA-1-/-小鼠随机分为野生型对照组、野生型治疗组、LFA-1-/-对照组、LFA-1-/-治疗组。小鼠饮用DSS溶液诱导结肠炎模型,治疗组小鼠予Fp灌胃。观察各组小鼠一般状况和组织病理学评分,以流式细胞术检测脾脏和肠系膜淋巴结中Treg细胞比例,ELISA法检测外周血清IL-10、TGF-β1含量,实时PCR法检测结肠组织IL-10、TGF-β1 mRNA表达。结果:与相应对照组相比,野生型治疗组结肠组织学评分显著下降(P<0.05);野生型治疗组和LFA-1-/-治疗组脾脏和肠系膜淋巴结中Treg细胞比例显著升高(P<0.05),血清IL-10、TGF-β1含量显著升高(P<0.01),TGF-β1 mRNA表达显著升高(P<0.05);LFA-1-/-治疗组IL-10 mRNA表达显著降低(P<0.01)。与野生型治疗组相比,LFA-1-/-治疗组血清TGF-β1含量显著降低(P<0.05),IL-10、TGF-β1 mRNA表达显著降低(P<0.05)。结论:Fp在LFA-1-/-小鼠中可上调Treg细胞比例,促进Treg细胞分泌抗炎因子IL-10、TGF-β1。Fp治疗野生型结肠炎小鼠的疗效优于LFA-1-/-小鼠,可能与LFA-1缺失对Treg细胞功能的发挥和细胞因子分泌受限有关。
Faecalibacteriumprausnitzii; 淋巴细胞功能相关抗原1; T淋巴细胞, 调节性; 结肠炎; 白细胞介素10; 转化生长因子β1
炎症性肠病(IBD)为肠道慢性、复发性炎症性疾病,主要包括溃疡性结肠炎(UC)和克罗恩病(CD)。目前认为肠道菌群参与肠黏膜免疫系统的异常反应。Treg细胞能减轻炎症反应,提高免疫耐受。Faecalibacteriumprausnitzii(Fp)是一种具有抗炎和免疫调节作用的肠道共生菌。有研究[1]发现,Fp及其产物在结肠炎动物模型中具有促进Treg细胞分化和抗炎因子分泌的作用。本研究的前期研究[2]已表明,淋巴细胞功能相关抗原(LFA)-1对Treg细胞的分化和功能有影响,但Fp对LFA-1基因敲除(LFA-1-/-)时影响Treg细胞分化调控及其作用机制目前尚不清楚。本研究通过DSS诱导小鼠结肠炎模型,旨在探讨Fp对LFA-1-/-结肠炎小鼠中Treg细胞和细胞因子的影响。
材料与方法
一、实验动物和主要试剂
1. 实验动物:LFA-1-/-C57BL/6J小鼠和同样遗传背景的野生型C57BL/6J小鼠(美国Jackson Laboratory)各20只,饲养于南京鼓楼医院无特定病原体级动物实验中心,7~8周龄,雌雄各半,体质量20~23 g。
2. 主要试剂:DSS(MP Biomedicals公司),Fp(ATCC 27766,美国模式菌种保藏中心),FITC标记的抗鼠CD4抗体、APC标记的抗鼠CD25抗体、PE标记的抗鼠Foxp3抗体以及小鼠白细胞介素-10(IL-10)、转化生长因子-β1(TGF-β1) ELISA试剂盒(eBioscience, Inc.),红细胞裂解液(MILTENYI BIOTEC),引物、反转录、PCR试剂盒和Trizol裂解液(TAKARA BIO INC.)。
二、研究方法
1. Fp菌培养:将Fp接种至LYHBHI培养基于37 ℃厌氧箱中培养48 h。根据600 nm波长处吸光度值结合平板菌落计数计算细菌浓度,以PBS重选并调整浓度至1×109CFU/mL。
2. 动物模型制备和分组:将40只野生型小鼠和LFA-1-/-小鼠随机分为野生型对照组、野生型治疗组、LFA-1-/-对照组和LFA-1-/-治疗组,每组各10只。小鼠饮用3.5% DSS溶液诱导结肠炎模型,治疗组小鼠给予0.2 mL/10 g Fp每天灌胃1次,对照组以等量PBS灌胃,每天1次,连续7 d。造模期间观察小鼠的状况、活动和排便情况,每日称重。造模第8天,颈椎脱臼法处死小鼠,眼眶取血,无菌取脾脏、肠系膜淋巴结和结肠,测量小鼠回盲部至肛门的结肠长度。
3. 组织学评分:取结肠炎病变显著部位,以中性甲醛固定,行HE染色。参照Dutra等[3]的标准行组织学评分。0分,黏膜结构正常,无炎症;1分,黏膜隐窝损坏1/3伴较少炎性细胞浸润;2分,黏膜隐窝损坏2/3伴少量炎性细胞浸润;3分,黏膜结构损坏严重涉及固有层伴大量炎性细胞浸润;4分,黏膜结构紊乱,炎性细胞大量浸润,甚至有透壁反应,结肠壁僵硬增厚。
4. 流式细胞术检测脾脏和肠系膜淋巴结中Treg细胞比例:无菌取小鼠新鲜脾脏和肠系膜淋巴结,充分研磨后脾脏细胞加入红细胞裂解液。予PBS重悬后计数,取1×106个细胞加入表面抗体APC-CD25 0.8 μL、FITC-CD4 1.0 μL,振荡、避光20 min;加入固定破膜剂800 μL,避光1~2 h;加入PE-Foxp3 2.5 μL,避光孵育45 min,PBS重悬至100 μL 后上流式细胞仪检测。
5. ELISA法检测外周血IL-10、TGF-β1含量:具体检测步骤按照试剂盒说明书进行操作。
6. 实时PCR法检测结肠组织IL-10、TGF-β1 mRNA表达:各组随机抽取4只小鼠,提取结肠总RNA,逆转录合成cDNA,行PCR反应。IL-10引物序列:F:5’-GCC TTA TCG GAA ATG ATC CA-3’,R:5’-AGG GTC TTC AGC TTC TCA CC-3’。TGF-β1引物序列:F:5’-ATT CCT GGC GTT ACC TTG G-3’,R:5’-AGC CCT GTA TTC CGT CTC CT-3’。内参GAPDH引物序列:F:5’-CAT GGC CTT CCG TGT TCC TA-3’,R:5’-TGT CAT CAT ACT TGG CAG GTT TCT-3’。反应条件:95 ℃ 30 min;95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,共40个循环;60 ℃ 1 min,95 ℃ 15 s。以2-△△Ct法计算目的基因的表达。
三、统计学分析

结 果
一、小鼠的一般状况、结肠长度和病理变化
造模后第3天,两组对照组小鼠开始出现进食减少,活动量少、精神萎靡、便质稀,体质量下降,第5天对照组小鼠开始出现部分血便,症状随时间延长加重,镜下可见黏膜正常结构破坏,大量炎性细胞浸润,杯状细胞减少;两组治疗组症状均较相应对照组减轻,镜下炎性细胞浸润程度减轻,同时体质量下降减少(图1)。
野生型对照组和LFA-1-/-对照组结肠长度较相应治疗组明显缩短(P<0.05),且野生型治疗组较LFA-1-/-治疗组明显增加(P<0.05)。野生型对照组结肠组织病理学评分较相应治疗组显著升高(P<0.05),而LFA-1-/-对照组与LFA-1-/-治疗组之间无明显差异(P>0.05)。两组治疗组结肠组织病理学评分无明显差异(P>0.05)(表1)。

表1 各组结肠长度和组织病理学评分(±s)
*与相应对照组比较,P<0.05;▲与野生型治疗组比较,P<0.05
二、脾脏和肠系膜淋巴结中Treg细胞比例
野生型治疗组和LFA-1-/-治疗组小鼠脾脏和肠系膜淋巴结中Treg细胞比例较相应对照组均显著升高(P<0.05);野生型治疗组脾脏中Treg细胞比例显著高于LFA-1-/-治疗组(P<0.01),而两组治疗组肠系膜淋巴结中Treg细胞比例无明显差异(P>0.05)(图2)。
三、血清IL-10、TGF-β1含量
野生型治疗组和LFA-1-/-治疗组血清IL-10、TGF-β1含量较相应对照组显著升高(P<0.01),且野生型治疗组血清TGF-β1含量显著高于LFA-1-/-治疗组(P<0.05),而两组治疗组血清IL-10含量无明显差异(P>0.05)(表2)。

A:野生型对照组;B:野生型治疗组;C:LFA-1-/-对照组;D:LFA-1-/-治疗组
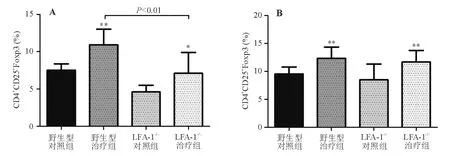
与相应对照组比较,*P<0.05,**P<0.01

组 别IL⁃10(pg/mL)TGF⁃β1(pg/mL)IL⁃10mRNA表达TGF⁃β1mRNA表达野生型对照组83.51±6.53134.70±10.311.27±0.041.06±0.03野生型治疗组121.00±11.08∗∗174.10±9.91∗∗1.07±0.141.19±0.07∗LFA⁃1-/-对照组71.54±6.36114.60±8.251.03±0.040.47±0.13LFA⁃1-/-治疗组105.10±7.24∗∗140.20±8.16∗∗▲0.61±0.09∗∗▲0.70±0.06∗▲
与相应对照组比较,*P<0.05,**P<0.01;▲与野生型治疗组比较,P<0.05
四、结肠组织IL-10、TGF-β1 mRNA表达
与相应对照组相比,野生型治疗组和LFA-1-/-治疗组结肠组织TGF-β1 mRNA表达显著升高(P<0.05),野生型治疗组IL-10 mRNA表达无明显差异(P>0.05),LFA-1-/-治疗组IL-10 mRNA表达显著降低(P<0.01)。野生型治疗组结肠组织IL-10、TGF-β1 mRNA表达均显著高于LFA-1-/-治疗组(P<0.05)(表2)。
讨 论
Fp对维护肠道菌群的稳态起重要作用,可分泌丁酸盐和未知产物。有研究发现,Fp具有免疫调节和抗炎的作用[4]。本课题组的前期动物实验[5]发现,对于TNBS诱导的实验性结肠炎大鼠,Fp及其上清液通过增加脾脏中Treg细胞比例而发挥治疗作用,但具体机制不明。说明益生菌对IBD的治疗具有举足轻重的作用。Treg细胞可降低炎性反应,抑制炎性进展,在维持免疫稳态、抗炎等过程中扮演重要角色。研究证明,Treg细胞数量减少或功能下降与IBD的发展相关[6]。动物实验[7]显示,通过体内输注Treg细胞可减轻重症联合免疫缺陷小鼠的结肠炎症状。临床研究[8]表明,与正常人相比,IBD患者外周血Treg细胞比例显著下降。因此,通过提高Treg细胞比例治疗IBD已成为目前研究的热点。Treg细胞分为nTreg细胞和iTreg细胞,两者具有相似的抑制功能[9]。在人体内,生理情况下nTreg细胞分布于脾脏和淋巴结中,而iTreg细胞主要位于肠道相关淋巴结中[10-11]。本研究流式细胞术结果显示野生型结肠炎小鼠给予Fp治疗后,脾脏和肠系膜淋巴结Treg细胞比例显著升高,同时症状减轻,结肠长度增加,组织病理学评分降低,说明Fp可有效治疗结肠炎小鼠;LFA-1-/-结肠炎小鼠经Fp治疗后,组织病理学评分与相应对照组无明显差异,考虑LFA-1对Treg细胞功能有调控作用,进而影响了Fp治疗结肠炎的疗效。
LFA-1为β2家族成员,可与细胞间黏附分子-1(ICAM-1)结合,对淋巴细胞的迁移、活化、归巢等有显著作用[12]。动物实验[13-14]表明,敲除LFA-1基因可导致外周Treg细胞比例和功能的降低。本研究中,Fp治疗后可提高LFA-1-/-小鼠脾脏和肠系膜淋巴结Treg细胞比例,提示Fp通过多种途径调控Treg细胞的分化。本实验中,野生型治疗组脾脏中Treg细胞比例高于LFA-1-/-治疗组,提示Fp与LFA-1可能协同促进Treg细胞分化,但具体机制不明;而两组肠系膜淋巴结中Treg细胞比例无明显差异,考虑到细胞活性、温度、抗体结合度等条件可影响流式细胞术,实验结果可能会有一定误差。
Treg细胞通过分泌IL-10和TGF-β而在IBD中发挥抗炎作用。有研究表明,TGF-β mRNA表达可证实Treg细胞的存在[15]。Schramm等[16]发现,外周Treg细胞比例升高是由于转基因小鼠高表达TGF-β。TGF-β具有抑制炎症的作用,在自身免疫中发挥重要作用,TGF-β1缺陷小鼠可引起全身多器官炎症,并可发生早期死亡[17]。IL-10主要由巨噬细胞和单核细胞产生,具有抗炎作用。IL-10缺失可导致与CD相似的结肠炎,且CD的复发与低含量IL-10相关[18]。本研究两组治疗组血清IL-10和TGF-β1含量均高于相应对照组,说明Fp抗炎的机制可能与促进抗炎因子的分泌有关。LFA-1-/-治疗组中血清TGF-β1含量显著低于野生型治疗组,而IL-10含量无明显差异。Wohler等[14]的研究亦发现,Treg细胞治疗LFA-1-/-结肠炎小鼠的疗效不如野生型小鼠。
本研究还发现,野生型和LFA-1-/-结肠炎小鼠经Fp治疗后,TGF-β1 mRNA表达均显著升高,但野生型治疗组IL-10 mRNA表达与相应对照组无明显差异,这一结果与野生型治疗组外周血IL-10含量较相应对照组升高不一致,考虑到体内促炎因子如IL-17A等可影响IL-10的分泌,前期研究[19]已表明Fp可下调促炎因子IL-17A。考虑到IL-17A对IL-10的分泌有负反馈作用,有利于维持肠道内促炎因子/抗炎因子的平衡,维持肠道内稳态。有临床研究[20]表明,UC患者T细胞中IL-10 mRNA表达明显升高,结肠中IL-10阳性细胞含量亦明显升高。本研究中LFA-1-/-治疗组IL-10 mRNA表达较相应对照组显著降低,考虑LFA-1缺失影响了外周Treg细胞向肠道组织的迁移。LFA-1-/-小鼠经Fp治疗后IL-10、TGF-β1 mRNA表达显著低于野生型治疗组,与LFA-1缺失影响Treg细胞的分化迁移有关。而Fp在LFA-1缺失的情况下,起调控Treg细胞相关炎性因子表达的作用。
综上所述,虽然LFA-1能调控Treg细胞的分化和迁移以及相关细胞因子的基因表达,但不能忽视Fp对Treg细胞的作用。本实验发现,Fp在LFA-1缺失的情况下能上调Treg细胞比例,促进抗炎因子TGF-β1 mRNA表达。Fp治疗LFA-1-/-结肠炎小鼠的疗效低于野生型小鼠,可能与LFA-1缺失对Treg细胞功能的发挥和细胞因子表达受限有关。进一步探究Fp与LFA-1协同作用的机制,可为今后治疗IBD提供新思路。
1 Qiu X, Zhang M, Yang X, et al.Faecalibacteriumprausnitziiupregulates regulatory T cells and anti-inflammatory cytokines in treating TNBS-induced colitis[J]. J Crohns Colitis, 2013, 7 (11): e558-e568.
2 姚仁玲, 邹晓平, 于成功. 淋巴细胞功能相关抗原-1调节Treg细胞对炎症性肠病的影响[J]. 胃肠病学, 2013, 18 (6): 346-351.
3 Dutra RC, Cola M, Leite DF, et al. Inhibitor of PI3Kγ ameliorates TNBS-induced colitis in mice by affecting the functional activity of CD4+CD25+FoxP3+regulatory T cells[J]. Br J Pharmacol, 2011, 163 (2): 358-374.
4 Sokol H, Seksik P, Furet JP, et al. Low counts ofFaecalibacteriumprausnitziiin colitis microbiota[J]. Inflamm Bowel Dis, 2009, 15 (8): 1183-1189.
5 杨晓彤, 张明明, 洪娜, 等.Faecalibacteriumprausnitzii对实验性结肠炎大鼠Foxp3+Treg细胞的影响[J]. 胃肠病学, 2012, 17 (3): 141-145.
6 Boden EK, Snapper SB. Regulatory T cells in inflammatory bowel disease[J]. Curr Opin Gastroenterol, 2008, 24 (6): 733-741.
7 Ogino H, Nakamura K, Ihara E, et al. CD4+CD25+regulatory T cells suppress Th17-responses in an experimental colitis model[J]. Dig Dis Sci, 2011, 56 (2): 376-386.
8 王轶, 刘雪平, 赵治彬, 等. 外周血CD4+CD25+FOXP3+调节性T细胞与炎症性肠病疾病活动度的关系[J]. 胃肠病学, 2010, 15 (4): 218-221.
9 Horwitz DA, Zheng SG, Gray JD. Natural and TGF-beta-induced Foxp3(+)CD4(+) CD25(+) regulatory T cells are not mirror images of each other[J]. Trends Immunol, 2008, 29 (9): 429-435.
10 Mayne CG, Williams CB. Induced and natural regulatory T cells in the development of inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19 (8): 1772-1788.
11 Barnes MJ, Powrie F. Regulatory T cells reinforce intestinal homeostasis[J]. Immunity, 2009, 31 (3): 401-411.
12 李猛, 高春记. LFA-1与配体ICAM-1黏附分子功能的研究进展[J]. 中国实验血液学杂志, 2008, 16 (1): 213-216.
13 Li L, Kim Js, Boussiotis VA. Rap1A regulates generation of T regulatory cells via LFA-1-dependent and LFA-1-independent mechanisms[J]. Cell Immunol, 2010, 266 (1): 7-13.
14 Wohler J, Bullard D, Schoeb T, et al. LFA-1 is critical for regulatory T cell homeostasis and function[J]. Mol Immunol, 2009, 46 (11-12): 2424-2428.
15 Becker C, Fantini MC, Neurath MF. TGF-beta as a T cell regulator in colitis and colon cancer[J]. Cytokine Growth Factor Rev, 2006, 17 (1-2): 97-106.
16 Schramm C, Huber S, Protschka M, et al. Blessing TGFbeta regulates the CD4+CD25+T-cell pool and the expression of Foxp3invivo[J]. Int Immunol, 2004, 16 (9): 1241-1249.
17 Annes JP, Munger JS, Rifkin DB. Making sense of latent TGFbeta activation[J]. J Cell Sci, 2003, 116 (Pt 2): 217-224.
18 Kühn R, Löhler J, Rennick D, et al. Interleukin-10-deficient mice develop chronic enterocolitis[J]. Cell, 1993, 75 (2): 263-274.
19 张明明.Faecalibacteriumprausnitzii抑制白介素17表达和对大鼠结肠炎的预防作用[D]. 南京大学, 2012.
20 Melgar S, Yeung MM, Bas A, et al. Over-expression of interleukin 10 in mucosal T cells of patients with active ulcerative colitis[J]. Clin Exp Immunol, 2003, 134 (1): 127-137.
(2016-08-01收稿;2016-09-06修回)
Effect ofFaecalibacteriumprausnitziion Treg Cells and Cytokines in Colitis Mice with LFA-1 Knockout
ZHANGMin1,LIYuanyuan2,ZHANGDongbo3,YUChenggong1,2.
1ClinicalCollegeofChineseandWesternIntegratedMedicine,NanjingUniversityofChineseMedicine/DrumTowerHospital,Nanjing(210008);2DepartmentofGastroenterology,theAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing;3DepartmentofGastroenterology,NanjingUniversityMedicalSchool,Nanjing
YU Chenggong, Email: chenggong_yu@nju.edu.cn.
Faecalibacteriumprausnitzii; Lymphocyte Function-Associated Antigen-1; T-Lymphocytes, Regulatory; Colitis; Interleukin-10; Transforming Growth Factor beta1
10.3969/j.issn.1008-7125.2017.03.006
国家自然科学基金项目(81470819)
#本文通信作者,Email: chenggong_yu@nju.edu.cn
Background: It has been widely accepted thatFaecalibacteriumprausnitzii(Fp) induces the differentiation of Treg cells. Lymphocyte function-associated antigen-1 (LFA-1) is also involved in the differentiation of Treg cells. Aims: To investigate the effect of Fp on Treg cells and cytokines in colitis mice with LFA-1 knockout (LFA-1-/-). Methods: Twenty wild type mice and twenty LFA-1-/-mice with same genetic background were randomly divided into wild type control group, wild type treatment group, LFA-1-/-control group and LFA-1-/-treatment group. Colitis model was induced by drinking DSS solution. Mice in the two treatment groups were intragastrically administrated with Fp. General status and histopathological score were assessed. Percentages of Treg cells in spleen and mesenteric lymph nodes were measured by flow cytometry. Serum levels of IL-10 and TGF-β1 were measured by ELISA. mRNA expressions of IL-10 and TGF-β1 in colonic tissue were detected by real time PCR. Results: Compared with corresponding control groups, histopathological score was significantly decreased in wild type treatment group (P<0.05); percentages of Treg cells in spleen and mesenteric lymph nodes were significantly increased (P<0.05), serum levels of IL-10 and TGF-β1 were significantly increased (P<0.01), expression of TGF-β1 mRNA was significantly increased in wild type treatment group and LFA-1-/-treatment group (P<0.05); expression of IL-10 mRNA was significantly decreased in LFA-1-/-treatment group (P<0.01). Compared with wild type treatment group, serum level of TGF-β1 was significantly decreased (P<0.05), and mRNA expressions of IL-10 and TGF-β1 were significantly decreased in LFA-1-/-treatment group (P<0.05). Conclusions: Fp can up-regulate the percentages of Treg cells and enhance the secretion of anti-inflammatory cytokines IL-10 and TGF-β1 in LFA-1-/-mice. The therapeutic efficacy for colitis in wild type mice is superior to that in LFA-1-/-mice, which may be related to the inhibition of function of Treg cells and secretion of cytokines due to LFA-1 knockout.

