环磷酸腺苷信号对矽肺纤维化形成的影响*
丁咏伟,耿玉聪,刘燕,徐洪,张丽娟,王瑞雪,王建辉,胡启峰,杨方
(华北理工大学 1.基础医学院,2.医学实验中心,河北 唐山 063009;3.河北省唐山市第二医院 创伤科,河北 唐山 063000)
环磷酸腺苷信号对矽肺纤维化形成的影响*
丁咏伟1,耿玉聪1,刘燕1,徐洪2,张丽娟2,王瑞雪1,王建辉1,胡启峰3,杨方1
(华北理工大学 1.基础医学院,2.医学实验中心,河北 唐山 063009;3.河北省唐山市第二医院 创伤科,河北 唐山 063000)
目的观察环磷酸腺苷(cAMP)信号在大鼠矽肺纤维化发生、发展过程中的变化及其对矽肺纤维化形成的影响。方法 采用HOPE-MED8050动式染尘控制系统复制大鼠矽肺模型,雄性Wistar大鼠随机分为6组,每组10只,分别染尘0、2、4、8、12和16周。采用Masson三色染色观察肺组织形态,采用免疫组织化学法染色和Western blot检测α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原(CollagenⅠ)、纤连蛋白(Fn)、激动型G蛋白α(Gαs)、抑制型G蛋白α(Gαi2、Gαi3)及cAMP的表达。结果 Masson三色染色显示,矽肺模型4周组细胞性结节区域可见蓝紫色胶原沉积,并随模型制备时间的延长纤维化病变区域胶原沉积逐渐增加。免疫组织化学法染色显示,对照组α-SMA阳性表达部位在气管及血管平滑肌;在矽肺模型16周组,α-SMA表达于结节周边及间质纤维化病变区域。α-SMA、CollagenⅠ、Fn及Gαi2、Gαi3蛋白表达在矽肺模型4、8、12和16周较对照组逐渐增多。在矽肺模型8周组Gαs蛋白表达及cAMP含量较对照组下降,至染尘16周达最低。结论 cAMP的表达在矽肺发生、发展过程中呈下降趋势,cAMP信号参与大鼠矽肺纤维化过程。
矽肺病;肌成纤维细胞;环磷酸腺苷
尘肺病(包括矽肺)是由于在职业活动中长期吸入生产性粉尘并在肺内潴留,而引起的以肺组织纤维化为主的全身性疾病。对尘肺发生、发展和防治机制的研究,一直是我国职业病研究领域中的难点及热点问题。课题组以往研究发现,β2肾上腺素受体-激动型G蛋白(β2 adrenergic receptor-stimulatory G protein,ADRB2-Gs)复合物在矽肺模型组中表达下调,仅为对照组的30%[1]。研究表明,ADRB2-Gs复合物能够促进腺苷酸环化酶(adenylyl cyclase,AC)表达的上调,调节环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的合成[2]。相关研究报道,cAMP信号在心、肺、肝等纤维化模型中具有抗纤维化的作用,cAMP表达的上调能够限制炎症反应,抑制成纤维细胞的增殖,阻断成纤维细胞向肌成纤维细胞的转变,减轻细胞外基质的沉积[3-5]。由此可见cAMP信号可能具有潜在的抗矽肺纤维化的效果。本研究通过复制矽肺大鼠模型,分析肺组织中cAMP信号的动态变化与矽肺纤维化病变的关系。
1 材料与方法
1.1 材料与试剂
3周龄雄性Wistar大鼠(50±10)g(北京维通利华动物技术有限公司),SiO2粉尘(美国Sigma-Aldrich公司),Masson三色染色试剂盒(台湾贝索公司),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔多克隆抗体(ab32575,美国EPITMICs公司),Ⅰ型胶原(CollagenⅠ)兔多克隆抗体(ab34710,英国Abcam公司),纤连蛋白(Fibronectin,Fn)兔多克隆抗体(ab45688,美国EPITMICs公司),抑制型G蛋白α(inhibitory G protein α,Gαi2)兔多克隆抗体(sc-7276,美国Santa Cruz公司),Gαi3鼠单克隆抗体(sc-365422,美国Santa Cruz公司),激动型G蛋白α(stimulatory G protein α,Gαs)鼠单克隆抗体(sc-135914,美国Santa Cruz公司),cAMP兔多克隆抗体(EL140118,英国Eterlife公司),免疫组织化学法二步法试剂盒(PV-6000,北京中杉金桥生物技术有限公司)。
1.2 主要仪器与设备
HOPE-MED8050动式染尘控制系统(天津开发区合普工贸有限公司),光学显微镜(日本Olympus公司),凝胶成像分体系统(美国Biorad公司)。
1.3 实验方法
1.3.1 模型复制与标本处理 HOPE-MED8050动式染尘控制系统参数:染毒室容积0.3 m3,柜内温度20~25℃,湿度70%~75%,压力-50~50 Pa,氧气浓度20%,进气流速3.0~3.5m3/h,粉尘进入速度为2.0~2.5 ml/min,柜内粉尘质量浓度为2 000 mg/m3。健康雄性Wistar大鼠60只随机分对照组、2周组、4周组、8周组、12周组、16周组,每组10只。每只动物染尘3 h/d,至相应时段处死大鼠,对照组不染尘,常规喂养16周后处死。取右下肺放入4%多聚甲醛固定,常规石蜡包埋,5μm连续切片。其余肺组织放入液氮速冻后,置入-80℃冰箱冷冻保存。
1.3.2 Masson三色染色观察肺组织病理形态 石蜡切片常规脱蜡至水。Weigert铁苏木素染5~10 min,流水冲洗。1%盐酸酒精分化,流水冲洗数分钟。丽春红酸性品红染液染5~10 min,蒸馏水稍洗。磷钼酸溶液短时处理约1 min,直接用苯胺蓝染液复染1~2 min。无水酒精脱水,二甲苯透明,中性树胶封固。
1.3.3 免疫组织化学染色检测大鼠肺组织α-SMA蛋白的定位表达 石蜡切片脱蜡至水。0.3%双氧水H2O2室温封闭内源性过氧化物酶15 min。枸橼酸盐高压修复抗原。滴加一抗(α-SMA为1∶200),4℃孵育过夜。磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗3次,5 min/次。滴加通用型二抗(羊抗兔/鼠)37℃孵育30 min,PBS冲洗3次,5 min/次,细胞色素氧化酶二氨基联苯胺显示法显色,苏木素复染细胞核,流水返蓝,脱水透明中性树胶封片。
1.3.4 Western blot检测α-SMA、CollagenⅠ、Fn、Gαs、Gαi2/3及cAMP的含量 称取50 mg肺组织,加入500 μl含蛋白酶抑制剂的放射免疫沉淀测定裂解液,充分剪碎匀浆,冰上超声震荡使蛋白解交联,4℃、12 000 r/min离心15 min,提取上清蛋白,5×上样缓冲液配蛋白。进行上样电泳及电转。一抗(CollagenⅠ、α-SMA、Fn、β-actin抗体1∶500稀释;Gαs、Gαi2、Gαi3抗体1∶200稀释)4℃孵育过夜,二抗溶液(1∶5 000稀释),37℃孵育30 min,增强化学发光试剂显色,采用Image-Proplus图像处理软件对条带进行分析,以目的蛋白光密度值与内参蛋白光密度值的比值作为该蛋白的相对表达量。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,进行完全随机设计的单因素方差分析(One-way ANOVA),进一步两两比较用q检验,P<0.05为差异有统计学意义。

图1 矽肺大鼠肺组织Masson染色 (×200)
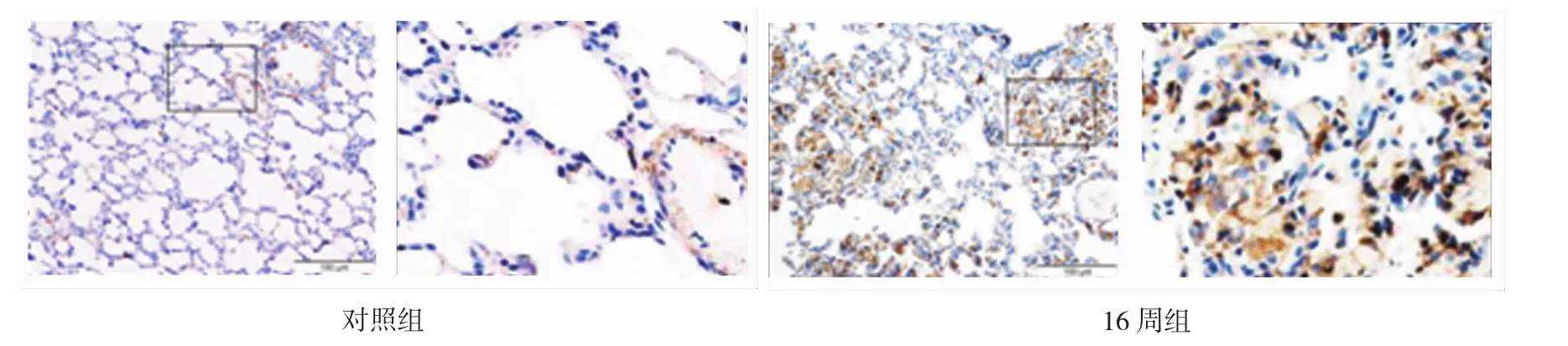
图2 矽肺大鼠α-SMA的表达 (免疫组织化学法×200)
2 结果
2.1 肺组织形态学改变
Masson三色染色显示,自矽肺模型4周组细胞性结节形成区域出现蓝紫色胶原沉积,矽肺模型8周和12周组大鼠肺组织可见肺泡间隔增宽明显,且细胞性结节数量增多,可见部分细胞性结节的融合。矽肺模型16周组肺组织内可见多个细胞性结节的融合和间质纤维化的形成,并可见细胞纤维性矽结节的形成,随模型复制时间的延长纤维化病变区域胶原沉积逐渐增加。见图1。
2.2 大鼠肺组织α-SMA蛋白的定位表达
免疫组织化学法结果显示,在对照组α-SMA阳性表达于气管及血管平滑肌。在矽肺模型16周组α-SMA标记的肌成纤维细胞主要位于结节周边及间质纤维化病变区域。见图2。
2.3 大鼠肺组织CollagenⅠ、α-SMA及Fn蛋白表达的变化
Western blot结果显示,大鼠矽肺组织中CollagenⅠ、α-SMA及Fn的蛋白表达自模型4周组开始上调,其中,CollagenⅠ在矽肺模型4周组、8周组、12周组及16周组的表达分别是对照组2.17、3.00、4.12和5.71倍,差异有统计学意义(P<0.05)。矽肺模型4周组、8周组、12周组及16周组α-SMA的表达分别是对照组1.81、3.08、3.87和4.95倍,差异有统计学意义(P<0.05)。Fn在矽肺模型4周组、8周组、12周组及16周组的表达分别为对照组的2.00、3.92、5.15和6.88倍,差异有统计学意义(P<0.05)。矽肺模型2周组、4周组、8周组、12周组及16周组组间比较,CollagenⅠ、α-SMA及Fn蛋白表达差异有统计学意义(P<0.05)。见表1和图3。
表1 矽肺大鼠CollagenⅠ、α-SMA及Fn的表达变化(n=10,±s)

表1 矽肺大鼠CollagenⅠ、α-SMA及Fn的表达变化(n=10,±s)
注:1)与对照组比较,P<0.05;2)与2周组比较,P<0.05;3)与4周组比较,P<0.05;4)与8周组比较,P<0.05;5)与12周组比较,P<0.05
?

图3 矽肺大鼠CollagenⅠ、α-SMA及Fn的表达
2.4 大鼠肺组织Gαs、Gαi2、Gαi3及cAMP蛋白表达的变化
Western blot检测结果显示,Gαs蛋白表达在矽肺模型8周组、12周组及16周组逐渐下降,分别是对照组的52.46%、43.17%和22.95%,差异有统计学意义(P<0.05)。cAMP的含量在矽肺模型8周组、12周组及16周组分别是对照组的63.53%、61.187% 和44.71%,差异有统计学意义(P<0.05)。Gαi2、Gαi3蛋白表达在矽肺模型4周组、8周组、12周组及16周组逐渐升高,其中Gαi2蛋白表达分别是对照组的3.20、4.30、6.80和7.70倍;与对照组比较,Gαi3蛋白表达分别是其2.15、2.92、3.58和4.15倍,差异有统计学意义(P<0.05)。矽肺模型2周组、4周组、8周组、12周组及16周组各组间比较,Gαs、Gαi2、Gαi3及cAMP的表达差异有统计学意义(P<0.05)。见表2和图4。
表2 矽肺大鼠Gαs、Gαi2、Gαi3及cAMP的表达变化 (n=10,±s)
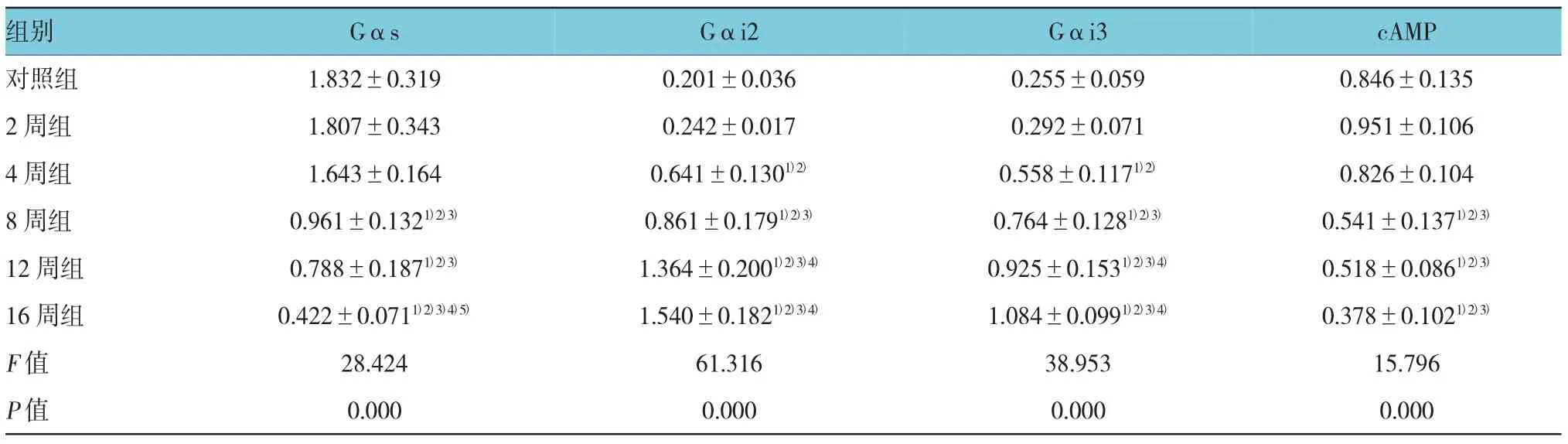
表2 矽肺大鼠Gαs、Gαi2、Gαi3及cAMP的表达变化 (n=10,±s)
注:1)与对照组比较,P<0.05;2)与2周组比较,P<0.05;3)与4周组比较,P<0.05;4)与8周组比较,P<0.05;5)与12周组比较,P<0.05
?

图4 矽肺大鼠Gαs、Gαi2、Gαi3及cAMP的表达
3 讨论
目前研究认为,肌成纤维细胞是导致肺组织弥漫性纤维化的主要效应细胞,在肺纤维化时肌成纤维细胞可来自肺间质成纤维细胞的转化[6],内皮细胞间质转化[7],上皮-间质转化[8],周细胞[9]或胸膜间皮细胞[10]的转化。无论何种来源,肌成纤维细胞都能特异性表达α-SMA。本研究中免疫组织化学染色显示,在矽肺模型组16周组中,α-SMA标记的肌成纤维细胞位于结节周边及间质纤维化区域,Westernblot检测结果显示,与对照组比较,矽肺模型组4~16周组α-SMA蛋白表达逐渐升高。提示矽肺模型中有大量活化的肌成纤维细胞。Masson三色染色显示,在结节及纤维化病变区域出现蓝紫色胶原沉积,并随染尘时间的延长胶原沉积逐渐增加。同时肺组织Collagen I、Fn的蛋白表达自矽肺模型4周组开始上调,至矽肺模型16周组达最高,提示随模型制备时间的延长,细胞外基质的生成逐渐增高。以上结果表明,经HOPE-MED8050动式染尘系统成功复制矽肺大鼠模型,矽肺病变进行性加重。
第二信使cAMP广泛参与细胞多种功能的调控。cAMP是鸟苷酸结合蛋白信号级联的第二信使。活化的Gαs可激活AC催化腺嘌呤核苷三磷酸产生cAMP;相反,激活的Gαi则抑制AC活性,导致cAMP水平降低。另外,cAMP的浓度还与磷酸二酯酶(Phosphodiesterase,PDE)有关,PDE可催化cAMP水解,进而减弱或终止cAMP信号分子的作用。研究报道,偶联到Gαs的受体,如腺苷A2B受体,通过增加cAMP产生,可抑制成纤维细胞向肌成纤维细胞的转化,并减少胶原合成[11]。Gαi2G184S突变小鼠Gαi2信号表达增强,其心肌成纤维细胞增殖和胶原纤维基因表达明显增强[12]。Gαi2缺陷小鼠在脂多糖诱导的肺损伤中巨噬细胞的聚集减少,且降低RAW 264.7细胞的运动和迁移[13]。本研究表明,Gαs/Gαi平衡可通过调节cAMP水平,抑制细胞外基质的分泌、肌成纤维细胞转化及炎症反应。另有研究显示,采用AC活化剂/PDE抑制剂等均能够有效抑制成纤维细胞增殖和细胞外基质成分的合成[14-15]。以上研究提示,Gαs/Gαi-cAMP信号对纤维化疾病具有重要的调控作用。
在本研究中,Gαs蛋白表达在矽肺模型4周组开始逐渐下降,至16周组达最低,cAMP在肺组织中的变化与Gαs蛋白一致,而Gαi2/3蛋白表达在矽肺模型4周组、8周组、12周组及16周组逐渐升高,并伴随α-SMA、CollagenⅠ和Fn蛋白表达的上调。综合以上结果,cAMP信号在大鼠矽肺纤维化的发生、发展过程中逐渐减弱,cAMP信号的低表达促进矽肺的发展。
[1]徐洪.Ac-SDKP抗矽肺纤维化作用的新靶向—肌成纤维细胞分化和差异蛋白的筛选[D].石家庄:河北医科大学,2012.
[2]HOYLE G W.Mitigation of chlorine lung injury by increasingcyclic AMP levels[J].Proc Am Thorac Soc,2010,7(4):284-289.
(童颖丹 编辑)
[3]PENKE L R,HUANG S K,WHITE E S,et al.Prostaglandin E2 inhibits α-smooth muscle actin transcription during myofibroblast differentiation via distinct mechanisms of modulation of serum response factor and myocardin-related transcription factor-A[J].J Biol Chem,2014,289(24):17151-17162.
[4]LOPEZ-SANCHEZ I,DUNKEL Y,ROH Y S,et al.GIV/Girdin is a central hub for profibrogenic signalling networks during liver fibrosis[J].Nat Commun,2014,5:4451.
[5]MILLER C L,CAI Y,OIKAWA M,et al.Cyclic nucleotide phosphodiesterase 1A:a key regulator of cardiac fibroblast activation and extracellular matrix remodeling in the heart[J].Basic Res Cardiol,2011,106(6):1023-1039.
[6]TUMELTY K E,SMITH B D,NUGENT M A,et al.Aortic carboxypeptidase-like protein (ACLP)enhances lung myofibroblast differentiation through transforming growth factor β receptor-dependent and-independent pathways[J].J Biol Chem,2014,289(5):2526-2536.
[7]HASHIMOTO N,PHAN S H,IMAIZUMI K,et al.Endothelial-mesenchymal transition in bleomycin-induced pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2010,43(2):161-172.
[8]ZHOU B,LIU Y,KAHN M,et al.Interactions between β-catenin and transforminggrowth factor-β signalingpathwaysmediate epithelial-mesenchymal transition and are dependent on the transcriptional co-activator cAMP-response element-binding protein (CREB)-binding protein (CBP)[J].J Biol Chem,2012,287(10):7026-7038.
[9]MARRIOTT S,BASKIR R S,GASKILL C,et al.ABCG2pos lung mesenchymal stem cells are a novel pericyte subpopulation that contributes to fibrotic remodeling[J].Am J Physiol Cell Physiol,2014,307(8):C684-C698.
[10]ZOLAK J S,JAGIRDAR R,SUROLIA R,etal.Pleural mesothelial cell differentiation and invasion in fibrogenic lung injury[J].Am J Pathol,2013,182(4):1239-1247.
[11]DUBEY R K,GILLESPIE D G,ZACHARIA L C,et al.A(2b) receptors mediate the antimitogenic effects of adenosine in cardiac fibroblasts[J].Hypertension,2001,37(2Pt2):716-721.
[12]KAUR K,PARRA S,CHEN R,et al.Gαi2 signaling:friend or foe in cardiac injury and heart failure[J].Naunyn Schmiedebergs Arch Pharmacol,2012,385(5):443-453.
[13]WIEGE K,LE D D,SYED S N,et al.Defective macrophage migration in Gαi2-but not Gαi3-deficient mice[J].J Immunol, 2012,189(2):980-987.
[14]SCHINNER E,WETZL V,SCHLOSSMANN J.Cyclic nucleotide signalling in kidney fibrosis[J].Int J Mol Sci,2015,16(2):2320-2351.
[15]GOBEJISHVILI L,BARVE S,BREITKOPF-HEINLEIN K,et al.Rolipram attenuates bile duct ligation-induced liver injury in rats:a potential pathogenic role of PDE4[J].J Pharmacol Exp Ther,2013,347(1):80-90.
Influence of cAMP signal on pathogenesis of silicotic fibrosis*
Yong-wei Ding1,Yu-cong Geng1,Yan Liu1,Hong Xu2,Li-juan Zhang2, Rui-xue Wang1,Jian-hui Wang1,Qi-feng Hu3,Fang Yang1
(1.Basic Medical College;2.Research Center of Medical Experiment,North China University of Science and Technology,Tangshan,Hebei 063009,China;3.Department of Trauma, the Second Hospital of Tangshan City,Tangshan,Hebei 063000,China)
ObjectiveTo observe the changes of cyclic adenosine monophosphate(cAMP)signal in pathogenesis and development of silicotic fibrosis.Methods A HOPE-MED8050 exposure control apparatus was used to copy the silicosis model.Male Wistar rats were randomly divided into 6 groups (10 in each group) and the rats inhaled dust respectively for 0,2,4,8,12 and 16 w.Masson trichrome staining was performed to observe the histomorphology of the lung tissues.The expressions of α smooth muscle actin (α-SMA),collagenⅠ,fibronectin (Fn),stimulatory G protein α (Gαs),inhibitory G protein α (Gαi2/3)and cAMP were detected by immunohistochemistry and Western blot respectively.Results Masson trichrome staining revealed bluish-purple collagen deposition in the 4-w silicosis group,and the collagen deposition in the fibrotic lesions increased with the time of exposure to silica.Immunohistochemical results showed that in the control group positive α-SMA expression was seen in the trachea and vascular smooth muscles,while in the 16-w silicosis group α-SMA was observed around the fibrotic nodules and in the interstitial fibrotic area.The expressions of α-SMA,collagen I,Fn and Gαi2/3 proteins gradually increased in the 4-w,8-w,12-w and 16-w silicosisgroups compared with the control group.As compared to the control group,the expressions of Gαs and cAMP significantly decreased in the 8-w silicosis group,and were the lowest in the the 16-w silicosis group. Conclusions cAMP expression decreases along with the pathogenesis and development of silicosis,and cAMP has a significant role in silicotic formation.
silicosis;myofibroblast;cyclic adenosine monophosphate
R135.2
A
10.3969/j.issn.1005-8982.2017.06.001
1005-8982(2017)06-0001-05
2016-05-05
国家自然科学基金(No:81472953);河北省自然科学基金青年基金(No:H2016209161);华北理工大学大学生创新计划(No:X2016218)
刘燕,E-mail:liuyan.zone@163.com;Tel:13582526275

