成纤维细胞生长因子21对内质网应激诱导心肌细胞凋亡的影响及其机制研究
梁平平, 仲琳,龚磊,王佳慧,杨军
基础与实验研究
成纤维细胞生长因子21对内质网应激诱导心肌细胞凋亡的影响及其机制研究
梁平平, 仲琳,龚磊,王佳慧,杨军
目的:探讨成纤维细胞生长因子21(FGF21)在内质网应激(ERS)诱导心肌细胞凋亡中的保护作用及其作用机制。
成纤维细胞生长因子;内质网;肌细胞,心脏;凋亡
(Chinese Circulation Journal, 2017,32:279.)
成纤维细胞生长因子21(FGF21)是FGFs家族的一名新成员,其主要作用是参与糖脂代谢的调节[1]。近年来发现FGF21也可以作为心血管系统重要的保护因子,在减少心肌梗死面积、减缓动脉粥样硬化的进展、减少心肌缺血再灌注损伤中具有重要的作用[2-4]。内质网应激(ERS)是导致高血压、心肌缺血、动脉粥样硬化、心肌肥厚、心力衰竭等发生发展的重要病理生理机制之一[5-7]。但是FGF21能否抑制内质网应激炎症反应,从而减少内质网应激诱导的心血管疾病发生发展尚少见报道。本研究通过衣霉素(TM)构建内质网应激模型,观察FGF21在心肌细胞中过表达对内质网应激诱导心肌细胞凋亡的影响。
1 材料和方法
材料:H9c2细胞(上海中国科学院细胞库);胎牛血清(FBS)、DMEM(Dulbecco改良的Eagle培养基)高糖型细胞培养液(Gibco,美国);FGF21抗体(abcam,美国); PERK抗体、phosphor-PERK抗体;核糖体真核生物起始因子2α(eIF2α)抗体、phosphor-eIF2α抗体、转录激活因子4(ATF4)抗体、JNK抗体、phosphor-JNK抗体、半胱氨酸天冬氨酸蛋白酶3剪切体(c-caspase-3)抗体(Cell Signaling Technology,美国);B淋巴细胞瘤-2(Bcl-2)抗体、Bcl-2的相关X蛋白(Bax)抗体(武汉博士德生物工程有限公司,中国);葡萄糖调节蛋白78(GRP78)抗体、CCAAT/ 增强子结合蛋白同源蛋白(CHOP)抗体、β-肌动蛋白(β-actin)抗体(Santa Cruz,美国);逆转录试剂盒、聚合酶链反应(PCR)试剂盒(大连宝生物工程有限公司);衣霉素、RNA提取试剂盒、总蛋白质提取试剂盒(上海生工生物工程股份有限公司);X-tremeGENE转染试剂盒(Roche,美国);CCK8试剂盒(Dojindo,日本);Tunel细胞凋亡检测试剂盒、(南京凯基生物科技发展有限公司)。
细胞培养与内质网模型的建立:H9c2细胞常规培养于含10%FBS的高糖型DMEM中,置于37℃5% CO2细胞培养箱中。将H9c2细胞以1×106/孔接种于6孔板中,衣霉素于二甲基亚砜(DMSO)中溶解,待细胞培养至80 %融合时加入衣霉素至终浓度10 μM 继续培养24 h。
pcDNA4-FGF21质粒的构建:按照Trizol试剂盒说明书提取H9c2细胞总RNA。取RNA模板1 μg逆转录合cDNA。应用软件Primer Designer 5 .0 设计引物。上游5’-CCGAATTCGCCGCCACCA TGGACTGGATGAAATCTAGAGTTGGGGCC-3’;下游5’-GGCTCGAGAGATGCATAGCTGGGGCTTCGGCCT TG-3’,在上、下游引物中分别引入EcoRI和XhoI酶切位点,以H9c2细胞cDNA为模板进行PCR扩增大鼠全长FGF21基因(627bp),条件为:95℃ 5 min,94℃ 30 s,61℃ 30 s,72℃ 1 min,72℃10 min,共35个循环。后续PCR 产物纯化、切胶回收、酶切均按照试剂盒说明书进行。在T4 DNA 连接酶的作用下,将FGF21目的片段与pcDNA4/To/ mychis相连。经转化、涂板后,挑取单克隆菌落,测序。测序正确者扩大培养,提取质粒DNA 并测定浓度。
pcDNA4-FGF21质粒转染与分组:按照转染试剂说明书进行转染,以转染 pcDNA4空载体质粒为转染阴性对照。转染48 h后,加入衣霉素至终浓度为10 μΜ,继续培养24 h。实验分为4个组:对照组、衣霉素处理组、pcDNA4-FGF21+衣霉素组、pcDNA4 + 衣霉素组。
蛋白免疫印迹(Western blotting)检测蛋白表达:提取各实验组细胞的蛋白并测定蛋白浓度,取50 μg蛋白上样,SDS-PAGE电泳,蛋白充分分离后,转至聚偏氟乙烯(PVDF)膜,封闭液室温封闭1h,加入一抗4℃过夜,洗膜3次,每次10 min,加入相应二抗室温孵育1 h,洗膜后加入电化学发光(ECL)液显影,β-actin作为对照,利用ImageJ软件计算条带灰度比,利用统计软件进行统计分析。
细胞计数试剂盒( CCK8)检测细胞活力[8]:H9c2细胞以7×103/孔的密度接种于96孔培养板中,培养至80 %融合时,按上述细胞分组处理细胞,在各实验组中加入100 μl的无血清DMEM培养基以及10 μl的CCK8溶液,继续培养4h,用酶联免疫检测仪在450 nm处检测OD值,细胞存活率(%)=(实验组OD 值-空白对照组OD 值)/(对照组OD 值-空白对照组OD 值)× 100%,每组设3孔,结果取均值,所得比值进行统计分析。
细胞凋亡水平检测(Tunel):H9c2细胞以1×105/孔的密度接种于细胞爬片上,培养至80 %融合时。按上述细胞分组处理细胞,4%的多聚甲醛室温固定30 min后,0.5%的聚乙二醇辛基苯基醚(TritonX-100)室温通透10 min,加入TAD酶反应液,37℃避光反应60 min,漂洗3次后,加入SF标记液37℃避光反应30 min,1%的4',6-二脒基-2-苯基吲哚(DAPI)染核10 min,加入抗荧光淬灭剂,封片。在共聚焦显微镜下观察并拍照,每个实验组随机选择5个视野拍照,计算凋亡细胞的数目和比值。
统计学分析:使用spss19.0软件包进行统计分析,计量数据以表示,多组均数间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 pcDNA4-FGF21成功构建并转染于心肌细胞:
pcDNA4/To/myc-his-FGF21真核质粒,经EcoR I、XhoI 双酶切(图 1A)和测序鉴定,并通过Western blot 检测myc标签蛋白和FGF21过表达蛋白,从而证实pcDNA4-FGF21质粒构建正确并成功表达于H9c2细胞(图1B)。
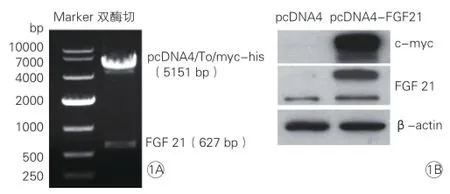
图1 FGF21质粒构建和在H9c2细胞中过表达
2.2 内质网应激诱导心肌细胞FGF21的表达(图2):
与对照组相比,衣霉素处理组、pcDNA4 + 衣霉素组和pcDNA4-FGF21 +衣霉素组FGF21的表达增加(P<0.01)。与衣霉素处理组及pcDNA4 + 衣霉素组比较,pcDNA4-FGF21 +衣霉素组FGF21表达增加(P<0.01)。

图2 内质网应激诱导心肌细胞FGF21的表达
2.3 FGF21过表达抑制内质网应激中PERK 和JNK介导的凋亡信号通路
与对照组相比,PERK介导的凋亡相关通路p-PERK、 p-eIF2α、 ATF4、CHOP蛋白表达水平在衣霉素处理组和pcDNA4 + 衣霉素组显著增加(P<0.05~0.01)。而与衣霉素处理组和pcDNA4 + 衣霉素组相比,pcDNA4-FGF21 +衣霉素组p-PERK、p-eIF2α、ATF4和CHOP蛋白表达水平则明显降低(P<0.05~0.01)(图3A)。
我们同样检测了JNK介导的凋亡通路主要蛋白表达,发现与对照组相比,在衣霉素和pcDNA4 +衣霉素组中促凋亡蛋白p-JNK、GRP78、c-caspase-3、Bax/ Bcl-2蛋白表达水平显著增加(P<0.05~0.01)。而与衣霉素处理组和pcDNA4 + 衣霉素组相比,在pcDNA4-FGF21 +衣霉素组p-JNK、GRP78、c-caspase-3、Bax/ Bcl-2蛋白表达水平明显降低(P<0.05~0.01)(图3B)。
2.4 FGF21过表达减轻内质网应激诱导的心肌细胞损伤
Tunel 染色后,胞核萎缩、碎裂、不规则,呈绿色颗粒的细胞即为凋亡细胞。结果显示,衣霉素处理组和pcDNA4 + 衣霉素组细胞凋亡率较对照组显著增加(P<0.01),而pcDNA4-FGF21 +衣霉素组细胞凋亡率则低于衣霉素处理组和pcDNA4 + 衣霉素组(P<0.01)(图4A)。CCK8结果显示:与对照组相比,细胞存活率在衣霉素组和pcDNA4 + 衣霉素组明显降低(P<0.05~0.01),与pcDNA4 + 衣霉素组和衣霉素处理组相比,pcDNA4-FGF21 +衣霉素组细胞存活率则升高(P<0.05)(图4 B)。
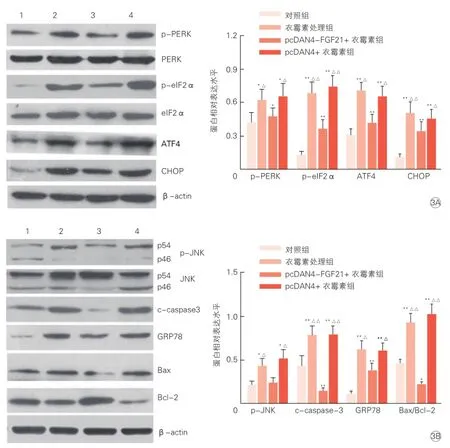
图3 FGF21抑制心肌细胞PERK和JNK介导的凋亡通路主要相关蛋白的表达
3 讨论
大量研究证明内质网应激炎症反应贯穿于心肌细胞损伤的全过程[9],内质网应激导致大量未折叠蛋白的积聚,启动未折叠蛋白反应(URP),URP主要包括三个跨膜蛋白受体:PERK、活化转录因子6(ATF6)和肌醇需求激酶1(IRE1)。这三个受体的激活可以诱导多种炎症因子的合成与释放,启动炎症反应,引起细胞凋亡[10],其中,PERK和IRE1-JNK介导的凋亡通路是内质网应激诱导细胞的特征性通路,然而FGF21在心血管系统的保护作用是否与减轻内质网应激有关及其作用机制尚不清楚。
本实验通过有效剂量的衣霉素构建内质网应激模型[11],发现内质网应激明显诱导心肌细胞FGF21的表达,提示内质网应激诱导FGF21的表达可能是心肌细胞进行功能代偿和自我保护的一个反应。为了进一步检测FGF21对内质网应激诱导心肌细胞凋亡的影响,我们通过FGF21在H9c2细胞中过表达,发现FGF21可以明显减少PERK介导促凋亡通路主要相关蛋白:p-PERK,p-eIF2α,ATF4和CHOP蛋白表达。研究证明PERK-eIF2α-ATF4-CHOP通路是UPR最重要的促凋亡信号通路,GRP78与PERK解离,激活eIF2α,从而促进 ATF4诱导多种基因编码促凋亡蛋白。其中CHOP作为内质网应激执行凋亡的关键蛋白,被上游信号ATF4大量激活和释放,从而诱导细胞走向凋亡[12]。因此FGF21通过抑制 PERK介导的促凋亡通路,从而减少内质网应激诱导的细胞凋亡。
此外,IRE1-JNK信号通路也是内质网应激中的重要促凋亡通路,在内质网应激时,JNK发生磷酸化,诱导Bax/Bcl-2蛋白的表达,从而促进细胞凋亡,另外JNK还可以促进线粒体中细胞色素C向胞浆释放,激活caspase-3,诱导细胞凋亡[13]。在我们研究中,FGF21过表达明显减少JNK磷酸化水平,其介导的促凋亡蛋白c-caspase 3、GRP78和Bax/Bcl-2的表达明显降低,内质网应激炎症反应得到明显的改善,因此FGF21通过抑制内质网应激相关凋亡信号通路,减少心肌细胞凋亡。

图4 FGF21过表达减少内质网应激诱导的心肌细胞凋亡
本实验证实内源性FGF21在心肌细胞内质网应激中表达上调,提示内质网应激诱导FGF21的表达可能是心肌细胞抵抗内质网应激损伤的自身代偿反应。我们进一步研究发现FGF21过表达明显减少内质网应激诱导的心肌细胞凋亡,其机制可能部分与抑制内质网应激中PERK和JNK介导的凋亡通路信号传导有关,但其更进一步的信号机制还需深入研究。
[1] 付坤, 刘景华. 成纤维细胞生长因子FGF21: 从生理作用到临床研究. 中国循环杂志, 2014, 29: 309-311.
[2] Planavila A, Redondo-Angulo I, Villarroya F. FGF21 and cardiac physiopathology. Front Endocrinol (Lausanne), 2015, 6: 133.
[3] Liu SQ, Roberts D, Kharitonenkov A, et al. Endocrine protection of ischemic myocardium by FGF21 from the liver and adipose tissue. Sci Rep, 2013, 3: 2767.
[4] Chow WS, Xu A, Woo YC, et al. Serum fibroblast growth factor-21 levels are associated with carotid atherosclerosis independent of established cardiovascular risk factors. Arterioscler Thromb Vasc Biol, 2013, 33: 2454-2459.
[5] Sun Y, Zhang T, Li L, et al. Induction of apoptosis by hypertension via endoplasmic reticulum stress. Kidney Blood Press Res, 2015, 40: 41-51.
[6] Sozen E, Karademir B, Ozer NK. Basic mechanisms in endoplasmic reticulum stress and relation to cardiovascular diseases. Free Radic Biol Med, 2015, 78: 30-41.
[7] Liu J, Ren F, Cheng Q, et al. Endoplasmic reticulum stress modulates liver inflammatory immune response in the pathogenesis of liver ischemia and reperfusion injury. Transplantation, 2012, 94: 211-217.
[8] Zhao GL, Yu LM, Gao WL, et al. Berberine protects rat heart from ischemia/reperfusion injury via activating JAK2/STAT3 signaling and attenuating endoplasmic reticulum stress. Acta Pharmacol 2016, 37: 354-367.
[9] Zhang K, Kaufman RJ. From endoplasmic-reticulum stress to the inflammatory response. Nature, 2008, 454: 455-462.
[10] Guo X, Ren F, Zhang X, et al. Endoplasmic reticulum stress collaborates with lipopolysaccharide to promote the inflammatory response in macrophages. Zhonghua Gan Zang Bing Za Zhi, 2015, 23: 604-608.
[11] Hwang HJ, Jung TW, Ryu JY, et al. Dipeptidyl petidase-IV inhibitor (gemigliptin) inhibits tunicamycin-induced endoplasmic reticulum stress, apoptosis and inflammation in H9c2 cardiomyocytes. Mol Cell Endocrinol, 2014, 392: 1-7.
[12] 顾晨, 李俊明. 内质网应激致2型糖尿病缺血心肌易损性增强的机制研究. 中国循环杂志, 2016, 31: 91-95.
[13] Zhang J, Xia Y, Xu Z, et al. Propofol Suppressed Hypoxia/ Reoxygenation-Induced Apoptosis in HBVSMC by Regulation of the Expression of Bcl-2, Bax, Caspase3, Kir6. 1, and p-JNK. Oxid Med Cell Longev, 2016, 2016: 1518738.
Effect of Fibroblast Growth Factor 21 on Endoplasmic Reticulum Stress Induced Rat’s H9c2 Cardiomyocyte Apoptosis With its Mechanism
LIANG Ping-ping, ZHONG Lin, GONG Lei, WANG Jia-hui, YANG Jun.
Department of Cardiology, Yantai Yuhuangding Hospital, Affiliated Hospital of Qingdao University Medical College, Yantai (264000), Shandong, China
YANG Jun, Email: yangjun19640124@163.com
Objective: To explore the protective roll of fibroblast growth factor 21 (FGF21) in endoplasmic reticulum stress (ERS) induced rat’s H9c2 cardiomyocyte apoptosis with its mechanism.Methods: pcDNA4 was used as gene vector, pcDNA4-FGF21 plasmid was constructed and transfected into rat’s H9c2 myocardiocytes for 48 h. ERS model was established by 10 μM tunicamycin (TM) induction for 24 h. The experiment was conducted in 4 groups:①Control group,②TM group, the cells were treated by TM,③pcDNA4-FGF21+TM group,④pcDNA4+TM group. The expressions of FGF21, protein kinase R-like ER kinase (PERK) and c-Jun N-terminal kinases (JNK) mediated apoptosis pathway related protein were measured by Western blot analysis; cell survival rate was examined by CCK-8 method and apoptosis rate was detected by TUNEL technique.Results: pcDNA4-FGF21 vector was successfully constructed and overexpressed in H9c2 myocardiocytes. Compared with Control group, TM group and pcDNA4+TM group had up-regulated endogenous FGF21 expression, increased PERK and JNK mediated apoptosis pathway related protein expression; reduced cell survival rate and elevated apoptosis rate. Compared with TM group and pcDNA4+TM group, pcDNA4-FGF21+TM group had down-regulated PERK and JNKmediated apoptosis pathway related protein expression; increased cell survival rate and decreased apoptosis rate.Conclusion: FGF21 overexpression can reduce ERS induced apoptosis rat’s H9c2 myocardiocytes which might be partly related for inhibiting PERK and JNK mediated signal transduction of apoptosis pathway.
Fibroblast growth factor; Endoplasmic reticulum; Myocyte, cardiac; Apoptosis
2016-04-28)
(编辑: 汪碧蓉)
264000 山东省烟台市,青岛大学医学院附属烟台毓璜顶医院 心内科(梁平平,仲琳,杨军),生物芯片(龚磊), 中心实验室(王佳慧)
梁平平 住院医师 硕士 主要从事心肌缺血再灌注损伤的研究 Email:liangpingping1019@163.com 通讯作者:杨军Email:yangjun19640124@163.com
R541
A
1000-3614(2017)03-0279-05
10.3969/j.issn.1000-3614.2017.03.017
方法: 以pcDNA4为基因载体,构建pcDNA4-FGF21质粒并转染H9c2大鼠心肌 细胞48h,加入衣霉素(TM)10 μM处理24h构建内质网应激模型,实验分为4个组:对照组、衣霉素处理组、pcDNA4-FGF21 +衣霉素组、pcDNA4 + 衣霉素组。利用蛋白免疫印迹(Western blot)方法检测FGF21蛋白及蛋白激酶R样ER激酶(PERK)和c-Jun氨基末端激酶(JNK)介导的凋亡通路相关蛋白的表达。利用CCK8检测细胞存活率和TUNEL检测细胞凋亡率。
结果:成功构建pcDNA4-FGF21质粒并在H9c2细胞中过表达。与对照组相比,衣霉素处理组和pcDNA4 + 衣霉素组明显上调H9c2细胞内源性FGF21的表达(P<0.01),以及增加PERK和JNK介导的凋亡通路相关蛋白的表达(P<0.05~0.01),减少细胞存活率和提高细胞凋亡水平(P<0.05~0.01)。与衣霉素处理组和pcDNA4 + 衣霉素组相比,在pcDNA4-FGF21 +衣霉素组明显降低PERK和JNK介导的凋亡通路相关蛋白的表达,增加细胞存活率,降低细胞凋亡水平(P<0.05~0.01)。
结论: FGF21过表达可以减轻内质网应激诱导心肌细胞的凋亡,其机制可能部分与抑制内质网应激中PERK和JNK介导促凋亡通路的信号传导有关。

