太子参新品种“施太1号”区域试验稳定性评价
肖承鸿+周涛+江维克+杨昌贵+周洁+康传志+黄艳+宋健

[摘要]该文分析太子参新品种“施太1号”的田间稳定性与适应性,为太子参新品种的审定和推广应用提供参考。选择4个不同种植区域,以“黔太子参1号”(品种)和“SB-C”(品系)为对照,测量农艺性状、药材性状、药材品质等指标,比较3个品种(系)在不同种植区域间的表型差异。结果表明相比2个对照品种(系),18个农艺性状中“施太1号”有10个性状区域间变异系数最小,其他8个性状处于中间;8个药材性状和品质指标中浸出物含量、太子参环肽B含量、50 g块根数、单个块根重、单株药材重5个指标区域间变异系数在3个品种(系)中最小;基于3个品种(系)在4个种植区域间的表型差异,可划分为3类,新品种“施太1号”单独聚为一类,而“黔太子参1号”和“SB-C”存在明显交集。与“黔太子参1号”和“SB-C”相比,新品种“施太1号”在农艺性状、药材性状、药材品质等评价指标方面稳定性、一致性和适应性较好,可作为新品种进行保护、审定和推广应用。
[关键词] 太子参; 施太1号; 品种选育; 区域试验; 稳定性
[Abstract] To provide guidance for certification, popularization and application of Pseudostellariae Radix new variety, the regional adaptation and stabilities of "Shitai No.1" were evaluated. The "Qian taizishen No.1" and "SB-C" varieties (strains) were used as the control varieties. The agronomic, medicinal material traits and medicine quality were used as evaluation index to compare the phenotypic difference of the three varieties (strains) in four planting areas. Compared to the control varieties, 10 agronomic traits of "Shitai No.1" had the smallest coefficient of variation among the 18 agronomic traits, and other 8 agronomic traits placed the middle level. Among 8 medicinal material traits and medicine quality indicators, the coefficient of variation of different regions of the extract content, pseudostellarin B content, the number of 50 g root tuber, the plant medicinal materials weight and weight of single root of "Shitai No.1" were the smallest compare to other varieties (strains). It could be divided into three groups based on the phenotypic difference of the three varieties (strains) in four planting areas. The "Shitai No.1" was classified as one group, while the "Qian taizishen No.1" and "SB-C" had cross clustering. The regional stability of several index about agronomic traits, medicinal material traits and medicine quality of "Shitai No.1" were better than that of the control varieties (strains). "Shitai No.1" was suitable for planting, popularization and application in the appropriate ecological areas of Guizhou province.
[Key words] Pseudostellariae Radix; Shitai No.1; breeding; regional test; stability analysis
中藥材新品种选育的重要目标是药材质量好、产量高、适应性广。品种的适应性是指品种在不同环境条件下表现出较为均一的稳定变化,在各种环境中都表现出高低相对一致的生产性能[1]。区域试验是评价品种稳产性、适应性的重要手段,任何品种都具有区域的适应性,在品质好、产量高的前提下,稳定性好的品种适应性广,可推广的范围就大,而稳定性不理想的品种则只能在其适应的区域和生产条件下推广应用。因此,区域试验品种稳定性评价尤为重要。
太子参为大宗常用中药材,系石竹科植物孩儿参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm.的干燥块根,具有益气健脾、生津润肺之功效[2]。太子参现已在贵州黔东南地区建立了大规模的种植基地,也是贵州省中药材重点发展品种之一。然而,由于种质及产区环境的差异,造成太子参产量、药材性状及质量参差不齐,难以实现商品药材的标准化。目前,太子参药材品质形成研究主要集中在种质评价、栽培条件优选、适宜区划等方面[3-9]。为了保障太子参品质的优良性,有必要开展太子参新品种的选育研究。
本研究是在课题组种质评价的基础上,以药材品质、产量等为目标,系统选育出“施太1号”,该品种具有产量好、药材商品等级高、抗性强等优良特征。为观察验证“施太1号”在贵州地区综合适用性,选择贵州省内4个不同生态类型区域进行新品种区域试验稳定性评价,旨在全面了解“施太1号”适应性,为“施太1号”的品种审定和推广应用提供科学依据。
1 材料与方法
1.1 种质
“施太1号”为课题组选育的品种,对照品种(系)“黔太子参1号”(品种)和“SB-C”(品系)为贵州三泓药业股份有限公司提供。编号为:施太1号(S)、黔太子参1号(Q)和SB-C(C)。
1.2 试验区域
设4个试验区,分别位于贵州施秉县牛大场镇、城关镇,黄平县新州镇和余庆县龙溪镇,编号为:施秉县牛大场镇(ND)、施秉县城关镇(XQ)、黄平县新州镇(HP)和余庆县龙溪镇(YQ)。其中牛大场镇长坳试验区中心海拔941 m,E107°56′42.76″,N27°08′17.17″;新州镇太翁村试验区中心海拔915 m,E107°50′26.18″,N26°57′26.36″;龙溪镇田坝村试验区中心海拔743 m,E107°44′08.19″,N27°17′21.77″;城关镇新桥村试验区中心海拔864 m,E108°01′39.61″,N26°57′32.53″。试验区域均属于高原季风性气候,年平均气温14~16 ℃,年總积温5 500 ℃,无霜期225~294 d,年降水量1 060~1 200 mm。试验区为新开垦,黄壤,微酸性,肥力中等,排灌方便。
1.3 试验设计
采用随机区组设计,4个试验区,每个试验区共设9个小区,每个品种(系)3个重复。小区面积为0.8 m×5 m=4 m2,小区间设置0.4 m空地作为隔离。2014年12月栽种,栽种前将充分发酵腐熟有机肥做基肥撒土面,覆土稍许平栽。株距5~7 cm,覆土7~10 cm,其他田间管理同大田一致。
1.4 农艺性状测量
2015年5月15日,太子参花果期,测量农艺性状,指标包括:株高、冠幅长、冠幅宽、叶片数、叶宽、叶长、主茎粗、主茎节数、茎节长、最长分枝长、闭锁花果数、叶干重、地上生物量12个性状;2015年7月20日,测量块根性状,指标包括:单株块根数、单株块根鲜重、中上部直径、块根长和单株块根干重6个性状。同一试验区每个品种(系)随机取样10个单株,共测120份单株。
1.5 药材性状测量
2015年7月20日,太子参药材采收期采集块根。同一试验区每个品种(系)随机取样10个单株,共得120份单株。此外,每个品种(系)采集250 g左右的混合样本,共得12份混合样本,洗净,烘干(40 ℃)。测量每株药材的质量,并从单株样本中随机选取15个块根测量中上部直径、单个块根重;从混合样本中随机称取50 g,测量50 g药材的块根数。
1.6 浸出物含量测定
依据《中国药典》2015年版第四部水溶性浸出物测定法(通则2201)项下测定[10]。精密称取太子参粉末约4 g,置250 mL的锥形瓶中,精密加水100 mL,密塞,冷浸,前6 h时时振摇,再静置18 h后,滤过,精密取续滤液20 mL,置干燥至恒重的蒸发皿中,水浴蒸干,再于烘箱中(105±5) ℃干燥3 h,置干燥器中冷至室温,精密称重。共测单株样本120份。
1.7 太子参多糖含量测定
依据参考文献[11]中比色法测定多糖含量。
1.7.1 仪器与试剂 紫外-可见分光光度计(CBC Cintra20型,澳大利亚照生公司),电子天平(EL104型,梅特勒-托利多仪器有限公司);葡萄糖对照品(中国食品药品检定研究院,批号110833-201205),乙醇、浓硫酸、苯酚均分析纯。
1.7.2 对照品溶液的配制 精密称取干燥至恒重的无水葡萄糖对照品15.10 mg,置25 mL量瓶,加水溶解并稀释至刻度,即得0.604 g·L-1标准储备液,从中精密吸取1 mL储备液,加水定容至25 mL,配制质量浓度为0.024 2 g·L-1的对照品溶液。
1.7.3 供试品溶液的制备 精密称取粗粉约0.1 g,置100 mL圆底烧瓶中,加80%乙醇70 mL水浴回流30 min,趁热过滤,滤渣用80%热乙醇洗涤2次,每次10 mL,将滤渣及滤纸置原烧瓶中,加水80 mL,90 ℃热浸1 h,趁热过滤,滤渣以热水洗涤3次,每次5 mL,合并滤液与洗液,放冷后加水定容至100 mL,摇匀,精密吸取10 mL定容至50 mL,摇匀,即得供试品溶液。
1.7.4 标准曲线绘制 精密吸取储备液0.5,0.8,1.0,1.3,1.5,1.8 mL,分别置于25 mL量瓶中,加水定容至刻度。分别精密吸取上述各溶液2 mL置于25 mL试管中,依次加入4%苯酚1 mL,浓硫酸5 mL充分混匀,冷却至室温。484 nm波长下测定。以吸光度为纵坐标,对照品浓度为横坐标,绘制标准曲线,得回归方程Y=0.056 6X-0.004 6(r=0.999 6)。表明葡萄糖溶液质量浓度在3.020~10.872 mg·L-1具有良好的线性关系。
1.7.5 含量测定 精密吸取供试液、对照品溶液各2 mL置25 mL试管中,按1.7.4项下自“依次加入4%苯酚1 mL”起操作。多糖含量=[A×C×D×f/W]×100%,式中A为供试液平均吸光度与对照品吸光度之比,C为稀释后葡萄糖标准溶液质量浓度(g·L-1),D为多糖稀释因数,f为多糖换算因子(2.38),W为样品称样量(mg)。共测单株样本120份。
1.8 太子参环肽B含量测定
依据参考文献[12]中HPLC测定太子参环肽B含量。
1.8.1 仪器与试剂 高效液相色谱仪( LC-20AD型,日本岛津);太子参环肽B对照品(中国科学院昆明植物研究所,纯度以95%计),乙腈为色谱纯,甲醇为分析纯,水为娃哈哈纯净水。
1.8.2 色谱条件 C18柱(Wondasil,4.6 mm×250 mm,5 μm);以水为流动相A,乙腈为流动相B,梯度洗脱(0~10 min,2%~10% B;10~40 min,10%~45% B;40~45 min,45%~55% B);检测波长203 nm;柱温30 ℃;流速0.9 mL·min-1。
1.8.3 对照品溶液的配制 精密称定太子参环肽B对照品适量,置量瓶中,加甲醇稀释至刻度,摇匀,制成每1 mL含太子参环肽B 0.453 2 mg的储备液。再取一定量储备液用甲醇稀释成每1 mL含太子参环肽B 18.13 μg的对照品溶液。
1.8.4 供试品溶液的制备 精密称定粉末约2 g,精密加入50 mL甲醇,称重,超声45 min,放冷,称重,用甲醇补足失重,摇匀,滤过,精密移取25 mL续滤液至蒸发皿中,水浴加热浓缩至干,残渣加甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm滤膜,取续滤液作为供试品溶液。
1.8.5 含量测定 分别精密吸取对照品、供试品溶液10 μL进样测量,按外标一点法计算含量。共测单株样本120份。
1.9 太子参氨基酸含量测定
依据参考文献[6]中柱前衍生化-HPLC测定氨基酸含量。
1.9.1 仪器与试剂 高效液相色谱仪(LC-20AD型,日本岛津);氨基酸测定分析包(天津博纳艾杰尔科技有限公司,包括三乙胺,异硫氰酸苯酯,正亮氨酸,17种氨基酸标准溶液,除胱氨酸浓度为1.25 mmol·L-1外,其余氨基酸浓度为2.5 mmol·L-1),乙腈为色谱纯,盐酸为分析纯。
1.9.2 色谱条件 Pntulips C18柱(4.6 mm×250 mm,5 μm);以醋酸钠水溶液为流动相A,以80%乙腈水溶液为流动相B,梯度洗脱(0~5 min,0%~5% B;5~13 min,5% B;13~14.5 min,5%~7% B;14.5~20 min,7%~12% B;20~25 min,12%~23% B;25~35 min,23%~33% B;35~38 min,33%~75% B;38~40 min,75% B;40~45 min,75%~100% B;45~46 min,100%~0% B;46~60 min,0% B);检测波长 254 nm;柱温 30 ℃;流速 1.0 mL·min-1。
1.9.3 供试品溶液的制备 取粉末0.5 g,精密称定,置于25 mL的安瓿瓶中,精密加入含0.1%苯酚的6 mol·L-1盐酸10 mL,振摇使其充分溶解分散,置(110±5)℃烘箱中水解24 h,取出冷却,过滤,精密量取滤液5 mL于蒸发皿中蒸干,残渣加水5 mL溶解,用0.45 μm滤膜过滤,供衍生使用。
1.9.4 衍生化反应 精密量取氨基酸标准溶液及供试品溶液200 μL,分别置于1.5 mL离心管中,向每个离心管中加入正亮氨酸内标溶液20 μL、三乙胺乙腈溶液100 μL、異硫氰酸苯酯乙腈溶液100 μL,摇匀,室温放置3 h,然后加入正己烷400 μL,振摇后放置10 min,取下层溶液,0.45 μm滤膜过滤,取滤液200 μL,加水定容至1 mL,摇匀即得。
1.9.5 含量测定 精密吸取对照品、供试品溶液10 μL,注入液相色谱仪,测定。氨基酸含量=f1×C×V×10-4/f2×W,式中f1=样品中各氨基酸峰面积/正亮氨酸峰面积,f2=标准溶液中各氨基酸峰面积/正亮氨酸峰面积,C=氨基酸标准品质量浓度(mg·L-1),V=样品溶液定容体积,W=称样量(g)。共测单株样本120份。
1.10 数据分析
采用SPSS 17.0计算平均数(X)、标准差(s)及聚类分析;根据结果将所有材料划分为10个等级,按第1级[Xi<(X-2s)]到第10级[Xi>(X+2s)],每0.5s为1级,每1级的相对频率(Pi)用于计算多样性指数,即Shannon-Weiner index(H′)的计算公式如下:H′=-∑Pi×lnPi,式中Pi为某一性状第i级别材料份数占总份数的百分比,Xi为第i级中的数据[13]。
2 结果分析
2.1 不同区域间叶部性状的遗传差异分析
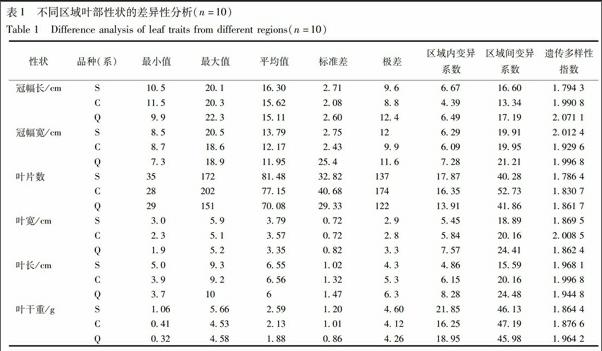
从6个叶部性状分析结果可知,不同性状间变异系数差异较大,在13.34%~52.73%,3个品种(系)叶片数和叶干重区域间变异系数均大于40%;相对于对照品种(系),S品种的叶部性状区域间变异较小,其中冠幅宽(19.91%)、叶片数(40.28%)、叶宽(18.89%)、叶长(15.59%)区域间变异系数在3个品种(系)中最小,冠幅长和叶干重处于第2位;3个品种(系)叶部性状遗传多样性较为丰富,但品种(系)间差异不大,在1.786 4~2.071 1。表明相对于Q品种和C品系,不同试验区域间S品种叶部性状差异性较小,相对稳定,见表1。
2.2 不同区域间茎部及果实性状的遗传差异分析
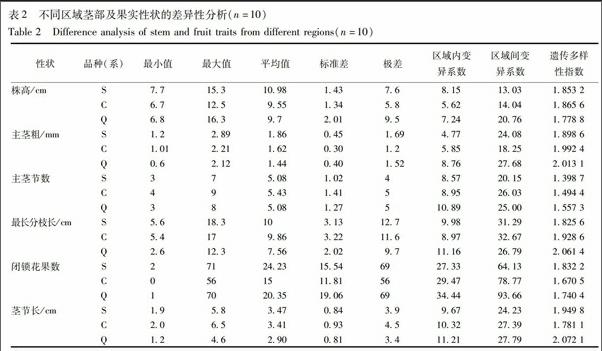
茎部及果实性状分析结果可知,性状间变异系数差异较大,最大的为闭锁花果数,Q品种的区域间变异系数达93.66%,最小的为株高,S品种的区域间变异系数仅为13.03%;相对于对照品种(系),S品种的茎部及果实性状区域间变异较小,6个性状中,株高(13.03%)、主茎节数(20.15%)、闭锁花果数(64.13%)、茎节长(24.23%)4个性状的区域间变异系数在3个品种(系)中最小,主茎粗和最长分枝长处于第2位;除主茎节数外,3个品种(系)茎部及果实性状遗传多样性较为丰富,S品种遗传多样性指数略低于对照品种(系),主茎粗(1.898 6)、主茎节数(1.398 7)、最长分枝长(1.825 6)遗传多样性指数在3个品种(系)中最小。表明相对于Q品种和C品系,不同试验区域间S品种茎部及果实性状差异性较小,相对稳定,见表2。
2.3 不同区域间产量性状的遗传差异分析
3个品种(系)的块根鲜重、地上生物量、地下生物量区域间变异系数较大,均大于36%,而块根粗和块根长区域间变异系数较小(10.17%~20.82%);相对于对照品种(系),6个性状中,S品种的块根粗(10.17%)、块根长(18.74%)的区域间变异系数在3个品种(系)中最小,其他4个性状均处于第2位;3个品种(系)产量性状遗传多样性较为丰富,但品种(系)间差异不大,在1.800 2~2.078 5。表明相对于Q品种和C品系,不同试验区域间S品种产量性状差异性较小,相对稳定,见表3。
农艺性状差异性分析结果表明,相对对照品种(系),S品种的18个农艺性状,有10个性状的区域间变异系数在3个品种(系)中最小,其他8个性状处于第2位,农艺性状的遗传多样性较为丰富。综合叶部、茎部、果实及产量性状的平均值、最大值、最小值、标准差、极差、变异系数和遗传多样性指数,种植在不同试验区的S品种农艺性状较对照品种(系)稳定。
2.4 不同区域药材性状的区域试验比较
3个品种(系)块根的中上部直径、单个块根重和单株药材重结果基本一致,均为ND区域的中上部直径、单个块根重和单株药材重显著高于其他3个区域,而在XQ,HP,YQ区域间无显著差异。相对于对照品种(系),S品种的4个药材性状有3个变异系数最小,分别为单个块根重(25.06%)、单株药材重(14.15%)和50 g块根数(14.07%)。结果表明,ND区域太子参药材产量高、药材商品性状好;相对于Q品种和C品系,不同试验区域间S品种药材性状差异性较小,相对稳定,见表4。
2.5 不同区域药材品质的区域试验比较
多重比较结果显示,4个试验区域的S品种浸出物和多糖含量有3个区域无显著差异,而Q品种和C品系仅有2个区域无显著差异;不同试验区域的S品种和Q品种太子参环肽B含量均无显著差异,而C品系仅3个区域无显著差异;不同试验区域的总氨基酸含量差异较大,S品种和C品系仅2个试验区域无显著差异,Q品种在4个区域均有显著差异。变异系数结果显示,相对于对照品种(系),S品种的4个药材品质有2个变异系数最小,分别为浸出物(7.78%)和太子参环肽B(5.84%),其他2个药材品质的变异系数处于第2位。结果表明,相对于Q品种和C品系,不同试验区域间S品种药材品质差异性较小,相对稳定,见表5。
2.6 不同品种(系)聚类分析结果
依据18个农艺性状、4个药材性状及4个药材品质平均值的相似度,采用SPSS软件进行系统聚类。结果显示,当相似距离為10时,3个品种(系)种植在4个区域的12份样本可分为3类:其中Q品种的4个样本及C品系的2个样本聚为一类,分别为HP-Q,YQ-Q,XQ-Q,ND-Q和ND-C,YQ-C;C品系的HP-C和XQ-C为一类;S品种的YQ-S,HP-S,ND-S和XQ-S单独聚为一类。表明相对于对照品种(系),S品种的性状与这2个品种(系)有明显的差异,且S品种的性状相对较稳定,种植在不同区域的性状相似性较大,并未出现与其他2个品种(系)交叉聚类的现象,见图1。
3 结论与讨论
每个品种都有其适宜种植的区域,把品种与区域特点结合起来,在适宜的区域种植相应的品种,能较大程度地发挥优良品种的优势。区域试验是鉴定品种品质、产量和稳定性的关键内容,是品种审定的必经程序,是品种推广应用不可缺少的重要环节。太子参选育的目的是从现有人工栽培群体中筛选商品规格等级、产量、有效成分含量或抗性优良的品系,进而培育成优良品种。“施太1号”选育研究表明,药材产量、商品等级、多糖含量和太子参环肽B含量优于对照品种(系)(另文发表),其农艺性状、药材性状、药材品质的多个指标的区域试验品种稳定性优于对照品种(系),可在贵州适宜生态区域示范性种植和推广应用。
表型性状受基因和环境双重影响,对品种基因效应、环境效应及两者的相互作用的研究有利于选育广泛适应性或特殊适应性品种,品种区域试验可用区域内平均变异系数和区域间变异系数来评价引起表型差异的因素。本试验结果显示,施太1号(S)、黔太子参1号(Q)和SB-C(C)3个品种(系)所有农艺性状的区域内平均变异系数均未达到区域间变异系数的一半,表明环境差异是引起太子参区域试验品种间产生差异的主要原因。相同品种(系)种植在4个区域的太子参总氨基酸含量也存在显著性差异,说明环境是影响太子参总氨基酸含量的主导因素,这与文献[14]结果一致。
本文所分析的18个农艺性状中,“施太1号”的叶片数、叶长、主茎粗等12个性状的遗传多样性指数略小于“SB-C”,且有10个农艺性状的区域间变异系数在3个品种(系)中最小。这说明“施太1号”农艺性状区域试验品种稳定性较好;但育种使其遗传多样性略有降低。这与文献[15]报道现代育种导致作物遗传多样性的降低,使得作物改良的遗传基础变得越来越狭窄理论一致。
“施太1号”药材性状和品质是否稳定是衡量其稳定性和适应性的重要环节,结果显示,8个药材性状及品质指标中,“施太1号”的浸出物含量、太子参环肽B含量等5个指标的区域间变异系数在3个品种(系)中最小,表明“施太1号”药材性状和品质区域间稳定性较好。多重比较显示,中上部直径、单个块根重、单株药材重、浸出物含量和多糖含量结果差异基本相似,这与文献[11]报道太子参多糖含量与药材外观性状存在显著相关性一致,也提示浸出物含量可能与药材外观性状存在一定的相关性。
本试验对“施太1号”进行了一年多点区域试验研究,初步探讨了“施太1号”在贵州太子参主产区的适应性,缺乏对不同年份随机变化的气候条件适应性的信息,下一步将对“施太1号”进行多年多点区域试验研究,更加全面探讨“施太1号”区域试验品种稳定性和遗传稳定性。
[参考文献]
[1] 俞世蓉.作物品种适应性和产量稳定性问题探讨[J].南京农业大学学报,1989,12(3):17.
[2] 中国药典.一部[S]. 2015:62.
[3] 肖承鸿,周涛,江维克,等.栽培太子参表型性状的遗传多样性分析[J].中药材,2015,38(8):1601.
[4] 肖承鸿,周涛,江维克,等.栽培太子参的遗传多样性与质量分析[J].中草药,2014,45(9):1319.
[5] 肖承鸿,周涛,江维克,等.贵州栽培太子参主要农艺性状比较及相互关系研究[J].中国中药杂志,2013,38(6):812.
[6] 杨昌贵,江维克,周涛,等.不同种源太子参中多糖和氨基酸含量的比较研究[J].中国现代中药,2014,16(1):32.
[7] 杨昌贵,周涛,肖承鸿,等.不同种源太子参生物量与太子参环肽B含量的分析[J].贵阳中医学院学报,2014,36(1):14.
[8] 康传志,周涛,郭兰萍,等.全国栽培太子參生态适宜性区划分析[J].生态学报,2016,36(10):2934.
[9] 康传志,周涛,江维克,等.土壤基本养分及无机元素对栽培太子参药材质量的影响[J].中药材, 2015,38(4):674.
[10] 中国药典.四部[S].2015:202.
[11] 康传志,周涛,郭兰萍,等.太子参商品规格等级标准研究[J].中国中药杂志,2014,39(15):2873.
[12] 肖承鸿,周涛,江维克,等.贵州太子参生物量与次生代谢物积累的动态变化分析[J].中国药学杂志,2013,48(16):1346.
[13] 郭丽芬,徐宁生,张跃,等.云南红花种质资源主要农艺性状的遗传多样性分析[J].植物遗传资源学报,2012,13(2):219.
[14] 马阳,侯娅,邹立思,等.不同种质和地域太子参氨基酸柱前衍生-HPLC测定及多元统计分析[J].天然产物研究与开发,2016(28):1192.
[15] 刘三才,郑殿升,曹永生,等.中国小麦选育品种与地方品种的遗传多样性[J].中国农业科学,2000,33(4):20.
[责任编辑 吕冬梅]

