2016年《美国内分泌医师协会与美国内分泌协会绝经后骨质疏松症诊疗指南》解读
李 静,陈德才,王 覃
·论著·
·专题研究·
2016年《美国内分泌医师协会与美国内分泌协会绝经后骨质疏松症诊疗指南》解读
李 静,陈德才,王 覃*
随着人口老龄化,骨质疏松症的患病率明显升高。骨质疏松症可导致患者身体功能受损、生活质量下降,其导致的骨折可显著增加患者的致残率和病死率,并带来极大的家庭和社会经济负担。有效的抗骨质疏松症治疗可显著降低骨质疏松性骨折的发生,对已发生骨折的患者也可有效避免再次发生骨折。2016年,美国内分泌医师协会(AACE)和美国内分泌协会(ACE)联合发布了更新的绝经后骨质疏松症诊疗指南。本文从骨折风险评估与骨质疏松症诊断、基础干预措施、药物干预方面对该指南进行解读,展现骨质疏松症诊治的新进展,提高临床实践水平。
骨质疏松,绝经后;指南;骨折;治疗
李静,陈德才,王覃.2016年《美国内分泌医师协会与美国内分泌协会绝经后骨质疏松症诊疗指南》解读[J].中国全科医学,2017,20(8):891-895[www.chinagp.net]
LI J,CHEN D C,WANG Q.Interpretation of American Association of Clinical Endocrinologists and American College of Endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis-2016[J].Chinese General Practice,2017,20(8):891-895.
骨质疏松症是由骨量下降、骨微结构破坏导致的骨强度下降、骨折风险升高的全身性骨病[1]。随着人口老龄化,骨质疏松症的发病率和疾病负担逐渐增加。美国国立骨质疏松症基金会(NOF)估计,美国有1 020万骨质疏松症患者,每年发生超过200万例骨质疏松症相关性骨折,其中女性占70%[2]。骨折是骨质疏松症的严重后果,可显著增加患者的致残率和病死率,并带来极大的家庭和社会经济负担。有效的抗骨质疏松症治疗可显著降低骨折的发生,对于已发生骨折的患者也可有效避免再次发生骨折。所以,识别并积极治疗骨质疏松症具有非常重要的临床和社会意义。
2016年,美国内分泌医师协会(AACE)和美国内分泌协会(ACE)联合发布了更新的绝经后骨质疏松症诊疗指南(以下简称AACE/ACE指南)[3]。AACE/ACE指南是在2010年版指南的基础上根据最新的临床证据修订而成,采用“问”与“答”的形式,结合最佳的证据与疾病成本效益分析,以提供绝经后骨质疏松症诊断、评估和治疗的循证医学证据。AACE/ACE指南采用循证分级和推荐分级结合的形式,循证分级根据证据来源的质量分为最佳证据等级(BEL)1~4级,分别代表强、中等、弱和无证据,推荐分级在循证分级的基础上结合了风险效益比、专家共识、资源可及性和文化等主、客观因素,分为A~D级,代表从最高到最低的推荐级别。本文就AACE/ACE指南进行解读,并与2014年NOF骨质疏松症防治指南[4]进行比较,旨在提高临床医师对骨质疏松症诊治的认识。
1 骨折风险评估与骨质疏松症诊断
AACE/ACE指南推荐所有≥50岁的绝经后女性均应进行骨质疏松症的风险评估(B级;BEL 1),这既包括骨质疏松症也包括骨折危险因素的评估。初次评估时,需进行详细的病史采集和体格检查,并采用世界卫生组织(WHO)骨折风险评估工具(FRAX)评估骨折发生的风险(B级;BEL 2)。然而,FRAX纳入的危险因素有限,如未纳入椎体骨密度、跌倒等重要指标,而这些骨折危险因素需在病史采集中详细了解。除此之外,由于我国流行病学数据需要更新,FRAX得出的骨折风险缺乏准确性,使其应用受到限制。与2014年NOF骨质疏松症防治指南比较,AACE/ACE指南对骨密度(bone mineral density,BMD)的筛查指征给出更加详细的建议,提出应根据临床骨折发生风险的大小进行考虑(B级;BEL 2),如≥65岁的女性,发生过脆性骨折,影像学提示骨量低下或全身性应用糖皮质激素≥3个月的绝经后女性。美国预防服务工作组(USPSTF)也推荐≥65岁的女性应筛查BMD,同时对年龄<65岁的女性,若骨折风险不低于无其他危险因素的65岁女性(10年重要的脆性骨折发生风险约9.3%),也需筛查BMD[5]。检测时,应使用双能X线吸收测定法(dual-energy X-ray absorptiometry,DXA)测量腰椎和髋部BMD(B级;BEL 2)。
既往公认的骨质疏松症的诊断标准主要依据髋部和腰椎BMD及骨折事件[6]。但该标准有一定的缺陷,如BMD对骨质疏松症的诊断特异度高,但灵敏度低,已有证据显示多种独立于BMD的危险因素可增加骨折的发生风险,而用已经发生骨折来诊断骨质疏松症可能延误最佳的诊疗时机[7]。而WHO标准会漏诊部分骨折高风险但BMD相对正常的个体,并且并不是所有患者均有机会进行BMD检测[8]。因此,AACE/ACE指南在诊断方面最大的改变是,推荐除BMD与脆性骨折外,增加了骨量低下(T值为-2.5~-1.0)但相应国家FRAX阈值提示骨折风险升高作为骨质疏松症的新诊断标准(B级;BEL 2),明显扩宽了骨质疏松症的诊断范围。这一标准最初由美国骨健康联盟提出[8],并被AACE/ACE指南采纳。骨折是骨质疏松症的严重后果,骨质疏松症诊断的目的是筛选出骨折高风险的患者进行有效治疗,避免低骨折风险的患者接受治疗。这一新标准的提出有助于筛选出骨折风险较高,但BMD的T值>-2.5的人群。尤其对因设备限制或身体衰弱、行动不便无法进行BMD检测的地区和人群,骨折风险可通过病史采集和体格检查的结果计算得到,在应用上更有价值。但骨质疏松症诊断范围的扩展也存在很多争议,最主要原因是缺乏相应临床试验的证据。既往抗骨质疏松症药物的临床试验纳入的骨质疏松症患者主要以BMD为诊断标准,小部分试验以骨折为诊断标准,目前尚无以骨折风险为骨质疏松症诊断和治疗标准的头对头临床试验。值得期待的是,首个以髋部骨折风险为治疗标准的头对头大型临床试验即将完成。初步结果已在2016年美国骨矿盐研究学会年会上报道,显示以髋部骨折风险为筛查和治疗标准会显著降低髋部骨折(27%,P=0.003)与重要的骨质疏松性骨折的发生风险(12%,P=0.018)[9]。
除此以外,AACE/ACE指南也提出,在排除其他代谢性骨病的前提下,无脆性骨折史但腰椎、股骨颈、全髋,或桡骨远端1/3处BMD的T值≤-2.5时可诊断为骨质疏松症(B级;BEL 2),其中桡骨远端1/3处是被AACE/ACE指南增加为新的诊断部位(尤其是在其他部位BMD不能获得时)。与NOF骨质疏松症防治指南一致,只要发生过椎体或髋部脆性骨折者,无论BMD水平如何,均应诊断为骨质疏松症;但AACE/ACE指南还增加了有肱骨近端、骨盆和部分前臂远端脆性骨折史同时存在骨量低下者,也应诊断为骨质疏松症,但需根据骨折时创伤的水平、年龄以及其他危险因素综合考虑。
BMD或骨折仅能反映骨骼的状态,不能反映引起骨密度的原因,因此根据BMD、骨折史和/或骨折风险诊断骨质疏松症后需筛查是否存在继发性骨质疏松(B级;BEL 2)。但大部分情况下骨质疏松症患者均不能明确合并疾病或药物的影响程度,所以区分骨质疏松症是继发性因素为主或原发性因素为主并不影响治疗原则,重点在于鉴别那些可导致骨量低下的非骨质疏松症的代谢性骨病,如骨软化、甲状旁腺功能亢进症等,避免误诊误治给患者带来重大的损害。因此,推荐检测骨转换标志物(bone turnover markers,BTMs),其不仅可用于辅助鉴别诊断,升高的BTMs也预示着骨丢失速率更快和骨折风险更高(B级;BEL 1)。
2 基础干预措施
明确诊断后,需评估与骨骼健康密切相关的基本因素。如应评估维生素D和钙的营养状态并进行合理的干预,既可维持长期的骨骼健康,也有助于抗骨质疏松症治疗时达到充分的疗效。AACE/ACE指南推荐对存在维生素D缺乏的高危因素,尤其是骨质疏松症患者应检测25羟维生素D〔25(OH)D〕水平(B级;BEL 2);骨质疏松症患者应维持25(OH)D≥30 μg/L的水平(推荐范围30~50 μg/L)(B级;BEL 3);必要时可进行维生素D替代,通常需1 000~2 000 U/d的摄入量以维持维生素D在合理的水平(C级;BEL 4),具有肥胖、吸收不良、器官移植后、高龄等因素的个体可能需要更高的补充剂量(A级;BEL 1)。目前,关于维生素D的合理水平尚存在争议,AACE/ACE指南对其推荐证据级别也不高,但包括NOF在内的学术组织均建议血清维生素D水平应≥30 μg/L。钙是骨形成的原料,为保证骨骼健康需摄入足够的钙,AACE/ACE指南与NOF骨质疏松症防治指南均推荐≥50岁女性钙的摄入需≥1 200 mg/d,如饮食中钙摄入不足需使用钙剂替代(B级;BEL 2),而我国2011年原发性骨质疏松症诊治指南则推荐绝经后妇女钙摄入量为1 000 mg/d[1]。充足的钙和维生素D是保证抗骨质疏松症药物充分发挥疗效的前提。
AACE/ACE指南对生活方式的评估和干预与既往无较大改变,如避免吸烟(B级;BEL 2)和过量饮酒(B级;BEL 2),推荐负重运动、平衡和抗阻训练(B级;BEL 2),提供预防跌倒的设施(A级;BEL 1),对于高跌倒风险者推荐使用髋部保护器(B级;BEL 1),物理治疗可能减少不适感、预防跌倒和提高生活质量(A级;BEL 1)。
3 抗骨质疏松症药物干预
3.1 抗骨质疏松症药物干预适应证 与建议增加桡骨远端1/3处作为诊断部位一致,AACE/ACE指南在抗骨质疏松症药物的适应证上较NOF骨质疏松症防治指南也做出相应扩展,提出增加桡骨远端1/3处BMD作为抗骨质疏松症治疗适应证之一。具体如下:骨量低下且合并髋部或椎体骨折(A级;BEL 1);腰椎、股骨颈、全髋和/或桡骨远端1/3处BMD的T值≤-2.5(A级;BEL 1);腰椎、股骨颈、全髋和/或桡骨远端1/3处BMD的T值在-2.5~-1.0,但FRAX计算出的10年任何重要的骨质疏松症相关性骨折风险≥20%,或髋部骨折风险≥3%(B级;BEL 2)。上述FRAX治疗阈值是根据美国数据制定的,AACE/ACE指南同时指出不同的国家需根据自己的标准划定治疗阈值,然而,我国暂无相关的研究数据。AACE/ACE指南首次将诊断标准和治疗指征进行统一,方便了临床实践。需指出的是,临床指南根据研究的现状做出关于药物治疗适应证的建议,而临床实践需考虑如患者的选择、FRAX未包括的危险因素、治疗的风险与获益等个体化因素,所以有效的方式是整合临床医师的临床经验与指南推荐,个体化地进行临床决策。
3.2 抗骨质疏松症药物的选择 与NOF骨质疏松症防治指南和其他广泛使用的骨质疏松症诊治指南对药物进行多线分级不同,在抗骨质疏松症药物选择方面,AACE/ACE指南提出依据骨质疏松症的严重程度,即骨折风险的高低进行药物的选择(见图1)。
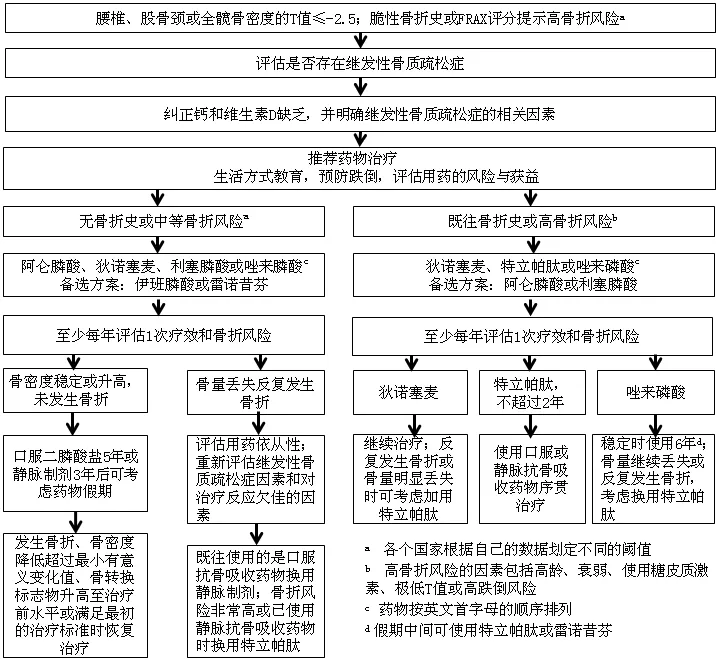
图1 美国内分泌医师协会与美国内分泌协会推荐绝经后骨质疏松症治疗流程
对于既往无脆性骨折史或中等骨折风险的患者,推荐使用阿仑膦酸、狄诺塞麦、利塞膦酸或唑来膦酸等具有降低多个部位骨质疏松性骨折风险的药物,如椎体、髋部和非椎体骨折,依班膦酸和雷洛昔芬作为次选药物,仅用于存在椎体骨折高风险,但无髋部或非椎体骨折风险的患者。而对于既往发生过脆性骨折或骨折高风险的患者,更推荐使用狄诺塞麦、特立帕肽或唑来膦酸,阿仑膦酸和利塞膦酸仅作为次选药物,不推荐依班膦酸和雷洛昔芬。该指南弱化了口服抗骨质疏松症药物在严重骨质疏松症患者中的使用,虽无头对头的研究直接比较口服和静脉滴注二膦酸盐在降低骨折发生风险的差异,但静脉滴注二膦酸盐的效果优于口服制剂符合临床的观察。对存在胃肠道疾病不能耐受或吸收口服抗骨质疏松症药物或依从性较差的患者,即使非骨折高风险也应使用静脉制剂。降钙素、雷奈酸锶等既往广泛应用的药物,由于其降低骨折风险的作用较弱,未被列为主要的抗骨质疏松症药物。按照骨折发生风险的高低选择相应的抗骨质疏松症药物可操作性强,有助于临床医师进行决策。
序贯治疗方面,由于特立帕肽推荐疗程不超过2年,且停用后骨量丢失明显,所以停用特立帕肽后需序贯使用抗骨吸收的药物(A级;BEL 1)。虽然狄诺塞麦和特立帕肽联用可更显著提高BMD(B级;BEL 1),但目前并无研究表明联用两种或多种抗骨质疏松症药物可更有效降低骨折的发生,因此AACE/ACE指南并不推荐联用两种药物治疗绝经后女性的骨质疏松症(C级;BEL 4)。对部分使用雌激素治疗绝经后症状或使用雷诺昔芬降低乳腺癌风险的骨折高风险患者,可加用非同类的抗骨质疏松症药物(D级;BEL 4)。
3.3 疗效监测 AACE/ACE指南明确指出,成功的抗骨质疏松症治疗应定义为BMD稳定或升高,且无新发骨折(A级;BEL 1);使用抗骨吸收药物的患者,BTMs应不高于绝经前女性的平均水平(A级;BEL 1),NOF骨质疏松症防治指南并无相关内容。骨质疏松症的核心表现是骨折风险升高,而非单纯是BMD或BTMs的异常,所以反映治疗成功的最佳指标应为骨折风险是否降至可接受的范围,但目前通过FRAX计算的骨折风险变化对治疗效果的反映不够敏感,也缺乏相应研究,尚无法在临床中应用。临床认为,对有相关临床症状的骨质疏松症患者,其症状的改善也是治疗有效的重要指标,但AACE/ACE指南和NOF骨质疏松症防治指南对骨质疏松症相关临床症状的关注较少,也并未将其纳入疗效监测的指标。治疗期间发生单个骨折不一定代表治疗失败,但至少表明该患者存在骨折高风险。明确何为成功的抗骨质疏松症治疗将有助于临床医师明确治疗靶目标,并且更好地进行疗效评估。治疗期间再发骨折或明显骨量丢失的患者应重新评估是否有继发性骨质疏松症的因素或考虑换用其他药物(A级;BEL 1)。
疗效监测的目的是评估抗骨质疏松症治疗是否成功,需在治疗期间检查是否有新骨折,并监测BMD和BTMs。AACE/ACE指南推荐,应获取腰椎和髋部基线BMD,开始阶段BMD的监测间隔可为1~2年,直到达到相对稳定的水平,之后的监测频率应依据临床实际情况个体化制定(B级;BEL 2),可长于2年,也可低于1年;最好采用同一仪器进行随访(B级;BEL 4),使不同时期的BMD检查结果具有可比性。也可监测BTMs以评估患者抗骨质疏松症治疗的依从性和疗效(B级;BEL 1)。由于多数椎体脆性骨折发生较隐匿,胸腰椎X线或DXA骨密度仪检测椎体可用于判断是否存在无症状性椎体骨折。
3.4 抗骨质疏松症治疗的疗程 骨质疏松症作为不可逆的骨骼衰老表现,需要终身管理,甚至终身治疗。关于抗骨质疏松症的治疗疗程,一直是临床备受关注的问题,长期治疗的安全性(如下颌骨坏死和不典型骨折)和相应临床研究的缺乏是长期应用抗骨质疏松症药物的瓶颈。对此,我国2011年原发性骨质疏松症诊治指南未给出相关建议,NOF骨质疏松症防治指南提出,中等骨折风险患者使用二膦酸盐3~5年后可停药,高骨折风险患者应继续使用或换用其他药物进行治疗,但可继续使用时长仍不清楚。随着大型临床试验延长试验的完成,二膦酸盐的使用疗程有了新的证据,AACE/ACE指南也据此有相应推荐。中等骨折风险患者,使用口服二膦酸盐5年(B级;BEL 1)或静脉用唑来膦酸3年(B级;BEL 1)后可给予药物假期;高骨折风险患者,使用口服二膦酸盐6~10年(B级;BEL 1)或静脉用唑来膦酸6年(B级;BEL 1)后可考虑药物假期,药物假期期间可使用特立帕肽或更弱的抗骨吸收药物,如雷诺昔芬(D级;BEL 4),但不推荐使用狄诺塞麦(A级;BEL 1)。二膦酸盐之所以存在药物假期,是因为其在骨骼中t1/2长,停药后有一定的后遗效应。随着停药时间延长,二膦酸盐对破骨细胞的抑制作用减弱,骨量会继续丢失,骨折风险继续升高,所以停药一定时间后常需要继续用药。二膦酸盐药物假期何时结束并无定论,AACE/ACE指南仅建议应个体化决策,如依据骨折风险大小、BMD或BTMs变化(B级;BEL 4)。药物假期结束后是继续用二膦酸盐,或换用其他药物,目前也没有相应证据。
狄诺塞麦在骨骼中t1/2短,停药后骨量丢失明显,AACE/ACE指南建议狄诺塞麦可长期应用。但目前尚无狄诺塞麦长期应用疗效和安全性的证据。特立帕肽使用时间不应超过2年(A级;BEL 1);如临床需要,其他类型的抗骨质疏松症药物可一直使用(D级;BEL 4),但该建议并无相关临床试验证据,推荐级别较低。
AACE/ACE指南依据最新的证据给出的疗程建议对临床实践有较大的指导意义,也提出了必要时抗骨质疏松症治疗可终身进行这一重要理念,符合骨质疏松症的病理生理改变。同时,也应注意到,某些重要问题亟待更多的研究提供证据。
4 总结
与NOF骨质疏松症防治指南相比,AACE/ACE指南依据最新的证据在绝经后骨质疏松症的诊断、抗骨质疏松症药物的选择和治疗疗程方面均有较大的改变,使更多骨骼强度降低、骨折风险升高的患者可诊断为骨质疏松症,从而有机会得到有效的治疗和管理,减少骨折的发生,同时,也有助于临床医师明确药物的使用和疗程,提高临床实践水平。
作者贡献:李静、陈德才、王覃进行文章的构思与设计、撰写论文;李静、王覃进行文献、资料收集和整理;陈德才、王覃进行论文的修订,负责文章的质量控制及审校;王覃对文章整体负责,监督管理。
本文无利益冲突。
[1]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2-17.DOI:10.3969/j.issn.1674-2591.2011.01.002. Branch of Osteoporosis and Bone Mineral Disease,Chinese Medical Association.Guidelines for diagnosis and treatment of primary osteoporosis(2011)[J].Chinese Journal of Osteoporosis and Bone Mineral Research,2011,4(1):2-17.DOI:10.3969/j.issn.1674-2591.2011.01.002.
[2]WRIGHT N C,LOOKER A C,SAAG K G,et al.The recent prevalence of osteoporosis and low bone mass in the united states based on bone mineral density at the femoral neck or lumbar spine[J].J Bone Miner Res,2014,29(11):2520-2526.DOI:10.1002/jbmr.2269.
[3]CAMACHO P M,PETAK S M,BINKLEY N,et al.American Association of Clinical Endocrinologists and American College of Endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis-2016[J].Endocr Pract,2016,22(Suppl 4):1-42.DOI:10.4158/EP161435.GL.
[4]COSMAN F,DE BEUR S J,LEBOFF M S,et al.Clinician′s guide to prevention and treatment of osteoporosis[J].Osteoporos Int,2014,25(10):2359-2381.DOI:10.1007/s00198-014-2794-2.
[5]NAYAK S,ROBERTS M S,CHANG C C,et al.Health beliefs about osteoporosis and osteoporosis screening in older women and men[J].Health Educ J,2010,69(3):267-276.DOI:10.1177/0017896910364570.
[6]KANIS J A.Diagnosis of osteoporosis[J].Osteoporos Int,1997,7(Suppl 3):S108-116.DOI:10.1007/BF03194355.
[7]KANIS J A,JOHNELL O,ODEN A,et al.FRAX and the assessment of fracture probability in men and women from the UK[J].Osteoporos Int,2008,19(4):385-397.DOI:10.1007/s00198-007-0543-5.
[8]SIRIS E S,ADLER R,BILEZIKIAN J,et al.The clinical diagnosis of osteoporosis:a position statement from the National Bone Health Alliance Working Group[J].Osteoporos Int,2014,25(5):1439-1443.DOI:10.1007/s00198-014-2655-z.
[9]MCCLOSKEY E V,LENAGHAN E,CLARKE S,et al.Screening based on FRAX fracture risk assessment reduces the incidence of hip fractures in older community-dwelling women-results from the SCOOP study in the UK[J].J Bone Miner Res,2016,26:S40.
(本文编辑:吴立波)
Interpretation of American Association of Clinical Endocrinologists and American College of Endocrinology Clinical Practice Guidelines for the Diagnosis and Treatment of Postmenopausal Osteoporosis-2016
LIJing,CHENDe-cai,WANGQin*
DepartmentofEndocrineandMetabolism,OsteoporosisMedicalEducationCenter,WestChinaHospital,SichuanUniversity,Chengdu610041,China
*Correspondingauthor:WANGQin,Associateprofessor;E-mail:wq3166@163.com
The prevalence of osteoporosis is growing rapidly with the aging of the population.Osteoporosis leads to decrease of physical function and quality of life.Moreover,fracture due to osteoporosis can bring about increased disability rate and mortality,and a great burden on family and society.Thankfully,anti-osteoporotic treatment is able to decrease fractures,and subsequent fractures effectively among those who already suffer from fractures.From the aspects of fracture risk assessment and osteoporosis diagnosis,basic intervention and pharmacological intervention,this article briefly interpreted the updated Clinical Practice Guidelines for the Diagnosis and Treatment of Postmenopausal Osteoporosis jointly issued by American Association of Clinical Endocrinologists (AACE) and American College of Endocrinology(ACE)in 2016,aiming to keep clinicians informed of the recent developments in osteoporosis diagnosis and treatment by which their clinical practice can be improved.
Osteoporosis,postmenopausal;Guidelines;Fractures,bone;Therapy
四川省科技计划资助项目(2015JY0180)

本期专题主持人简介
科研成果:作为课题负责人承担国际合作课题、科技部“十一五”科技支撑计划项目分课题、国家863计划项目子项目、中华医学会骨质疏松症专项基金、四川省科学技术委员会、中国循证医学中心课题各一项,负责国家药监局临床药物研究课题7项。完成国家、省级科研课题8项,获四川省科技进步三等奖1项,获得我国国家发明专利1项及欧洲共同体发明专利1项。
R 681
A
10.3969/j.issn.1007-9572.2017.08.001
2016-10-15;
2017-01-19)
610041四川省成都市,四川大学华西医院内分泌与代谢科,骨质疏松医疗教育中心
*通信作者:王覃,副教授;E-mail:wq3166@163.com
【编者按】 中老年人是骨质疏松症的高危人群,尤其在绝经后女性中有较高的患病率。骨质疏松症的预防、筛查、诊断、治疗和康复一直是临床关注的热点问题。本刊2016年第14期“专题研究”就骨质疏松性骨折风险预测简易工具、骨代谢标志物、超声骨密度检查在筛查骨质疏松症及预测骨折风险中的价值进行了探讨,获得了广大读者热烈反响。本期“专题研究”再次组织相关专家,进一步就骨质疏松症发生的危险因素、治疗及效果评价标准做深入探讨,以期为临床高危人群的干预提供借鉴。
陈德才 博士,主任医师、教授、硕士生导师,四川大学华西医院/华西临床医学院内分泌代谢科副主任
学术任职:四川大学华西医院骨质疏松医疗教育中心副主任,科技部国家科技奖励工作办公室评审专家,中华医学会骨质疏松和骨矿盐疾病分会常务委员,四川省人民政府学科评议(审)专家,四川省卫生和计划生育委员会学术技术带头人,四川省医师协会内分泌代谢专科医师分会副会长、候任会长,四川省医学会骨质疏松专委会主任委员,成都医学会骨质疏松专委会主任委员,四川省医学会内分泌暨糖尿病专委会常务委员,四川省医学会、成都市医学会医疗事故鉴定专家,成都医学会理事。《中华骨质疏松和骨矿盐疾病杂志》编委,《中华内分泌外科杂志》编委,JournalofBoneandMineralResearch中文版编委,美国Metabolism杂志审稿人。
在国内外核心学术期刊以第一或通信作者发表科研论著60余篇,副主编专著《骨质疏松性骨折的临床诊断与治疗》,副主译《骨质疏松营养学》,参编专著15部。

