平陆百合愈伤组织诱导的正交试验研究
任建宏,王鹏丽,殷丽娜,赵娟
(山西农业大学 农学院,山西 太谷 030801)
平陆百合愈伤组织诱导的正交试验研究
任建宏,王鹏丽,殷丽娜,赵娟*
(山西农业大学 农学院,山西 太谷 030801)
[目的]筛选平陆百合愈伤组织诱导的最佳培养基配方。[方法]以平陆百合的鳞片作为外植体,分别在光照和黑暗培养条件下,利用正交试验设计法研究了不同浓度2,4-D、NAA、KT组合对平陆百合愈伤组织诱导效果的影响。[结果]光照培养条件下,百合愈伤组织的适宜诱导培养基配方为MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1,诱导率为57.143%,各因子影响程度依次为NAA>KT>2,4-D;黑暗培养条件下,百合愈伤组织的适宜诱导培养基配方为MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1,诱导率为50%,各因子影响程度依次为KT>NAA>2,4-D。[结论]平陆百合愈伤组织诱导的最佳培养基配方为:MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1,培养条件为光照。
平陆百合; 愈伤组织; 正交设计
平陆百合(Liliumbrownievar.viridulum)属百合科百合属多年生草本植物,为可食用百合,生长于山西省中条山下的平陆县,个头大、鳞片肉厚无柴,质量好、营养价值高,有“中条参”的美称;含有大量蛋白质、脂肪、淀粉、维生素,并含有少量钙、磷、铁等,药用价值高,具有补中益气,温肺止咳,安神、清心等功效[1,2]。
愈伤组织培养作为植物离体培养最主要的培养形式[3,4],既可用于植物生长发育、分化机制、遗传变异规律及遗传育种等相关研究[5,6],又可用于规模化、工厂化生产有用化合物,是一种适于植物快繁的新手段[7~9]。虽然近年来已开展一些对食用百合愈伤组织诱导的相关研究,但在采用正交设计法诱导百合愈伤组织方面还未见系统的研究报道。本试验以平陆百合脱毒苗鳞片为外植体,采用L25(56)均匀正交设计分析比较2,4-D、NAA、KT三种激素不同浓度组合在光照与黑暗条件下对百合愈伤组织诱导的影响,旨在为平陆百合脱毒苗快速繁殖提供新途径,同时建立和优化愈伤组织体系,为开展遗传转化相关研究提供理论依据。
1 材料与方法
1.1 试验材料
平陆百合(Liliumbrowniivar.viridulum)脱毒试管苗由山西农业大学农学院植物组织培养实验室提供。
1.2 试验方法
平陆百合愈伤组织诱导采用L25(56)正交表设计正交试验,根据设计安排25个处理组合。试验因素水平见表1,所用培养基均按照正交法设计(表2)。外植体均选用百合鳞片,每组处理接种42块鳞片,重复3次。每天观察愈伤组织诱导情况,接种20 d后统计愈伤组织诱导率。
表1 L25(56)愈伤组织诱导正交试验设计
Table 1 Design of orthogonal test L25(56) for callus induction

因素Factors水平/mg·L-1Levels2,4-D12345NAA0.10.20.30.40.5KT0.10.20.30.40.5
试验所用培养基均以MS作为基本培养基,附加蔗糖3%、琼脂0.6%,pH为5.6~5.8。光照条件温度(25±2) ℃,光照16 h·d-1,光照强度1 600~2 100 lx;黑暗条件温度(16±2) ℃,关掉接种材料上下的灯管,不需遮光。
1.3 数据统计及分析方法
愈伤组织诱导率=产生愈伤组织的外植体数/接种外植体总数×100%;
试验所采集数据由Spss17.0和Microsoft Excel进行分析。
2 结果与分析
2.1 愈伤组织诱导的正交试验结果
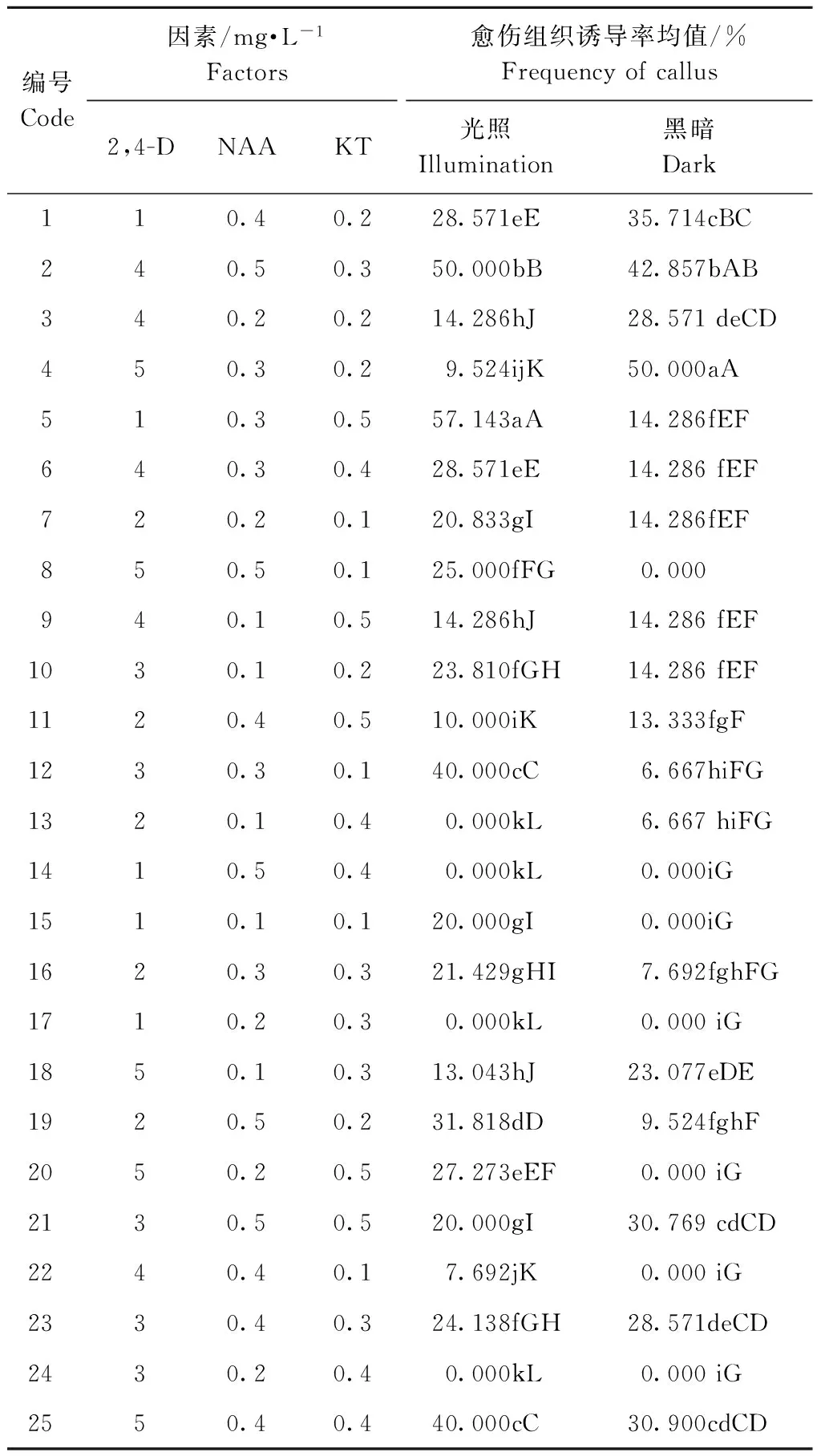
3种外源激素及5个浓度梯度,根据正交表设计得25组试验处理,分别置于光照、黑暗条件下,其愈伤组织诱导率均值见表2。多重比较分析可知,2种条件下25组愈伤组织诱导率均值差异显著。光下5号培养基愈伤组织诱导率均值显著高于其他24组,即MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1适宜平陆百合形成愈伤组织。黑暗下4号激素配方的愈伤诱导率均值显著高于其他24组,说明黑暗条件适宜愈伤形成的配方为MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1。
表2 平陆百合愈伤诱导率的L25(56)正交试验方案及结果
Table 2 Plan and result of L25(56)orthogonal design test for callus induction of Lilium
编号Code因素/mg·L-1Factors愈伤组织诱导率均值/%Frequencyofcallus2,4-DNAAKT光照Illumination黑暗Dark110.40.228.571eE35.714cBC240.50.350.000bB42.857bAB340.20.214.286hJ28.571deCD450.30.29.524ijK50.000aA510.30.557.143aA14.286fEF640.30.428.571eE14.286fEF720.20.120.833gI14.286fEF850.50.125.000fFG0.000940.10.514.286hJ14.286fEF1030.10.223.810fGH14.286fEF1120.40.510.000iK13.333fgF1230.30.140.000cC6.667hiFG1320.10.40.000kL6.667hiFG1410.50.40.000kL0.000iG1510.10.120.000gI0.000iG1620.30.321.429gHI7.692fghFG1710.20.30.000kL0.000iG1850.10.313.043hJ23.077eDE1920.50.231.818dD9.524fghF2050.20.527.273eEF0.000iG2130.50.520.000gI30.769cdCD2240.40.17.692jK0.000iG2330.40.324.138fGH28.571deCD2430.20.40.000kL0.000iG2550.40.440.000cC30.900cdCD
注:同列不同小写字母表示差异显著(P<0.05)。
Note:Different lowercase letters show significant difference at the 0.05 level in the same column.
2.2 光照条件下平陆百合愈伤组织诱导
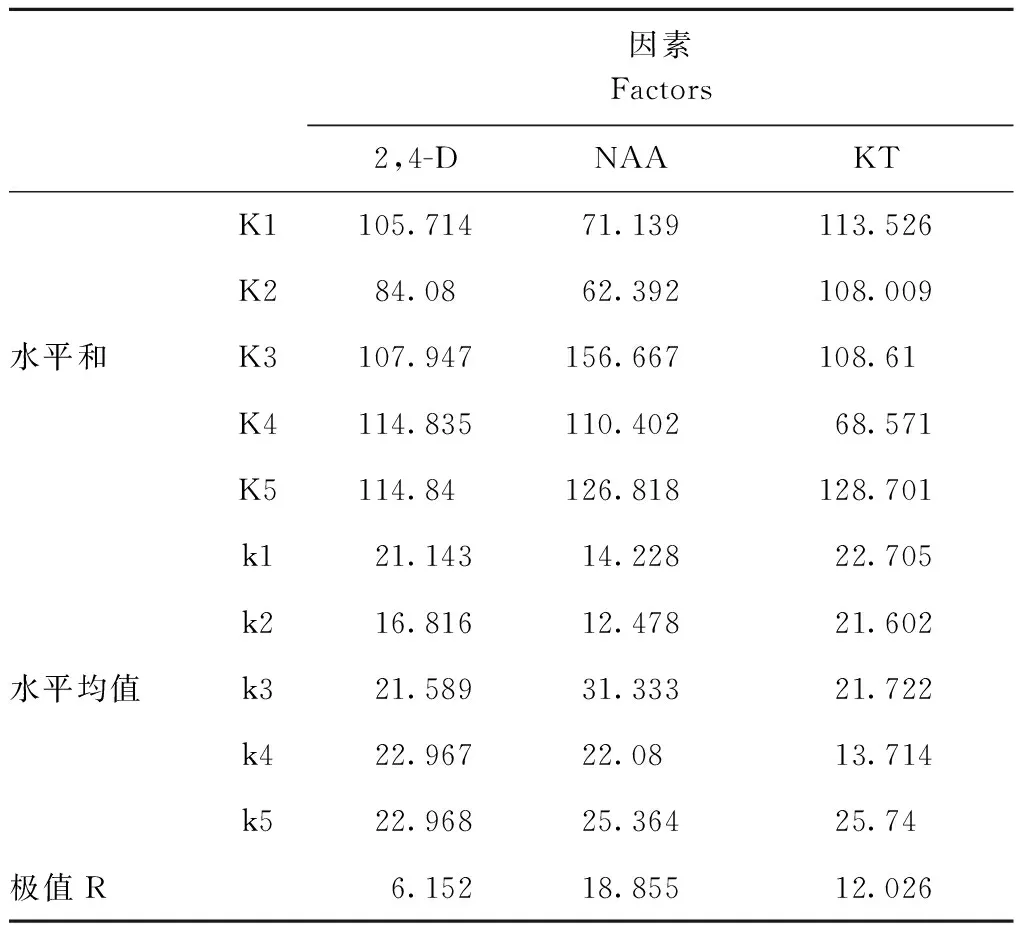
平陆百合鳞片接种后置于光下培养,10 d后开始萌动,肉眼可见切口处有白色点状物质,之后鳞片的切口边缘形成一层绿色紧密型愈伤组织(图1a);培养至40 d后一部分愈伤组织出现突起,一部分则褐化变黑(图1c)。由表2、表3可得其直观分析,2,4-D、NAA和KT的极差分别是6.152、18.855和12.026,说明2,4-D对平陆百合愈伤组织的诱导作用最小,NAA的诱导作用最大。由此可见,试验用3种激素对平陆食用百合的愈伤组织诱导作用的主次关系为NAA>KT>2,4-D。不同浓度NAA对平陆百合愈伤组织诱导率有极显著差异(P<0.01),而2,4-D与KT对愈伤组织的诱导作用差异不显著(表4)。综合可得,光照条件下平陆百合愈伤组织诱导的最佳组合为MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1。
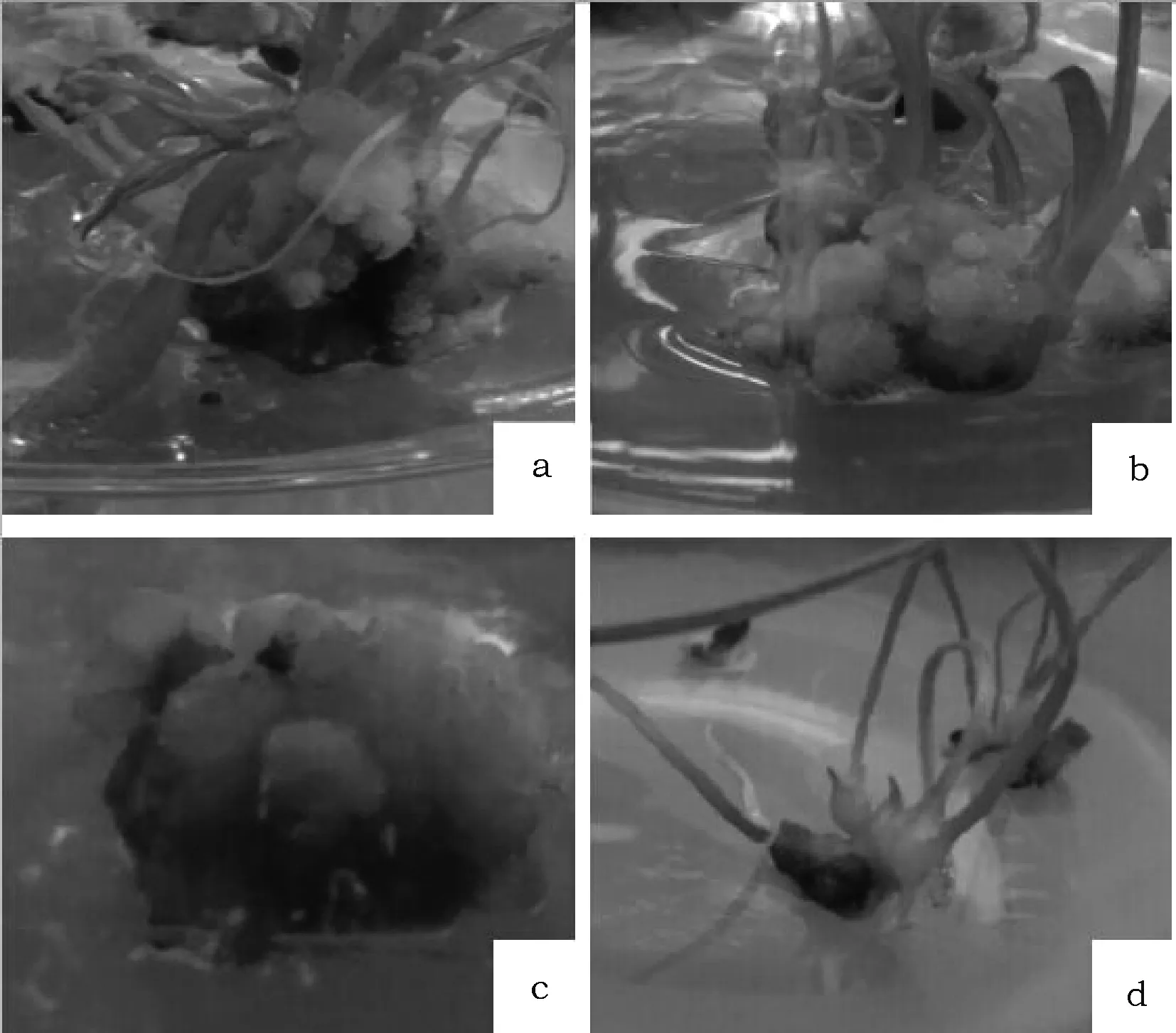
图1 平陆百合愈伤组织的诱导Fig.1 Callus induction of Lilium 注:a (培养基:MS+2,4-D 1 mg·L-1 +NAA 0.3 mg·L-1+KT 0.5 mg·L-1;培养条件:光照); b (培养基:MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1;培养条件:黑暗); c (光照培养条件下,愈伤组织逐渐褐化变黑); d (光照培养条件下,愈伤组织开始分化)Note: a(medium:MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1; culture conditions:light treatment ); b (medium:MS+2,4-D 5 mg·L-1+NAA 0.3 m g·L-1+KT 0.2 g·L-1;culture conditions:light treatment); c (in light,callus gradually go brown and black); d (in lignt, callus differentiation)
Table 3 Audio-visual analysis for callus induction rate of Lilium
因素Factors2,4-DNAAKTK1105.71471.139113.526K284.0862.392108.009水平和K3107.947156.667108.61K4114.835110.40268.571K5114.84126.818128.701k121.14314.22822.705k216.81612.47821.602水平均值k321.58931.33321.722k422.96722.0813.714k522.96825.36425.74极值R6.15218.85512.026
注:K为各因素在各个水平诱导率的总和,k为各因素在各个水平的平均值,R为极差。表5同。
Note: K the sum of the various factors in each level, k the average of the factors at each level, R Indicate range.The same as in table 5.
表4 平陆百合愈伤组织平均诱导率方差分析
Table 4 Variance analysis for average callus induction rate of Lilium

变异来源Sourceofvariation平方和Sumofsquare自由度df均方MeanofsquareF值FvalueSig2,4-D383.537495.8840.5220.720NAA3681.3214920.3305.008**0.001KT1189.4374297.3591.6180.181误差11394.19062183.777总计50028.72974
2.3 黑暗条件下平陆百合愈伤组织诱导
外植体接入培养基在黑暗条件下培养20 d后,鳞片边缘出现颗粒状愈伤组织,呈现黄白色;40 d后愈伤组织增多,有少量根出现(图1b)。由表5可知,2,4-D、NAA和KT的极差分别是10.495、13.133和20.571,说明2,4-D对平陆百合愈伤组织的诱导作用最小,KT的诱导作用最大;各因素对平陆百合的愈伤诱导率影响的主次关系为KT>NAA>2,4-D。
表5 黑暗条件下平陆百合愈伤诱导率的极差分析/%
Table 5 Audio-visual analysis for callus induction rate of Lilium in the dark condition

试验因素Factors2,4-D/mg·L-1NAA/mg·L-1KT/mg·L-1K173.07758.31535.238K251.50242.857138.095水平和K380.29392.93102.198K4100108.51951.852K5103.97783.1572.674k114.61511.6637.048k210.38.57127.619水平均值k316.05918.58620.44k42021.70410.37k520.79516.6314.535极值R10.49513.13320.571
由表6可见,不同浓度的KT对平陆百合愈伤组织诱导率极显著差异(P<0.01),2,4-D与NAA对愈伤诱导率差异显著(P<0.05)综合可得,黑暗条件下对平陆百合愈伤组织诱导的最佳组合为MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1。
表6 黑暗条件下平陆百合愈伤组织平均诱导率方差分析
Table 6 Variance analysis for callus induction rate of Lilium in the dark condition
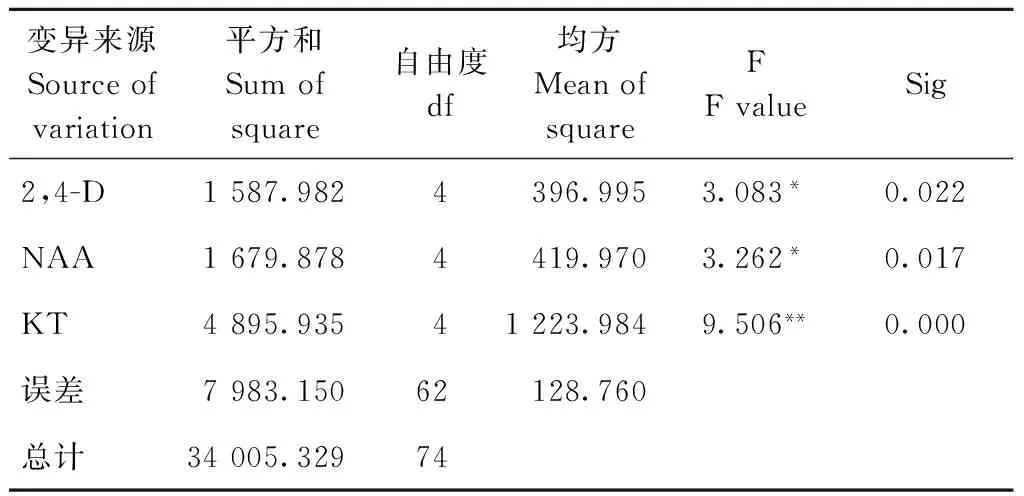
变异来源Sourceofvariation平方和Sumofsquare自由度df均方MeanofsquareFFvalueSig2,4-D1587.9824396.9953.083*0.022NAA1679.8784419.9703.262*0.017KT4895.93541223.9849.506**0.000误差7983.15062128.760总计34005.32974
3 讨论与结论
正交设计具有试验次数少,数据分析角度多且方法简单等优点,是优化植物愈伤组织诱导体系的有效工具[10]。通过对正交试验所得数据进行直观分析、方差分析以及多重比较,能够确定百合愈伤组织诱导率的主要影响因素,从而对试验结果做出准确评价[11,12]。
愈伤组织是具有分化能力的薄壁细胞,在快速繁殖、育种、转基因、脱毒苗生产等方面均有极大的应用价值,可用于百合愈伤组织诱导的外植体有鳞片、茎段、叶片、花瓣、花丝、子房、种子等,其中鳞片为最常用的外植体。Mori等[13]利用21个百合品种,选用种子、鳞片、叶片等作外植体研究其愈伤组织诱导情况,其中鳞片的愈伤组织诱导率可达100%。吕玉虎等[14]研究表明鳞片在培养基上的放置方式对其愈伤组织诱导有影响,其诱导能力从强到弱依次为:鳞片内侧向上平放>鳞片竖直插入>鳞片内侧向下平放。翟彦等[15]研究切花百合时以花丝为外植体,愈伤组织形成先发生在切口处。在本试验中,选用平陆百合鳞片作外植体,接种时水平放置内侧向上,观察其切口处愈伤组织的诱导情况,所得结果与上述结论相近,这说明鳞片作为诱导愈伤组织的外植体,效果较好,且与鳞片的放置方式有关。
光暗培养条件影响愈伤的诱导。一般而言,暗培养有利于愈伤组织的诱导,而光培养对愈伤组织的分化及器官形成有利。张艺萍等[16]研究表明东方百合在黑暗条件下更易形成愈伤组织。本试验中,光照条件较黑暗条件更适于平陆百合形成愈伤组织,推测这可能与百合品种有关。形成的愈伤组织一段时间后一部分褐化变黑(图1c),一部分出现芽点再生(图1d),在试验中愈伤组织褐化变黑,这可能是由于多酚类化合物在多酚氧化酶作用下氧化形成活性酸化物与环形多聚体氧化蛋白时形成深色化合物,这类物质很快又被氧化形成醌类化合物,导致愈伤组织褐化变黑,从而使其失去再生能力,而芽点再生则可能是因为光照促进了组织的分化及器官形成。
外源植物激素对愈伤组织的形成有重要的诱导作用,不同植物、不同外植体以及相同外植体不同部位对所用植物激素都不同[17]。2,4-D常被用来诱导愈伤组织,本研究在光照与黑暗2种条件下,均经极差分析得到两种生长素影响平陆百合愈伤组织形成的主次关系为NAA>2,4-D;陆美莲等[18]研究同样表明NAA对百合愈伤诱导的影响大于2,4-D;孙君社等[19]研究认为NAA的生物活性低于2,4-D,且相差3~5倍,这与本试验所得结论有差异,这可能是由于不同百合品种对不同生长素类的效应有所差异。 KT常被选用诱导百合胚性愈伤,本试验选用其作为一种外源激素,直观分析可看出在两种条件下,对诱导平陆百合愈伤组织影响因素KT>2,4-D,KT的主要作用还需进一步验证。当生长素与细胞分裂素的比例高时,有利于诱导愈伤组织形成;本试验在光照条件下最佳诱导愈伤组织形成的培养基配方为MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1,黑暗条件下最佳配方为MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1;与上述基本原理基本一致。
此外,愈伤组织还受基因型影响,Mori等[13]对33个不同基因型的百合进行愈伤组织诱导研究,结果30个基因型诱导形成愈伤组织。Loretta等[20]研究发现,麝香百合较东方百合和亚洲百合相比有较强的愈伤组织诱导能力。
综合考虑,平陆百合愈伤组织诱导的最佳培养基配方为:MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1,培养条件为光照。
[1]陈龙.百合(Lilium)鳞茎薄层胚性愈伤组织诱导及再生植株遗传稳定性鉴定[D].杨凌:西北农林科技大学,2013:1-3.
[2]张传海,葛自兵,白雪峰,等.食用百合卷丹离体培养再生体系的建立[J].皖西学院学报,2012,28(2):1-3.
[3]陈俊男,邓志英,田纪春.小麦成熟胚组织培养体系优化及其影响因素的研究[J].麦类作物学报,2012,32(2):197-202.
[4]丰先红,李健,罗孝贵.百合病毒脱除技术研究进展[J].农学学报,2015,5(9):91-95.
[5]韩婷婷,孙周平.矮丛蓝莓叶片的愈伤组织诱导及植株再生[J].西北植物学报2010,30(3):0615-0620.
[6]陈超.红掌愈伤组织和再生团块的发育及四倍体诱导[D].南京:南京农业大学,2011:7-9.
[7]马怡迪.野生百合高效再生体系建立及愈伤组织增殖调控研究[D].浙江:浙江大学,2015:10-13.
[8]袁雪,钟雄辉,李晓昕,等.铁炮百合的胚性愈伤组织诱导和植株再生[J].核农学报,2012,26(3):0454-0460.
[9]崔瑞峰,张丽霞,韩晓红.不同激素配比对百合鳞片愈伤组织诱导的影响[J].黑龙江农业科学,2014(9):8-9.
[10]王兴仁,张录达,王华方.正交试验设置重复的必要性和统计分析方法[J].土壤通报,2000,31(3):135-139.
[11]刘建军,龚一富,王世安,等.银杏愈伤组织诱导的多因子正交试验研究[J].广西植物,2014,34(1):116-119.
[12]方萍.实用农业试验设计与统计分析指南[M].北京:中国农业出版社,2000:193-231.
[13]Mori S, Adachi Y, Horimoto S, et al. Callus formation and plant regeneration in various Lilium species and cultivars[J]. In Vitro Cellular & Developmental Biology-Plant, 2005,41 (6):783-788.
[14]吕玉虎,李彬青,吴淑平,等.百合的离体组织培养和快速繁殖[J].信阳农业高等专科学校学报,2002,12(2):19-20.
[15]翟彦,张宗勤,贾敏,等.百合体细胞胚胎发生和植株再生[J].西北植物学报,2011,31(4):0834-0841.
[16]张艺萍,吴丽芳,吴学尉,等.东方百合胚性愈伤组织诱导和植株再生研究[J].江西农业学报,2008, 20(12):33-36.
[17]Wang D M,Huang X L,Huang SH, et al. The action mechanism of cytokinins in plant tissue culture[J]. Plant Physiology Communications,1996,32(5):373-377.
[18]陆美莲,徐新萍,周厚高,等.均匀正交设计在百合组织培养中的应用[J].西南农业大学学报(自然科学版),2004,26(12):699-702.
[19]孙君社,方晓华.植物激素对百合鳞片愈伤组织生长的影响[J].中国农业大学学报,2001,6(2):58-61.
[20]Loretta Bacchetta, Patrizio C Remotti, Claudia Bemardini, et al. Adventitious shoot regeneration from leaf explants and stem nodes of Lilium[J]. Plant Cell, Tissue and Organ Culture,2003,74(1):37-44.
(编辑:马荣博)
Callus induction ofLiliumbrowniivar.viridulumby orthogonal test
Ren Jianhong, Wang Pengli, Yin Li’na, Zhao Juan*
(CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective] Search the optimal medium of callus inducement ofLiliumbrowniivar.viridulum.[Methods]With the scales ofLiliumas explants, the effect of different hormone combines (2,4-D、NAA、KT )on the callus induction ofLiliumwere studied by design test in light and darkness respectively. [Results]In light, the effect of three hormones on callus induction was NAA>KT>2,4-D. The optimal medium for callus induction ofLiliumwas MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1,the callus induction frequency was 57.143%; In darkness, the effect of three hormones on callus induction was KT>NAA>2,4-D.The optimal medium for callus induction ofLiliumwas MS+2,4-D 5 mg·L-1+NAA 0.3 mg·L-1+KT 0.2 mg·L-1, the callus induction frequency was 50%.[Conclusion]The best medium for callus induction ofLiliumbrowniivar.viridulumwas MS+2,4-D 1 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1, inducing condition was light.
Liliumbrownievar.viridulum, Callus, Orthogonal design
2016-10-23
2016-12-28
任建宏 (1991-),男(汉),山西寿阳人,硕士研究生,研究方向:植物组织培养
*通信作者:赵娟,博士,副教授。Tel:13834836658;E-mail:sxndzhaojuan@163.com
山西省科技攻关项目(20130311014-1) ;山西农业大学引进人才科研启动项目(2012YJ13);山西省青年科技研究基金(201601D202054)
S644.1
A
1671-8151(2017)03-0189-05

