把握信息 关键突破 正确解答
任鑫

化学反应速率和化学平衡的图像类试题是一种特殊题型,在每年的高考考题中必有涉及。该类试题包含的信息量比较大,对能力要求较高,随着高考的不断改革以及对学科能力要求的不断提高,这种数形结合的试题将频频出现。
一、有效贮备化学反应速率及化学平衡知识
1.化学反应速率
(1)掌握1条规律:对于可逆反应mA(g)+nB(g)pC(g),
v(A)∶v(B)∶v(C)=Δn(A)∶Δn(B)∶Δn(C)=
Δc(A)∶Δc(B)∶Δc(C)=m∶n∶p。
(2)理解5个因素:增大反应物浓度、增大气体反应物压强、升高温度、使用催化剂、增大反应物表面积,化学反应速率均增大,反应时间将缩短,达到平衡的时间也缩短。反之,反应速率将减小,反应时间将变长,达到平衡的时间将延长。
(3)了解1个图象(图1)。其中:
E1—正反应活化能 E2—逆反应活化能
ΔH=E1-E2=E3-E4
2.化学平衡的移动图2图3
(1)掌握平衡特征。
①v(正)=v(逆)>0。
例如只有在t2時刻(图2)反应才达到平衡。
②反应体系中各物质的质量或浓度保持不变。
例如
只有在t3时刻(图3)反应才达到平衡状态。
③反应物的转化率不变。
(2)理解1个原理。
勒·夏特列原理(化学平衡移动原理):如果改变影响化学平衡的条件(浓度、压强、温度等)之一,平衡将向着能够减弱这种改变的方向移动。“减弱改变”是化学平衡移动原理的核心内涵。
二、解答信息类化学反应速率和化学平衡图像题的思路、步骤与技巧
1.解题思路
2.解题步骤
三、信息类图像题解法例析
角度一 速率-压强(或温度)图像
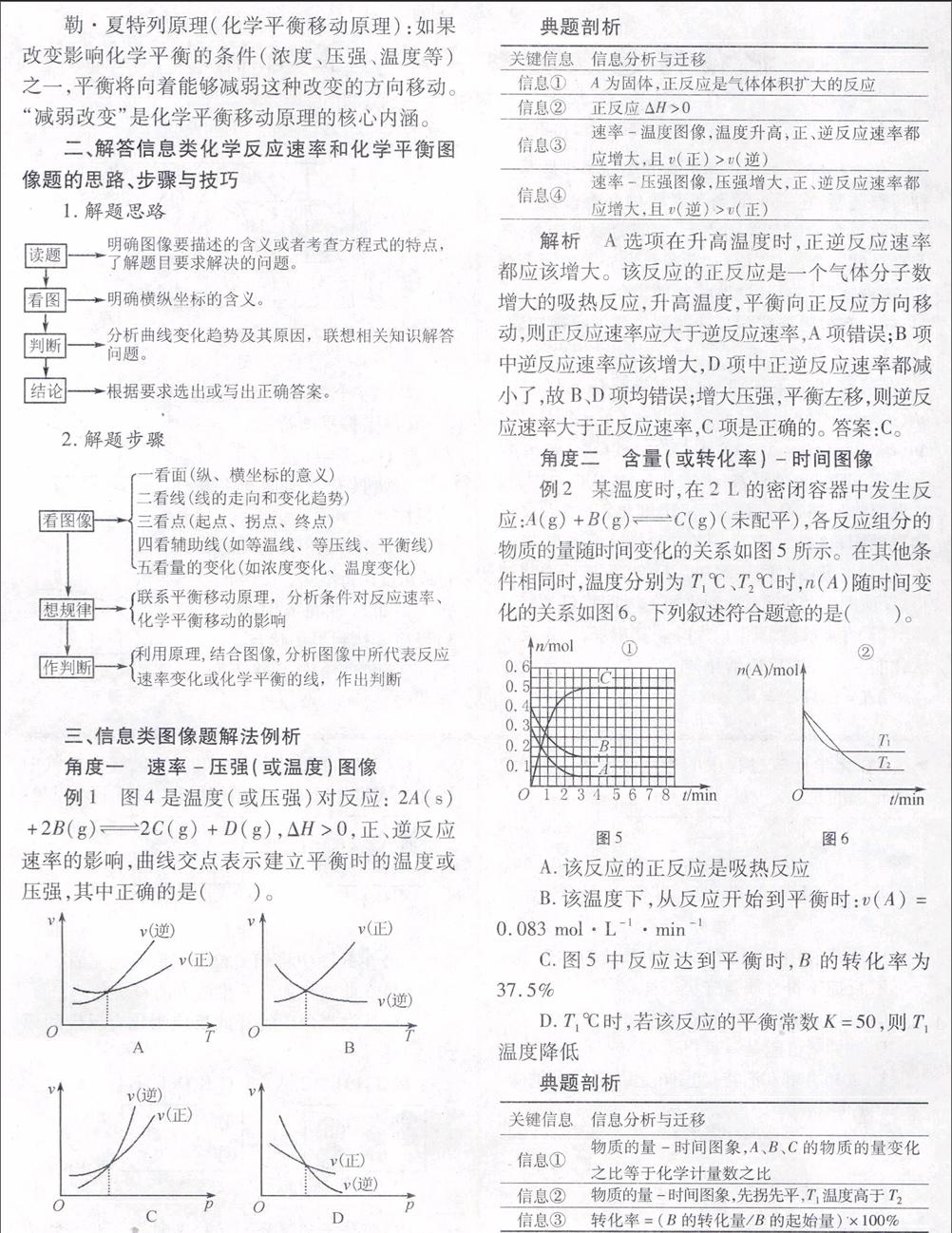
例1 图4是温度(或压强)对反应: 2A(s)+2B(g)
2C(g)+D(g),ΔH>0,正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是( )。
典题剖析
关键信息信息分析与迁移
信息①A为固体,正反应是气体体积扩大的反应
信息②
正反应ΔH>0
信息③
速率-温度图像,温度升高,正、逆反应速率都应增大,且v(正)>v(逆)
信息④
速率-压强图像,压强增大,正、逆反应速率都应增大,且v(逆)>v(正)
解析 A选项在升高温度时,正逆反应速率都应该增大。
该反应的正反应是一个气体分子数增大的吸热反应,升高温度,平衡向正反应方向移动,则正反应速率应大于逆反应速率,A项错误;
B项中逆反应速率应该增大,D项中正逆反应速率都减小了,故B、D项均错误;增大压强,平衡左移,则逆反应速率大于正反应速率,C项是正确的。
答案:C。
角度二 含量(或转化率)-时间图像
例2 某温度时,在2 L的密闭容器中发生反应:A(g)+B(g)C(g)(未配平),各反应组分的物质的量随时间变化的关系如图5所示。在其他条件相同时,温度分别为T1℃、T2℃时,n(A)随时间变化的关系如图6。下列叙述符合题意的是( )。
A.该反应的正反应是吸热反应
B.该温度下,从反应开始到平衡时:v(A)=0.083 mol·L-1·min-1
C.图5中反应达到平衡时,B的转化率为37.5%
D.T1℃时,若该反应的平衡常数K=50,则T1温度降低
典题剖析
关键信息信息分析与迁移
信息①物质的量-时间图象,A、B、C的物质的量变化之比等于化学计量数之比
信息②
物质的量-时间图象,先拐先平,T1温度高于T2
信息③
转化率=(B的转化量/B的起始量)×100%
解析 根据“先拐先平,数值大”的原则可推知,T1>T2,温度越高,A的物质的量越大,则平衡向左移动,正反应放热,A不正确;v(A)=(0.3 mol-0.05 mol)/(2 L×3 min)=
0.041 7 mol·L-1·min-1,B不正确;B的转化率为(0.4-0.15)÷0.4×100%=62.5%,C不正确;由图可知A、B、C物质的量变化之比为1∶1∶2,则K0为33.3<50,平衡常数越小,温度越高,D正确。
答案:D。
角度三 恒温线(或恒压线)图像
例3 在一定体积的①容器中通入均为0.1 mol·L-1的CH4与CO2两种气体,在一定条件下发生反应:CO2(g)+CH4(g)
2CO(g)+2H2(g)②,测得平衡时CH4的转化率与温度及压强的关系如图7所示,下列说法一定正确的是( )。
A.该化学反应的:ΔH③>0
B.在图示中压强关系为:p1>p2>p3>p4④
C.在1100℃时,该反应的化学平衡常数为64
D.图示中,压强为p4时,在Y点⑤:正反应速率小于逆反应速率
典题剖析
关键信息
信息分析与迁移
信息①
容器的体积不变,压强可能变化
信息②
正反应是气体体积扩大的反应
信息③
根据平衡转化率与温度的变化关系判断
信息④
根据某一温度下,转化率与压强的关系判断
信息⑤
壓强为p4时,Y点在图线以下,趋于平衡,反应应向正反应方向进行
解析 分析图象可知:升高温度,平衡正向移动,正反应为吸热反应,A正确;由反应方程式可知,增大压强时,平衡逆向移动,结合图象可知压强:p1
答案:A。
角度四 特殊图像
例4 在两个固定体积均为1L密闭容器中以不同的氢碳化比n(H2)n(CO2)充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图8所示。下列说法正确的是( )。图8
A.该反应在常温下不能自发进行
B.氢碳比X<2.0
C.若起始时,CO2、H2浓度分别为0.5 mol/L和1.0 mol/L,则可得P点对应温度的平衡常数的值512
D.向处于P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后
α(CO2)减小
典题剖析
关键信息信息分析与迁移
信息①
只考虑改变一个条件对化学平衡的影响
信息②
正反应是气体体积缩小的反应
信息③
CO2平衡体积分数随T变化的关系图象信息④温度越高,速率越大
解析 A.由图可知,随温度升高,CO2的平衡转化率减小,说明升高温度,平衡逆向移动,则正反应为放热反应,即ΔH<0,另外据反应可知ΔS>0,根据ΔG=ΔH-TΔS,则ΔG始终<0,因此常温下该反应能自发进行,故A错误;B、氢碳比越大,二氧化碳的转化率越大,故X>2.0,B项错误;C.由图可知,P点平衡时二氧化碳转化率为0.5,氢碳比为2,根据三段式可计算出此时的平衡常数为512,C项正确;向处于P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,此时平衡正向移动,再次平衡后,α(CO2)增大,D项错误。
答案:C。

