盐酸青藤碱对家兔脊柱压缩性骨折愈合的影响*
李 莉,胡熙耀,万 超,郭俐宏,吴胜英**
(1.湖北医药学院,基础医学院 十堰 442000;2.十堰市太和医院针灸治疗科,湖北医药学院附属医院 十堰 442000)
青藤碱(Sinomenine,SIN)是从青风藤的干燥根茎中提取的生物碱,具有镇痛、免疫抑制、抗炎、抗风湿及抗肿瘤等作用[1,2]。常用制剂有青藤碱缓释胶囊、盐酸青藤碱注射液等,因其对炎性因子IL-1β、IL-6β、IL-17β具有明显的抑制作用,故临床常用于治疗风湿、类风湿、骨性关节炎等[3]。在脊柱压缩性骨折愈合过程中,IL-1β、IL-6β、IL-17β等炎性因子影响骨折局部病理微环境,而骨生长分化因子2(growth differentiation factor2,GDF2)和骨保护素(Osteoprotegerin,OPG)则在骨折愈合过程中扮演重要角色,GDF2具有诱导成骨分化和骨形成能力,对促进骨痂形成具有重要意义[4]。作为破骨细胞生成抑制因子,OPG与骨吸收和重建密切相关,可抑制破骨细胞的分化,促进骨折部位破骨细胞凋亡,抑制骨吸收[5]。而VEGF及VEGF-mRNA高表达均可促进骨折愈合[6]。目前就盐酸青藤碱是否对OPG、GDF2和VEGF等促进骨折愈合的诸多因子产生影响尚无实验报导,本实验建立去势后家兔L1-L5骨质疏松脊柱压缩性骨折模型,观察盐酸青藤碱是否对以上所述诸多因子起到调节作用,为临床治疗此类疾病提供理论和实验依据。
1 材料与方法
1.1 实验动物及分组
SPF级家兔48只,雌性,兔龄6-7个月,体重2.9-3.1 kg,采用随机数字表编号,然后随机分为空白对照组、模型组、SIN组,每组16只(n=16)。
1.2 试剂及药品
盐酸青藤碱(宝鸡浩翔生物技术有限公司,批号:0170128);OPG和GDF2检测ELISA试剂盒(上海蓝基生物科技有限公司,批号:10090913);IL-1β、IL-6β、IL-17β检测ELISA试剂盒(上海信则生物科技有限公司,批号:017011105、017011107、017022129),兔VEGF、NO和SOD ELISA试剂盒(江苏酶标生物科技有限公司,批号:MB-2469A,MB-2470A,MB-2470A)。
1.3 造模及治疗
用10%水合氯醛腹腔注射麻醉,俯卧位固定家兔,然后采用去势手术切除家兔双侧卵巢,2个月后再手术制备L1-L5节段脊柱压缩性骨折模型。造模方法:动物麻醉后用8%硫化钠涂于L1-L5节段脊柱位置的皮肤,退去手术区兔毛,碘伏消毒,75%乙醇脱碘,模型组和SIN组做以下手术造模:铺无菌巾,纵行切开皮肤、钝性分离家兔L1-L5背阔肌、棘间肌及韧带,暴露L1-L5椎间盘,从脊柱侧前方剪断L1-L5节段椎体前缘,脊柱不做内固定;空白对照组不麻醉、不造模作为正常对照。术后在2周内每日强迫活动6小时,动物会因运动和重身重量压缩造成脊柱压缩性骨折[7]。因家兔前肢欠发达,但有发达的脊柱背侧肌群和腹侧肌群,其负重集中在后肢,生活体位多以半直立屈曲位为主,且造模手术是沿脊柱前缘L1-L5节段横断损伤的,兔的脊柱稳定性仍存在,动物清醒后生活及人为强迫活动会因脊柱在此负重状态下,脊柱受压,最终表现成压缩状态,形成L1-L5节段脊柱压缩性骨折模型[8]。在术后2周时,三组动物均存活,经拍摄CR分析,动物L1-L5节段脊柱均有明显压缩变短病理改变,说明建模成功。在术后2周成模时,用10%盐酸青藤碱在L1-L5脊柱两侧夹脊穴注射,青藤碱总用量为2 mL·kg-1·d-1,治疗 4 周。模型组和空白对照组注射等体积生理盐对照。
表1 3组OPG、GDF2表达比较(n=8,±s)

表1 3组OPG、GDF2表达比较(n=8,±s)
注:骨保护素(OPG);骨生长分化因子(GDF2);注:与空白对照组比较,△P <0.05;模型组比较,▲P <0.05,与同组治疗前比较,#P <0.05
1.4 观察指标
在治疗前和治疗后各取8只家兔的L1-L5脊柱及椎间盘,采用免疫组化染色法测定骨折脊柱骨GDF2、VEGF及VEGF-mRNA表达;ELISA法检测静脉血OPG、NO和SOD;免疫荧光法测定椎间盘二聚糖、图像分析法测L1-L5脊柱骨密度;ELISA法检测椎间盘炎性因子IL-1β、IL-6β和IL-17β水平,操作按ELISA试剂盒说明书进行。
1.5 统计学处理
使用SPSS 15.0统计分析软件 ,本实验所有数据均计算标准差,以±s表示,多组间先进行方差分析,对于组间的均数检验和组间两两比较采用LSD-t检验,以P<0.05,为差异有统计学意义。
2 结果
2.1 盐酸青藤碱对家兔OPG、GDF2的影响
见表1。空白对照组兔OPG、GDF2治疗前后无明显变化(P>0.05)。模型组治疗前后均低于空白对照组(P<0.05)。SIN组治疗治疗前低于空白对照组(P<0.05),治疗后明显升高,与同组治疗前及模型组比较(P<0.05),差异有统计学意义。
2.2 盐酸青藤碱对家兔IL-1β、IL-6β和IL-17β的影响
见表2。空白对照组IL-1β、IL-6β和IL-17β治疗前后无明显变化(P>0.05)。模型组治疗前后均高于空白对照组比较(P<0.05)。SIN组治疗治疗前低于空白对照组(P<0.05),治疗后明显降低,与同组治疗前及模型组比较(P<0.05),差异有统计学意义。
表2 3组IL-1β、IL-6β和IL-17β比较(n=8,±s)
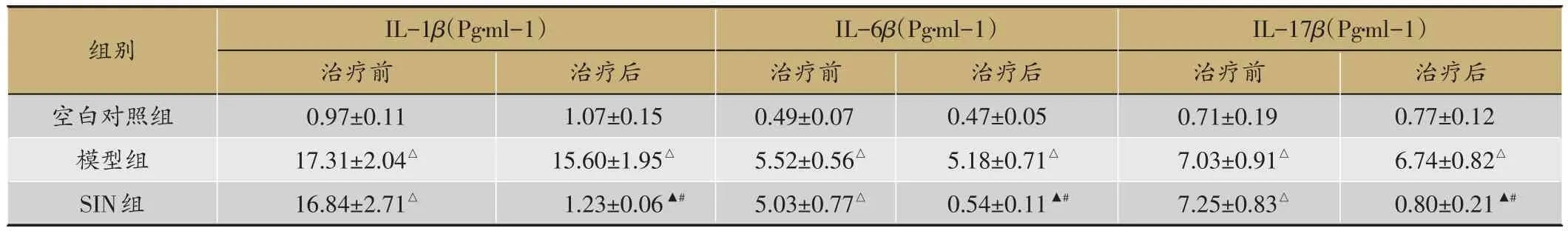
表2 3组IL-1β、IL-6β和IL-17β比较(n=8,±s)
注:白介素-1β:IL-1β;注:与空白对照组比较,△P<0.05;模型组比较,▲P<0.05,与同组治疗前比较,#P<0.05
组别空白对照组模型组SIN组IL-1β(Pg·ml-1)治疗前0.97±0.11 17.31±2.04△16.84±2.71△治疗后1.07±0.15 15.60±1.95△1.23±0.06▲#IL-6β(Pg·ml-1)治疗前0.49±0.07 5.52±0.56△5.03±0.77△治疗后0.47±0.05 5.18±0.71△0.54±0.11▲#IL-17β(Pg·ml-1)治疗前0.71±0.19 7.03±0.91△7.25±0.83△治疗后0.77±0.12 6.74±0.82△0.80±0.21▲#
表3 3组二聚糖光密度及骨密度比较(n=8,±s)
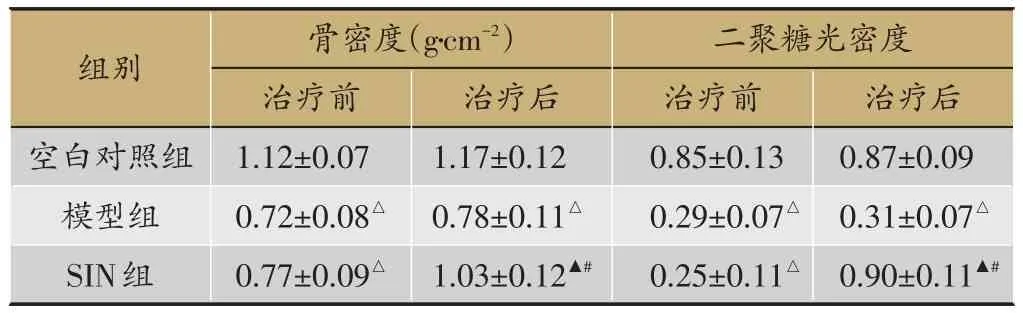
表3 3组二聚糖光密度及骨密度比较(n=8,±s)
注:与空白对照组比较,△P<0.05;模型组比较,▲P<0.05,与同组治疗前比较,#P<0.05
表4 3组VEGF、VEGFmRNA表达比较(n=8,±s)
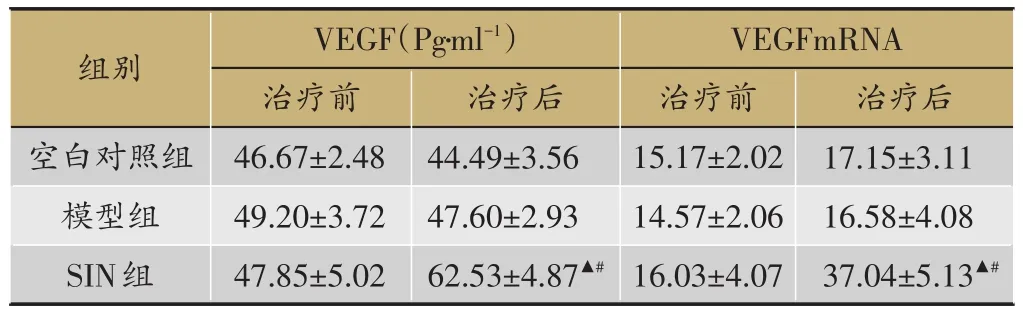
表4 3组VEGF、VEGFmRNA表达比较(n=8,±s)
注:血管内皮生长因子(VEGF),血管内皮生长因子基因表达(VEGFm⁃RNA);注:与空白对照组比较,△P<0.05;模型组比较,▲P<0.05,与同组治疗前比较,#P<0.05
表5 3组NO和SOD比较(n=8,±s)
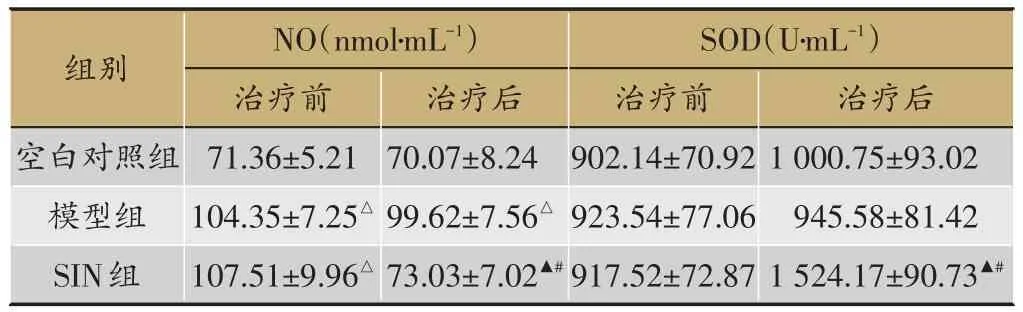
表5 3组NO和SOD比较(n=8,±s)
注:一氧化氮(NO);超氧化物歧化酶(SOD);注:与空白对照组比较,△P<0.05;模型组比较,▲P<0.05,与同组治疗前比较,#P<0.05
2.3 盐酸青藤碱对家兔骨密度和二聚糖光密度的影响
见表3。模型组二聚糖光密度及骨密度在疗前后均明显降低,与空白对照组比较(P<0.05)。SIN组治疗后显著升高,与同组治疗前及模型组比较(P<0.05),差异有统计学意义。
2.4 盐酸青藤碱对家兔骨折脊柱VEGF和VEGFm-RNA的表达的影响
见表4,空白对照组和模型组疗前后VEGF、VEG⁃FmRNA均有一定表达,但与同组治疗前比较(P>0.05),模型组与空白对照组比较(P>0.05)。SIN组治疗后高表达,与同组治疗前及模型组比较(P<0.05),差异有统计学意义。
2.5 盐酸青藤碱对NO和SOD的表达的影响
见表5,模型组疗前后SOD均正常,与空白对照组比较(P>0.05),NO治疗前和治疗后均升高,与空白对照组比较(P<0.05)。SIN组治疗前SOD均正常,与空白对照组比较(P>0.05),NO治疗前升高,与空白对照组比较(P<0.05)。治疗后SOD显著升高,NO降低,与同组治疗前及模型组比较(P<0.05),差异有统计学意义。
3 讨论
脊柱压缩性骨折以老年患者较多,特别是50岁以上的绝经妇女,此类患者多存在骨质疏松,在外力的作用下较易发生压缩性骨折。以往对青藤碱的研究主要局限在风湿、类风湿、骨关节炎、肿瘤等方面[9],而没有针对骨质疏松性骨折方面的研究,本研究填补了青藤碱对骨质疏松脊柱压缩性骨折的影响,为临床应用提供实验依据。本研究发现,在经盐酸青藤碱治疗后,SIN组椎间盘二聚糖增多,IL-1β、IL-6β、IL-17β含量降低、静脉血NO含量降低。二聚糖具有抑制IL-1β、IL-6β和IL-17β合成,调节椎间盘新陈代谢而达到抑制椎间盘退行性等的作用[10]。IL-1β可激活一氧化氮合酶而产生NO,在诱导软骨细胞凋亡的同时,诱导产生IL-6β和IL-17β,促进软骨细胞凋亡发生,降解软骨细胞基质,降低成骨细胞活性,减缓骨痂形成[11]。而因子IL-17β由活化的T细胞产生,可增强破骨细胞活性并最终导致骨侵蚀[12]。盐酸青藤碱可能通过增强椎间盘二聚糖的合成,调节椎间盘软骨细胞增殖和合成蛋白多糖的新陈代谢来影响IL-1β、IL-6β和IL-17β合成[13]。特别是抑制IL-1β后,可减少其刺激软骨细胞分泌PGE2,降低椎间盘基质金属蛋白酶的形成,从而抑制诱导型一氧化氮合酶表达,降低NO的产生,降低软骨细胞凋亡发生,增加软骨细胞基质,增强成骨细胞活性,从而加速骨痂形成[14]。
本研究还发现,SIN组L1-L5节段脊柱VEGF和VEGFmRNA高表达。VEGF可促骨折区域血管内皮再生、对建立动脉侧支循环,提高骨折区域营养及代谢中发挥着重要调节作用[15]。盐酸青藤碱夹脊穴注射吸收后,通过刺激骨折区域VEGF分秘,促进骨折区域血管内皮再生、建立新的动脉侧支循环,这有利于增加损伤局部的血供,间接促进骨折愈合。在动物实验中,Kimelman-Bleich N等[16]发现GDF2具有诱导成骨活性的作用,但在大鼠腰椎脊柱融合均动物模型中有明显促成骨作用。而OPG是机体成骨与破骨的重要偶联因子,主要功能是维持骨的正常矿化抑制破骨细胞的分化,抑制成熟破骨细胞的骨吸收活性并诱导其凋亡,从而减少骨吸收[17]。青风藤药性苦燥辛散,归脾经、肝经,善走经络,夹脊穴注射可直达病所,达到祛风湿、通经络的目的[18]。本实验夹脊穴注射符合中医经穴治疗体系的理论,夹脊穴位于腰椎棘突旁,深层有棘突韧带和肌肉等,针刺可改善微环境,促进局部炎性因子IL-1β、IL-6β等代谢,缓解肌肉痉挛,这不仅利于骨折愈合,还可提高SOD活性以清除机体自由基,而且减少炎症性病理改变,加速骨折愈合。
本实验以骨质疏松脊柱压缩性骨折模型为研究对象,系统观察了盐酸青藤碱对OPG、GDF2和VEGF等促进骨折愈合的诸多因子的影响,发现盐酸青藤碱“夹脊穴”注射可促进去势家兔L1-L5节段VCF愈合,这一结果对其可能应用于临床治疗骨质疏松脊柱压缩性骨折具有一定的参考价值。
1 张欣悦,高永翔.青藤碱的免疫抑制和抗炎活性研究进展.湖南中医杂志,2016,32(3):193-194.
2 陈伟毅,秦春宏,银晓刚.青藤碱抗肿瘤作用研究进展.中国药师,2013,16(10):1902-1903.
3 杨惠琴,陈礼荣.青藤碱注射液对兔膝骨性关节炎关节液及血清IL-6水平的影响.中医药导报,2007,13(10):62-63.
4 罗进勇.骨形态发生蛋白9促成骨的分子机制.重庆医学,2016,45(9):1153-1355.
5 赵燕,王艳,张燕.GLP-1对2型糖尿病大鼠血清OPG、RANKL及骨密度的影响研究.中国骨质疏松杂志,2016,22(6):700-705.
6 郑洁,王瑞辉,寇久社.青藤碱对兔膝骨关节炎模型软骨及滑膜血管内皮生长因子和神经生长因子表达的影响.中国中医药信息杂志,2016,23(03):38-41.
7 崔健超,江晓兵,杨志东.胸腰椎椎体骨折动物模型的研究进展.中国脊柱脊髓杂志,2015,25(7):666-669.
8 张淑娴,郭新全,邱玉金.兔椎体骨折动物模型制备的初步探讨.动物医学进展,2013,34(7):131-134.
9 秦峰,蔡辉.青藤碱药理作用研究进展.现代中药研究与实践,2016,30(04):81-86.
10 蔡颖,邱赛红,孙必强.盐酸青藤碱治疗风湿类疾病研究概况.中医药导报,2006,12(12):84-86.
11 杨惠琴,陈礼荣.青藤碱对膝骨性关节炎兔关节液及血清白细胞介素1β含量的影响.中西医结合学报,2008,6(12):1275-1279.
12 姚金丹,韩光红,胡敏.IL-17对破骨细胞中MMP-9表达水平的影响及其意义.吉林大学学报 (医学版),2016,42(3):462-466.
13 张群燕,姚茹冰,蔡辉.青藤碱抑制类风湿关节炎骨破坏的研究进展[J].安徽医药,2016,20(1):1-4.
14 Yang,H Q,Chen L R,et a1.Effects of sinomenine on synovial fluid and serum content of interleukin-1beta in rabbits with osteo⁃arthritis.Chin J Integr Med.2008,6(12):1275-9.
15 周正楠,张岩,邱旭升.骨折愈合过程中vegf的表达与调控及其作用的研究进展.中国矫形外科杂志,2015,12(24):2248-2251.
16 Kimelman-Bleich N,Pelled G,Zilberman Y,et a1.T argeted gene-and-host progenitor cell therapy for nonunion bone fracture repair.Mol Ther,2011,19(1):53-59.
17 Wagner D, Fahrleitner-PammerA. Levels of osteoprotegerin(OPG)and receptor activator for nuclear factor kappa B ligand(RANKL)in serum:are they of any help.Wien Med Wochenschr,2010,160(17-18):452-457.
18 丁从珠,姚瑶,方芸.青藤碱对胶原诱导的关节炎大鼠血清OPG/RANKL、lL-17含量的影响.南京中医药大学学报,2012,28(4):330-333.

