匙羹藤总皂苷通过调控脂肪组织PI3K/AKT信号通路改善胰岛素抵抗的作用机制研究*
秦灵灵,穆晓红,徐暾海,刘铜华
(1.北京中医药大学科技处 北京 100029;2.北京中医药大学东直门医院 北京 100700;3.北京中医药大学中药学院 北京 100029;4.北京中医药大学研究生院 北京 100029)
肥胖已成为全球性问题,据统计86%的2型糖尿病(type 2 diabetes,T2DM)是肥胖患者,近年来研究显示肥胖患者脂肪组织中异常病理改变可导致脂肪组织发生IR,进而引起T2DM发生发展[1],脂肪组织中胰岛素介导的PI3K-AKT信号通路是IR发生发展的主要分子作用机制[2]。本课题组前期实验表明,匙羹藤具有缓解IR的作用[3],而GA同时又是其降糖的主要作用成分,因此本实验以GA为干预因素,观察其对具有IR以及肥胖特征的KKay小鼠脂肪组织IR的作用,并以PI3K-AKT信号通路为切入点,观察其分子调控机制。
1 材料
1.1 实验动物
27只SPF级KKay小鼠(雄性,6-7周龄),9只同周龄雄性SPF级C57BL/6J小鼠,均购自中国医学科学院实验动物所,许可证号SCXK京2009-0004,均采用单笼喂养。
1.2 药物与试剂
GA提取流程:将匙羹藤生药2 kg按照料水比1:10,1.5 h→1:10,1.5 h→1:8,1 h进行煎煮,滤液浓缩至稠膏,干燥后制成粉末。称取粉末50.7000 g,水溶后超声15 min,过滤后分别用水、10%、50%、75%、95%的乙醇上大孔树脂RS-3洗脱,随后浓缩。采用香草醛-高氯酸比色紫外分光光度法测定各浓缩液中GA含量,选取皂苷含量最高的知50%乙醇洗脱物液用于实验。
盐酸吡格列酮片(北京太洋药业有限公司);MMLV反转录试剂盒(Takara公司);100bp DNA Ladder(北京全式金生物技术有限公司);扩增试剂盒(北京中原领先科技有限公司);Trizol试剂盒(Invitrogen公司);Agarose(Promega公司);DEPC(Sigma公司);蛋白质Marker(MBI公司);AKT抗体(CST公司,#4685);PAKT(ser473)(CST 公 司 ,#4060);P-AKT(Thr 308)(CST公司,#4056);PDK1抗体(CST公司,#3062)。
1.3 主要仪器
低温高速离心机(3κ30,Sigma)、实时荧光定量PCR仪(ABI 7500)、高速4℃低温离心机(Thermo)、核酸紫外分光光度计(Biophotometer)、半干转电转印仪(Bio-Rad)、转膜仪(J-MAX,#ST-2)、稳压稳流电泳仪(Bio-Rad)、垂直电泳槽(Bio-Rad)、计算机图像分析仪(Image-Pro Plus Analysis Soft ware)。
2 方法
2.1 动物分组及饲养方法
动物适应性喂养1周后测随机血糖,选取非同日两次随机血糖13.9 mmol·L-1的27只KKay小鼠,按体重随机分为DM组、BG组、GA组。选取9只C57BL/6J小鼠作为NC组。KKay小鼠喂以KK高脂鼠料,C57BL/6J小鼠喂以普通饲料。
2.2 给药方法
采用灌胃方式,按1 mL·100 g-1/天(但不超过0.5 mL)的体积给药。按照体表面积法换算小鼠给药剂量:BG组4.05 mg·kg-1/天;GA组按照中药生药量15 g·kg-1/天给药;NC组和DM组给予相同剂量的无菌水。
2.3 检测方法
2.3.1 空腹血糖
空腹血糖取血方法:剪尾取血,用血糖仪及试纸测定;

表1 扩增基因的引物序列
2.3.2 Fins
Fins值测定方法为:放射性免疫法检测血清中Fins值;
2.3.3 ISI
ISI计算方法为:ISI=1/FPG×Fins,取其自然对数进行统计。
2.3.4 实时荧光定量PCR法检测目标mRNA含量
检测附睾脂肪组织中APN、PTEN、PI3K-p85mRNA表达量。① Trizol一步法提取总RNA:将脂肪组织放入研钵中加入液氮进行快速研磨,用核酸紫外分光光度计法检测RNA的浓度与纯度;②引物序列:见下表1;③RNA的体外反转与实时荧光PCR:采用25 μL反转录体系,42℃孵育60 min→70℃ 10 min,将cDNA加入20 μL反应体系,94℃预变性1 min,94℃ 15 s 、60℃ 34 s、72℃ 15 s 40个循环,72℃ 10min,用相对定量2-△△CT法分析结果。
2.4.5 western blot法检测 AKT、P-AKT(Ser473)、PAKT(Thr 308)、PDK-1蛋白表达量
提取细胞内蛋白→测定总蛋白含量→蛋白变性→SDS-PAGE电泳(10%SDS-PAGE分离胶,5%浓缩胶分离蛋白)→转印→封闭→一抗(1∶1 000比例稀释)孵育→二抗(1∶10 000稀释)孵育,室温放置1 h→清洗→ECL发光→用IPP软件对扫描图象的目的条带进行灰度分析。
2.5 统计学方法
采用SPSS 17.0统计软件包处理数据,数据以平均值±标准差(±s)表示,组间比较采用单因素方差分析方法,P<0.05为差异有统计学意义。
3 结果
3.1 一般情况
表2 各组小鼠摄食量的变化(±s)

表2 各组小鼠摄食量的变化(±s)
注:与NC组相比,*P<0.05。
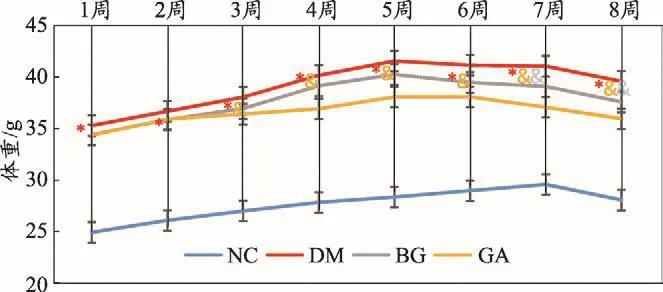
图1 各组小鼠体重的变化(±s)
表3 各组小鼠FPG、Fins、ISI水平(±s)

表3 各组小鼠FPG、Fins、ISI水平(±s)
注:与NC组相比,*P<0.05;与DM组相比,&P<0.05。
在给药期内由于灌胃操作失败,DM组小鼠死亡1只。NC组小鼠精神状态良好,皮毛有光泽,活动自如,反应机敏;DM组小鼠精神萎靡,皮毛干枯无光泽,动作迟缓,行为倦怠,反应迟钝,且在实验过程中逐渐加重;BG、GA组与DM组小鼠状态相似,在给药过程中,皮毛颜色有相黑色转变的情况,与DM组小鼠相比较,精神状态较好,活动时间较多且较灵活,反应较灵敏些。
3.2 GA对摄食量、体重的影响
从表2可以看出:与NC组摄食量相比较,DM组小鼠显著增加(P<0.05);在给药过程中,与DM组摄食量相比较,BG,GA组虽有减少但没有统计学意义。
从图1可以看出:与NC组体重相比较,DM组升高(P<0.05),与DM组体重相比较,BG组小鼠从第7周开始降低(P<0.05),GA组小鼠从第3周开始降低(P<0.05)。
3.3 GA对FPG、Fins、ISI的影响
由表3可以看出,经GA干预后,与NC组相比,DM组FPG、Fins水平升高,ISI降低(P<0.05);与DM组相比,BG组FPG、Fins水平降低,ISI升高(P<0.05),GA组FPG、Fins水平降低,ISI升高(P<0.05)。
3.4 GA对脂联素基因表达的影响
从图2-(1-3)可以看出:与NC组APNmRNA表达量相比较,DM组降低(P<0.05);与DM组APNmRNA表达量相比较,BG组、GA组均增加(P<0.01)。
3.5 GA对脂肪组织PI3K-p85mRNA表达量的影响
从图3-(1-3)可以看出:与NC组PI3K-p85mRNA表达量相比较,DM组降低(P<0.05);与DM组PI3K-p85mRNA表达量相比较,GA组增加(P<0.05)。
3.6 GA对AKT、P-AKT(ser473),P-AKT(Thr 308)蛋白表达量的影响
从图4-(1-6)可以看出:P-AKT(Thr 308):与NC组P-AKT(Thr 308)蛋白表达量相比较,DM组显著降低(P<0.01);与DM组P-AKT(Thr 308)蛋白表达量相比较,BG组升高(P<0.05),GA组显著升高(P<0.01)。P-AKT(Ser473):与NC组P-AKT(Ser 473)蛋白表达量相比较,DM组降低(P<0.05);与DM组PAKT(Ser 473)蛋白表达量相比较,GA组升高(P<0.05)。P-AKT(Thr 308)/AKT比值(磷酸化程度):与NC组AKT第308位Thr磷酸化程度相比较,DM组显著降低(P<0.01);与DM组AKT第308位Thr磷酸化程度相比较,BG组、GA组均显著升高(P<0.01)。PAKT(Ser473)/AKT比值(磷酸化程度):与NC组AKT第473位Ser磷酸化程度相比较,DM组降低(P<0.01);与DM组AKT第473位Ser磷酸化程度相比较,GA组显著升高(P<0.01),BG组此位点磷酸化程度有上升趋势,但是没有统计学差异。
3.7 GA对PDK-1蛋白表达量的影响
从图5-(1-2)可以看出:与NC组PDK-1蛋白表达量相比较,DM组增加(P<0.01);与DM组PDK-1蛋白表达量相比较,BG组降低(P<0.05),GA组降低(P<0.01)。
3.8 GA对PTEN基因表达量的影响
从图6-(1-3)可以看出:与NC组PTENmRNA表达量相比较,DM组没有显著变化,但是与DM组PTE-NmRNA表达量相比较,BG组、GA组降低(P<0.05)。

图2-1 各组小鼠APNmRNA表达量(±s)

图2-2 APN扩增曲线

图2-3 APN溶解曲线
4 讨论

图3-1 各组小鼠PI3K-p85mRNA表达量(±s)

图3-2 PI3K-p85扩增曲线
图3-3 PI3K-p85溶解曲线
目前,以IR为主要特征的相关代谢性疾病,包括2型糖尿病、高脂血症、高尿酸血症、心血管疾病及代谢综合征在全球呈迅速上升趋势,而肥胖成为了这类人群的潜在发病因素,越来越多的研究认为异常增多的脂肪组织引起的IR,是IR疾病群的触发因素[4]。胰岛素在其外周靶组织中借助于不同的信号通路发挥其对葡萄糖代谢及利用的生物学效应,其中PI3K/AKT占主要地位,该通路主要至通过与目标细胞表面胰岛素受体结合后,通过一系列反应使胰岛素受体底物被磷酸化,进而与PI3K的p85调节亚单位相结合,从而催化p110,最终激活PI3K,经过一系列级联反应最终通过磷酸化AKT第308位的苏氨酸以及473位的丝氨酸激活AKT,发挥生物学效应[5]。近年来发现PTEN具有削弱PI3K/AKT的作用,主要是通过特异地使磷脂酰肌醇-3,4,5-三磷酸3′位脱磷酸实现的[6,7]。PDK-1在PI3K/AKT信号通路中主要是在三磷酸肌醇的作用下与AKT相结合,参与了其第308位苏氨酸的磷酸化过程[8]。本实验在进行中,发现GA在不影响摄食量的前提下对于小鼠的体重具有明显的减轻作用,且可改善IR状态,因此本实验选择脂肪组织为目标组织,以PI3K/AKT信号通路为切入点观察GA干预IR的作用机制。

图4-1 各组小鼠目标蛋白表达量(自左到右为:NC,DM,BG,GA)

图4-2 各组小鼠AKT蛋白表达量(±s)

图4-3 各组小鼠P-AKT(Thr 308)蛋白表达量(±s)
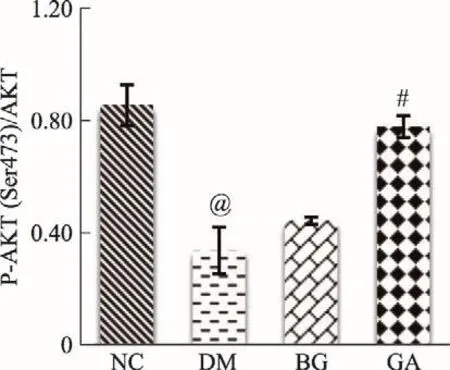
图4-6 各组小鼠P-AKT(Ser473)/AKT比值(±s)
KKay小鼠是一种自发2型糖尿病小鼠,表现为严重肥胖、高胰岛素血症、胰岛素抵抗等代谢异常综合征,研究发现KKay脂肪组织存在IR,且可能与PI3K信号通路传导障碍有关[9],适用于本实验的设计思路,故选取了KKay小鼠作为研究对象。

图5-1 各组小鼠目标蛋白表达量(自左到右为:NC,DM,BG,GA)

图5-2 各组小鼠PDK-1蛋白表达量(±s)
APN是近年来新发现的一种白色脂肪组织来源的具有多种生物活性的物质,研究显示其含量与脂肪组织IR呈负相关[10]。实验结果显示,经GA干预后,ISI指数升高,脂肪组织APN基因表达量降低,此两指标可从整体以及组织水平反映出GA改善脂肪组织IR的作用。对于PI3K-AKT信号通路,经GA干预后表现为被激活状态:①增加PI3K-p85mRNA的表达;②增强AKT第308位苏氨酸、第473位丝氨酸的磷酸化:虽然对AKT的表达量没有影响,但是增加了两个磷酸化位点蛋白的表达量,从而增强了其磷酸化程度,进而增强了AKT的激活程度;③调节因子PDK-1蛋白表达量降低:虽然对于PI3K-AKT信号通路PDK-1起到正调节作用,但是PDK-1在模型小鼠脂肪组织中表现出表达量增加的现象,初步分析可能在IR状态下,PI3K被抑制,三磷酸肌醇含量随之降低,抑制了PDK-1的激活,而PDK-1的激活主要是通过PH域与细胞膜三磷酸肌醇相结合而被固定在细胞膜而实现的,因此存在于细胞浆中的未被激活的PDK-1含量增加,实验中提取的是细胞内的蛋白(未被激活的PDK-1),因此表现出来的是含量增加的现象,在经GA干预后PI3K被激活,三磷酸肌醇含量增加,促进了PDK-1的激活,因此存在于细胞内的未被激活的PDK-1降低,间接提示了IR得以缓解,其并非是GA对该信号通路的作用点,而是一系列调节作用所表现出来的现象;④减少PTEN基因表达量:与C57小鼠相比较,PTEN在模型小鼠脂肪组织中的基因表达量没有变化,但是在经过GA干预8周后,与模型组相比,给药组小鼠体内的基因表达量降低,由此推测其对PIK/AKT信号通路的抑制作用减弱,间接起到了增强该通路作用的效应。本实验同时以具有缓解IR作用的BG为对照药物,结果显示其具有改善IR的作用,但是其降低体重的作用较GA出现晚,GA表现出了其减肥的优势所在。在对PI3K/AKT信号通路作用方面,BG表现出的激活作用与GA也不尽相同,BG主要通过作用在AKT的第473位丝氨酸的磷酸化上,而GA在对PI3K的P85亚基、AKT第308位Thr、第473位Ser的磷酸化上均表现出其激活作用,提示GA对PI3K/AKT信号通路调控具有多靶点、多样化的特征。
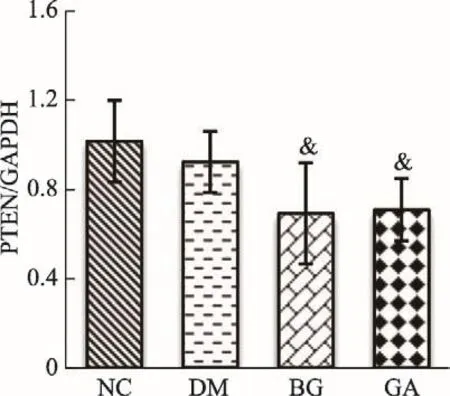
图6-1 各组小鼠PTENmRNA表达量(±s)
图6-2 PTEN扩增曲线
图6-3 PTEN溶解曲线
综上所述,GA可通过多环节激活脂肪组织PI3K/AKT信号通路,进而改善KKay小鼠IR,但其具体分子调控机制还有待进一步的研究。
1 Reilly S M,Saltiel A R.Obesity:A complex role for adipose tissue macrophages.Nat Rev Endocrinol,2014,10(4):193.
2 GuilletC,Masqrau A,Walrand S,et al.Impaired protein metabolism:interlinks between obesity,insulin resistance and inflammation.Obesity Rev,2012,13(2):51-57.
3 TiwariP,Mishra B N,Sangwan N S.Phytochemicaland pharmacologicalproperties ofGymnema sylvestre:an important medicinal plant.Biomed Res Int,2014,2014(1):830285.
4 Gustafson B.Adipose tissue,inflammation and atherosclerosis.J Ath-eroscler Thromb,2010,17(4):332-341.
5 戴冰,吴沁璇,肖子曾,等.六味地黄汤及其水提醇溶部位对2型糖尿病模型大鼠脂肪组织中PI3K/Akt信号通路的影响.中成药,2016,38(02):428-430.
6 曾静波.PTEN、FoxO3a与PI3K-Akt通路在胰岛素抵抗发生机制中所起作用的实验研究.北京:中国协和医科大学博士学位论文,2007.
7 NakashimaN,SharmaP M,ImamuraT,et al.Thetumor suppressorPTEN negatively regulates insulin signaling in3T3-L1 adipocytes.J Biol Chem,2000,275(17):12889-12895
8 Zhou Q L,Park J G,Jiang Z Y,et al.Analysis of insulin signalling by RNAi-based gene silencing.Biochem Soc Trans,2004,32(Pt 5):817-821.
9 张先慧,胡照娟,张艳红,等.辛开苦降方对初发2型糖尿病KKay小鼠肝脏胰岛素抵抗及IRS-2/PI3K通路的影响(英文).中华中医药杂志,2015,30(05):1774-1779.
10 安平,王安平,母义明.脂联素与胰岛素抵抗研究进展.生物技术通讯,2017,28(03):360-365.

