雷公藤红素-薏苡仁组分微乳的制备及其体内抗肺癌药效研究*
黄萌萌,李 萍,刘玉萍,刘聪燕,瞿 鼎,陈 彦**
(1.南京中医药大学附属中西医结合医院 南京 210028;2.江苏省中医药研究院中药组分与微生态研究中心 南京 210028)
微乳作为纳米载体之一,是一种热力学稳定的溶液体系[1],能够包载难溶性药物,促进其口服吸收利用[2-4]。尽管微乳制剂在促进药物吸收方面有许多优势,但与其它纳米制剂一样在中药方面的应用仍然存在:辅料用量多,载药量低,难以实现多组分载药等共性问题[5,6]。有研究发现某些植物中存在的一些组分如茶叶中儿茶素类成分EGCG[7]、生姜中脂质纳米颗粒[8]、葡萄柚中的脂质[9],既有一定的活性,又可用作药物载体,运送各种治疗药物,包括抗癌药物、DNA/RNA和抗体等,可以降低制剂辅料的用量,实现多组分载药的同时提高疗效,为解决上述问题提供了新的研究思路。本课题组近年来一直倡导“药辅合一”的设计理念,并从抗肿瘤中药中优选一批极具药理活性,又有辅料样作用的组分作为双功能组分,参与中药多组分纳米给药系统的构建。譬如,我们以薏苡仁油作为药物兼油相,人参皂苷作为药物兼类表面活性剂,荷载诸如灵芝三萜、依托泊甙等难溶性药物,制备了一系列具有中医药特色的口服多组分抗肿瘤微乳,不仅大大地降低了常规辅料的用量,还巧妙地将中药多组分整合到同一个递药系统中,实现了多组分协同抗肿瘤的设计初衷[10-14]。
众所周知,抗肿瘤药物常可导致不同程度的肝肾损伤[15-16]。基于上述“药辅合一”的设计思路,本课题组拟采用具有增强免疫、减轻毒性药物的肝肾损伤等作用的中药多糖作为功能性组分[17-19],参与多组分抗肿瘤微乳的构建。本研究首先对薏苡仁中的薏苡仁油及多糖进行了提取纯化,并以薏苡仁油为油相,薏苡仁多糖水溶液为水相,加入适宜的表面活性剂及助表面活性剂,荷载雷公藤红素,制备雷公藤红素-薏苡仁组分微乳(TCC-MEs),再表征其理化性质,评价其抗Lewis肺癌移植瘤活性,考察治疗所致的肝肾毒性。通过上述研究旨在达到以下四个目的:①通过微乳制剂促进抗肿瘤活性组分薏苡仁油、雷公藤红素及多糖的体内吸收;②降低制剂的辅料用量,实现中药多组分载药;③通过多组分配伍达到减毒增效作用;④充分利用薏苡仁药材中的有效组分,最终为探索高效低毒的中药多组分抗肿瘤纳米制剂提供理论依据和实践探索。
1 实验材料
1.1 仪器
Waters 2695型高效液相色谱仪(美国Waters公司)、ELSD-2000蒸发光闪射检测器(美国Alltech公司),Aglient 1260高效液相色谱仪(美国安捷伦公司),Aglient 6890 GC色谱仪,UV-1800型紫外可见分光光度计(上海奥析科学仪器有限公司),Nano-ZS型马尔文粒径测定仪(英国Malvern公司),HA221-40(50)-25型超临界萃取装置(江苏南通华安超临界萃取有限公司),HITACHI7020全自动生化分析仪(日本日立公司);贝克曼库尔特LH750全自动血液细胞分析仪(美国贝克曼库尔特公司);梅特勒-托利多十万分之一分析天平(美国METTLER TOLEDO公司),TG16W台式高速离心机(长沙湘智离心机仪器有限公司),85-2恒温磁力搅拌器(上海司乐仪器厂)。
1.2 药品与试剂
薏苡仁药材购于安徽亳州药材有限公司,经江苏省中医药研究院钱士辉研究员鉴定为禾本科植物Coix lacryma-jobi L.var.ma-yuen(Roman.)Stapf的干燥成熟种仁。雷公藤红素(纯度≥99%,泽朗医药科技有限公司,批号:ZL1508501Z),甘油三油酸酯(纯度≥98%,中国食品药品检定研究院;批号:111692-201501)聚氧乙烯氢化蓖麻油(Cremophor®RH 40,德国BASF公司),聚乙二醇400(PEG 400,国药集团化学试剂有限公司)。
1.3 实验动物与细胞株
实验动物:雄性ICR小鼠,20±2 g左右,由南通大学提供,清洁级,合格证号:SCXK(苏)2014-0001。江苏省中医药研究院动物中心常规饲养。
细胞株:Lewis肺癌细胞,购于上海和元生物技术股份有限公司。
2 方法与结果
2.1 薏苡仁油提取与分析
2.1.1 薏苡仁油的提取
采用本实验室优选的薏苡仁油超临界CO2萃取条件提取薏苡仁油。薏苡仁油提取过程如下:取500 g过12目筛的薏苡仁粗粉装入1 L萃取釜中,设定萃取釜压力为22 MPa,萃取温度为38℃;分离釜I压力为8 Mpa,温度为48℃;分离釜II压力为4 Mpa,温度为26℃;萃取装置内CO2流量控制在10 L·h-1,萃取时间为2.5 h,携带剂(95%乙醇)用量为3.0 mL·g-1生药。当达到设定的萃取时间后,从分离釜I和分离釜II出料口接收萃取液,合并萃取液,于37℃旋转蒸发回收溶剂,即得薏苡仁油,得率为2.8%。
2.1.2 薏苡仁油中总甘油三酯含量测定
按照实验室前期建立的紫外分光光度方法进行测定[20],以甘油三油酸酯为对照,测定薏苡仁油中总甘油三酯含量。结果表明超临界萃取得到的薏苡仁油中总甘油三酯含量以甘油三油酸酯计为70%。
2.1.3 薏苡仁油中的甘油三油酸酯含量测定及组分分析
采用HPLC-ELSD法分析薏苡仁油中成分,方法如下:
(1)色谱条件 色谱柱:ZORBAX SB-C18(4.6×150 mm,5 μm);流动相:乙腈∶二氯甲烷(68∶32),流速:1.0 mL·min-1;柱温:35℃;ELSD 参数:漂移管温度72℃,空气流速1.8 L·min-1;进样量:5 μL。色谱图见图1。
(2)对照品溶液的制备 精密称取甘油三油酸酯对照品适量于5 mL容量瓶中,加流动相溶解定容,摇匀,0.22 μm微孔滤膜过滤,取续滤液即得浓度为1.27 mg·mL-1的对照品溶液。
(3)供试品溶液的制备 分别精密称取薏苡仁油适量于5 mL容量瓶中,加流动相溶解定容,摇匀,0.22 μm微孔滤膜过滤,取续滤液即得供试品溶液。
(4)线性关系考察 依次将对照品溶液稀释配成浓度为 0.064 mg·mL-1、0.127 mg·mL-1、0.254 mg·mL-1、0.635 mg·mL-1、1.27 mg·mL-1的对照品溶液,取上述5个浓度的对照品溶液按照上述色谱条件进行分析,以样品峰面积值取对数值Y为纵坐标,对照品溶液浓度X(mg·mL-1)为横坐标,进行线性回归。得到回归方程为Y=1498.4x+12.495,R²=0.996 7,甘油三油酸酯在0.64-12.7 μg线性关系良好。
(5)样品分析
取供试品按上述测定条件测定,超临界萃取得到的薏苡仁油中甘油三油酸酯含量为6.26%,薏苡仁油中主要含7个成分,参照文献[21-22]并与对照品对照,除了含有甘油三油酸酯(峰6),还含有三亚油酸甘油酯(峰1),二亚油酸油酸甘油酯(峰2),棕榈酸二亚油酸甘油酯(峰3),亚油酸二油酸甘油酯(峰4),棕榈酸亚油酸油酸甘油酯(峰5)、棕榈酸二油酸甘油酯(峰7)。
2.2 薏苡仁多糖提取分离与分析
2.2.1 薏苡仁多糖的提取分离
参照前期预实验结果,称取经超临界萃取过的薏苡仁残渣2.0 kg,加入10倍量的水,煎煮2次,每次煎煮1.5 h,合并2次提取液,浓缩至提取液浓度为0.75 g·mL-1。将提取浓缩液先用95%乙醇醇沉至含乙醇质量分数为40%,4℃静置过夜,抽滤,取上清液,回收乙醇,浓缩液再加95%乙醇沉淀至含乙醇质量分数为80%,4℃静置过夜,4 500 r·min-1离心10 min,沉淀物冷冻干燥得薏苡仁粗多糖19.8 g,得率为1.0%。
2.2.2 薏苡仁多糖的初步分析
参照文献[23]采用紫外分光光度法,以葡萄糖为对照,采用苯酚-硫酸法测得薏苡仁多糖中总糖含量为53.72%。采用蒽酮-硫酸反应、三氯化铁反应、茚三酮反应、咔唑-硫酸反应、碘-碘化钾反应等检测表明薏苡仁多糖主要为还原性多糖。
采用高效凝胶渗透色谱法测定薏苡仁多糖的相对分子质量。采用TSKgel 4000PWXL色谱柱,将薏苡仁多糖及分子量分别为650、37、0.18 kD的葡聚糖标准品依次进样分析,使用Shimadzu LC solution GPC Analysis软件对各标准品的保留时间进行分析,再根据薏苡仁多糖的保留时间计算其分子量。结果表明薏苡仁多糖分子量分布主要在3.7-330 KDa之间。
采用DEAE-Sepharode Fast Flow弱阴离子交换柱对薏苡仁多糖进一步分离纯化,采用超纯水、0.1 mol L-1、0.5 mol L-1NaCl梯度洗脱,碘-碘化钾反应和苯酚硫酸法对洗脱液进行显色,收集多糖部位并采用薄层色谱法、气相色谱法对其单糖组成进行分析,结果表明薏苡仁多糖主要由葡萄糖、阿拉伯糖、木糖、半乳糖、果糖等组成。

图1 薏苡仁油对照品与样品色谱图
2.3 TCC-MEs的制备与表征
2.3.1 未荷载雷公藤红素的薏苡仁组分微乳(CCMEs)处方筛选
课题组在前期研究的基础上,首先对薏苡仁油微乳处方进行了筛选:以薏苡仁油为油相,并固定其用量为400 mg,RH40为表面活性剂、PEG400为助表面活性剂,(RH40与PEG400质量比3∶1,即Km值为3∶1),采用水滴定法制备微乳,观察微乳外观,并测定粒径,筛选薏苡仁油与混合表面活性剂用量。结果见图2A,制备所得微乳粒径随着RH 40用量降低逐渐增大,外观由澄清透明逐渐变为乳白色。当RH 40(wt%)大于25%时(以RH40量与载体比例计),微乳粒径均较小(<100 nm),因此采用薏苡仁油作为油相制备微乳,薏苡仁油与混合表面活性剂用量比应低于2∶1。研究表明20-40 nm粒径左右的小粒径纳米粒子更易于向肿瘤组织的深层渗透[24],因此为实现药物的深层渗透,本实验选择薏苡仁油微乳(C-MEs)处方为薏苡仁油400 mg,RH40 300 mg、PEG400100 mg,粒径为38.37 nm。
在确定制备C-MEs的上述处方后,继续考察加入薏苡仁多糖是否对C-MEs的粒径产生影响。称取薏苡仁油400 mg,RH 40 300 mg,PEG 400 100 mg磁力搅拌1 h,称取薏苡仁多糖50 mg溶于5 mL纯化水中,水滴定法制备微乳并定容至10 mL,考察微乳的粒径变化。结果见图2B,50 mg薏苡仁多糖的加入对微乳粒径大小基本无影响,且该微乳在不同稀释倍数下粒径与PDI均无显著性变化;在25℃的条件下保存1个月或1 300 0 r·min-1离心30 min均无明显絮凝和分层现象,粒径与PDI无显著性变化,表明该薏苡仁组分微乳处方可进行下步包埋难溶性抗肿瘤药物研究。
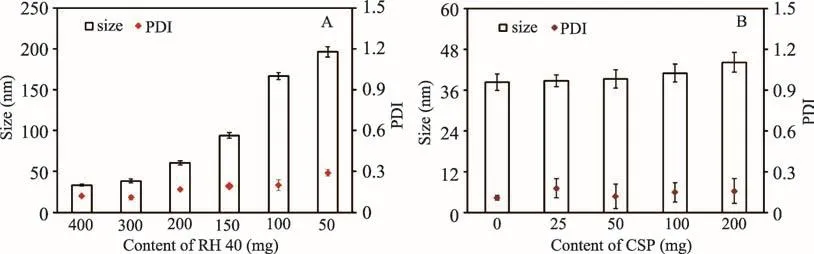
图2 RH40与薏苡仁多糖加入量对微乳粒径的影响 (n=3,±sD)
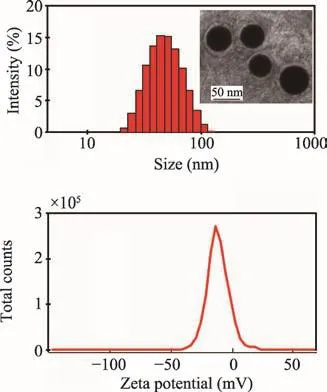
图3 TCC-MEs粒径(内部为透射电镜图)、电位图
2.3.2 雷公藤红素-薏苡仁组分微乳处方的确定
根据筛选得到的薏苡仁组分微乳处方,精密称取薏苡仁油400 mg,RH 40 300 mg,PEG 400 100 mg,分别加入雷公藤红素10、20、40 mg,每份样品重复3份,在磁力搅拌器下搅拌1 h,混合均匀,逐滴加入含50 mg薏苡仁多糖水溶液5 mL至形成澄清透明的溶液,加水定容至10 mL,磁力搅拌1 h,即得TCC-MEs。对其载药量、包封率、粒径及zeta电位进行考察,结果见表1,随着雷公藤红素加入量的增加,其包封率呈减小趋势,当雷公藤红素加入量为10 mg时,包封率最大,超过90%。因此选择处方中加入雷公藤红素10 mg。
表1 雷公藤红素-薏苡仁组分微乳的粒径、PDI、电位及雷公藤红素的包封率与载药量(n=3,±sD)

表1 雷公藤红素-薏苡仁组分微乳的粒径、PDI、电位及雷公藤红素的包封率与载药量(n=3,±sD)
雷公藤红素/mg 10 20 40多糖/mg 50 50 50 Size/nm 43.86±3.22 44.69±4.31 44.50±2.98 PDI 0.10±0.01 0.10±0.02 0.15±0.01 Zeta/mV-13.74±0.92-15.29±0.76-16.76±0.98包封率/%90.72±0.28 85.72±0.74 82.16±1.17载药量/%1.08±0.17 1.68±0.16 3.46±0.12
综上,TCC-MEs最佳处方与制备方法如下:称取RH40 300 mg,PEG 400 100 mg,薏苡仁油400 mg,雷公藤红素10 mg,磁力搅拌混匀1 h,滴加含薏苡仁多糖50 mg的水溶液至10 mL,即得。TCC-MEs平均粒径为(43.86±3.22)nm,Zeta电位为 (-13.74± 0.92)mV,雷公藤红素包封率为(90.72±0.28)%,载药量为(1.08±0.17)%。
2.4 TCC-MEs粒径和Zeta电位测定及形态观察
取纯化水将TCC-MEs稀释10倍,取1 mL稀释液加至马尔文激光散射粒度测定仪的样品池中,在室温下测定各微乳的平均粒径,Zeta电位及多分散指数(PDI);取TCC-MEs稀释5倍的微乳液1滴,滴于载有Formvar支持膜的铜网上,放于蜡板上,晾干,再滴加2%的磷钨酸1滴,晾干,用滤纸吸走多余的液体,放于透射电镜下观察微乳的外观形态。结果见图3,表明不同雷公藤红素荷载量制备的TCC-MEs粒径在43 nm左右,形态圆整,边缘清晰,粒径分布较均匀,呈弱电负性。
2.5 TCC-MEs体内抗肺癌药效评价
2.5.1 TCC-MEs体内抗肺癌药效
取对数生长期的Lewis肺癌细胞,用0.25%胰酶消化液进行消化,于1000 r·min-1下离心5 min,用灭菌的PBS溶液将细胞制成细胞悬液,调整细胞数为2×107个·mL-1。用一次性无菌注射器迅速在每只小鼠右腋部皮下注射0.1 mL新鲜制备的Lewis肺癌细胞悬液。小鼠接种后待右侧腋窝形成体积约80 mm3的硬质瘤后,随机分为4组,每组6只,分别为生理盐水对照组、雷公藤红素裸药组(T)、雷公藤红素-薏苡仁油微乳(TC-MEs,不含薏苡仁多糖)组、雷公藤红素-薏苡仁组分微乳(TCC-MEs)组,每天灌胃给药0.1 mL·10g-1(以雷公藤红素剂量计,10 mg·kg-1),每天用游标卡尺测量瘤体积大小,称重,观察并记录小鼠进食、活动状态及死亡情况。连续给药14天后,眼眶取血,颈椎脱臼处死,剥离腋下肿瘤、取肝、脾、肾、胸腺等脏器。
分别称取小鼠体重、肿瘤重量,计算抑瘤率。并称取肝脏、脾脏、胸腺重量,计算肝脏指数、胸腺指数和脾脏指数。根据如下公式计算肿瘤抑制率、肝指数、脾指数及胸腺指数。
抑瘤率(%)=(1-给药组平均肿瘤体积/模型组平均肿瘤体积)×100%,
脏器指数=脏器重量(mg)/小鼠体重(g)。
组间数据采用SPSS 21.0进行单因素方差分析。以均值±标准差(x˭±SD)表示,两组均数间的比较采用t检验,P<0.05认为差异有统计学意义。
结果见表2,由表可知,雷公藤红素组、TC-MEs和TCC-MEs抑瘤率分别为49.21%、64.89%和71.84%,TC-MEs和TCC-MEs组抑瘤率与裸药组相比显著提高(P<0.05),表明微乳制剂可以促进雷公藤红素的吸收,且薏苡仁油也具有抗肿瘤疗效,两者联用增强了抗肺癌疗效,发挥了中药多组分的增效优势;TCC-MEs疗效略优于TC-MEs组,但无统计学差异。值得注意的是,经TC-MEs治疗后,小鼠脾指数和胸腺指数显著低于雷公藤红素裸药组和TCC-MEs组,可能与TC-MEs微乳促进了雷公藤红素的口服吸收,间接地增加了药物对小鼠免疫功能抑制有关[25],而得益于多糖的引入,TCC-MEs一定程度上缓解了雷公藤红素免疫抑制作用,也体现了多组分协同构建带来的增效减毒优势。
2.5.2 肿瘤组织HE染色
取药效实验中各组小鼠的肿瘤投入到10%福尔马林中,用石蜡包埋、切片、染色,作常规病理检查,观察组织的形态学改变和肿瘤坏死情况。用显微镜观察,并拍摄图片,结果见图4。肿瘤组织HE染色结果显示,雷公藤红素组肿瘤组织有部分坏死,而TC-MEs和TCC-MEs组肿瘤组织出现大面积坏死现象,提示微乳制剂可以显著促进肿瘤组织的坏死。
表2 各组制剂的体重、肝、脾、胸腺指数及抑瘤率(n=6,±SD)

表2 各组制剂的体重、肝、脾、胸腺指数及抑瘤率(n=6,±SD)
与雷公藤红素组比较:*P<0.05,**P<0.01;与TC-MEs组比较:#P<0.05,##P<0.01,###P<0.001
抑瘤率/%NA 49.21±8.89 64.89±7.65*71.84±6.48**分组对照组雷公藤红素TC-MEs TCC-MEs体重/g 29.50±1.18 30.12±2.29 31.60±1.04 33.36±2.17肝指数/g.kg-1 49.03±4.34 48.86±3.87 54.93±4.89 50.32±3.50脾指数/g.kg-1 4.68±0.57 4.19±0.44 3.10±0.78*4.87±1.10##胸腺指数/g.kg-1 0.97±0.41 0.78±0.33 0.42±0.21*1.25±0.18###
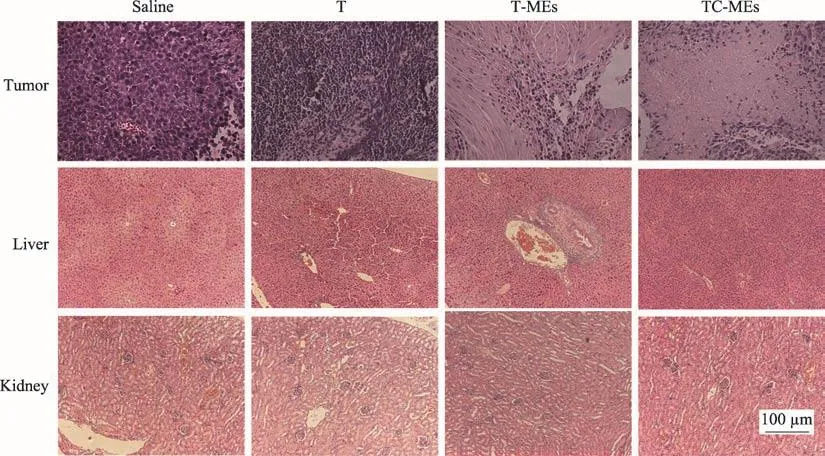
图4 各制剂组荷瘤小鼠组织HE染色(×100)
表3 各组制剂给药后小鼠血常规数据(n=6,±sD)

表3 各组制剂给药后小鼠血常规数据(n=6,±sD)
与正常组比较:*P<0.05,**P<0.01;与对照组比较:#P<0.05,##P<0.01
组别正常组对照组雷公藤红素组TC-MEs组TCC-MEs组白细胞计数/109⋅L-1 6.06±2.42 6.37±1.89 14.35±2.70**##17.9±3.90**##8.94±2.37红细胞计数/1012⋅L-1 9.53±1.19 8.61±1.37 9.79±1.61 10.26±1.96 8.83±0.91血红蛋白/g⋅L-1 179.33±26.91 154.24±22.54 175.50±25.89 193.60±27.45 168.25±15.94血小板计数/1011⋅L-1 15.51±1.82 15.28±1.45 15.92±1.22 16.42±2.11 17.35±1.98
表4 各组制剂给药后小鼠生化指标数据(n=6,±sD)

表4 各组制剂给药后小鼠生化指标数据(n=6,±sD)
与正常组比较:*P<0.05,**P<0.01;与对照组比较:#P<0.05,##P<0.01
2.6 TCC-MEs安全性评价
2.6.1 小鼠肝肾功能生化指标及血常规测定
取“2.2.2”项下的小鼠眼眶全血20 μL,采用全自动血液分析仪测定了WBC(白细胞计数)、RBC(红细胞计数)、HGB(血红蛋白浓度)及PLT(血小板计数)几项血常规指标。另取小鼠眼眶血液,4 000 r/min离心10 min获得200 μL血清,并对其肝功能指标谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、肾功能指标血尿素氮(blood urea nitrogen,BUN)进行测定。结果见表3、4。
由表3可知各给药组小鼠白细胞数目均有所升高,雷公藤红素与TC-MEs组白细胞数目显著升高,与正常组相比具有显著性差异(P<0.01),TCC-MEs组白细胞略有升高,但与正常组相比无统计学差异;红细胞数目、血红蛋白含量、血小板数与正常组相比均无统计学差异。各给药组血清肝功能指标ALT、AST与正常组相比均显著升高,而TCC-MEs组ALT、AST升高程度明显低于TCC-MEs;说明薏苡仁多糖的载入可以缓解雷公藤红素导致的ALT、AST升高;而各给药组肾功能指标BUN则基本无变化,均在正常范围之内[26]。
2.6.2 肝肾组织HE苏木精-伊红染色(hematoxylin-eosin staining)
取药效实验中各组小鼠的肝肾组织进行HE染色,观察组织的形态学改变,并拍摄图片,结果见图4。由肝组织切片可见TC-MEs组肝细胞索紊乱,有以淋巴细胞为主的炎症细胞浸润并伴有轻微纤维化;其它组肝细胞无明显形态学变化;肾组织切片显示,各组肾细胞均无明显形态学变化,本实验剂量下雷公藤红素及制剂组无明显肾损伤。
综合血液生化指标与HE染色结果,推测裸药雷公藤红素由于吸收较差,所以体内肝毒性作用相对较小,而TC-MEs对肝脏组织具有一定的损伤,原因推测为微乳促进了雷公藤红素的吸收,且微乳主要分布在肝脏,所以致使产生一定的肝毒性,而微乳中加入的薏苡仁多糖在一定程度上减轻了雷公藤红素-薏苡仁油微乳的肝损伤作用。
3 讨论
本实验采用超临界萃取法和水提醇沉法提取得到薏苡仁油和薏苡仁多糖,采用HPLC、UV高效液相色谱法(High Performance Liquid Chromatograph,HPLC),紫外可见分光光度法(UV-vis spectrophotometry)法等对其进行化学组成分析,以保证制剂所用药物来源稳定,质量一致,并将天然来源的薏苡仁油和薏苡仁多糖作为功能性辅料,在少量表面活性剂和助表面活性剂的作用下,成功制备得到雷公藤红素-薏苡仁组分微乳。该系统粒径在40 nm左右,外观圆整,分布均匀,药物(薏苡仁油、薏苡仁多糖和雷公藤红素)与载体(表面活性剂和助表面活性剂)比例达115%,相较常规微乳,载药量获得了极显著的提高。体内抗肺癌实验表明雷公藤红素-薏苡仁油微乳可显著提高雷公藤红素抗肿瘤疗效,潜在的药效学机制为两方面:一方面为微乳促进了雷公藤红素的口服吸收,使药物能够达到发挥疗效的有效浓度,另一方面薏苡仁油也具有抗肿瘤疗效[27,28],两者联用可实现协同增强抗肿瘤疗效作用。此外,一定量薏苡仁多糖的引入可以缓解雷公藤红素相关制剂所致的肝毒性。因此课题组后续将继续对薏苡仁组分与雷公藤红素联用增效减毒的机理进行深入研究,并探讨其他中药多糖组分是否有类似作用,为中药多组分微乳的研究提供参考,以期促进源自食用植物的纳米载体的开发,促进中药天然双功能辅料的应用,为安全的靶向药物运送平台的构建提供支撑。
1 Tanmoy D,Santinath G,Mahua G,et al.Comparative study of gastroin⁃testinal absorption of EPA&DHA rich fi sh oil from nano and conven⁃tional emulsion formulation in rats.Food Res Int,2012,49(1):72-79.
2 Acharya D P,Hartley P G.Progress in microemulsion characterization.Curr Opin in Colloid In,2012,5(17):274-280.
3 Shishu,K,Maheshwari M D.Evelopment and evaluation of novel micro⁃emulsion based oral formulations of 5-fluorouracil using non-everted rat intestine sac model.Drug Dev Ind Pharm,2012,38(3):294-300.
4 Yin Y M,Cui F D,Mu C F,et al.Docetaxel microemulsion for enhanced oral bioavailability:Preparation and in vitro and in vivo evaluation.J Control Release,2009,140(2):86-94.
5 刘根新,张继瑜,刘英,等.药用微乳的研究及存在的问题.湖北农业科学,2009,48(8):2029-2032.
6 Li W,Yalcin M,Lin Q,et al.Self-assembly of green tea catechin deriva⁃tives in nanoparticles for oral lycopene delivery.J Control Release,2017,248:117-124.
7 Chung J E,Tan S,Shu J G,et al.Self-assembled micellar nanocomplex⁃es comprising green tea catechin derivatives and protein drugs for can⁃cer therapy.Nature Nanotech,2014,9(11):907-12.
8 Zhang M,Xiao B,Wang H,et al.Edible Ginger-derived Nano-lipids Loaded with Doxorubicin as a Novel Drug-delivery Approach for Colon Cancer Therapy.Mol Ther,2016,24(10):1783-1796.
9 Wang Q,Zhuang X,Mu J,et al.Delivery of therapeutic agents by nanoparticles made of grapefruit-derived lipids.Nature Commun,2013,4(5):1867-1877.
10 Qu D,He J,Liu C,et al.Triterpene-loaded microemulsion using Coix lacryma-jobi seed extract as oil phase for enhanced antitumor efficacy:preparation and in vivo evaluation.Int J Nanomedicine,2014,9:109-119.
11 Qu D,Ma Y,Sun W,et al.Microemulsion-based synergistic dual-drug codelivery system for enhanced apoptosis of tumor cells.Int J Nanomed⁃icine,2015,10:1173-1187.
12袁成甜,贺俊杰,陈彦,等.灵薏方多组分微乳的制备及其抗肺癌活性研究.中草药,2014,45(22):3284-3288.
13李萍,黄萌萌,刘玉萍,等.雷公藤红素-薏苡仁油微乳的制备及其体外抗肿瘤活性评价.中国实验方剂学杂志,2017(6):1-6.
14 Qu D,Wang L,Liu M,et al.Oral Nanomedicine Based on Multicompo⁃nent Microemulsions for Drug-Resistant Breast Cancer Treatment Bio⁃macromolecules,2017,18(4).
15谢铮铮,梁瑶,孙路路.抗肿瘤药物肝毒性评价及在肝功能受损患者中的剂量调整.中国临床药理学杂志,2016,32(23):2203-2205.
16任军,周心娜.抗肿瘤药物肝损伤研究进展.中国药物应用与监测,2012(6):309-313.
17 Xiao J,Liong E C,Ching Y P,et al.Lycium barbarum,polysaccharides protect mice liver from carbon tetrachloride-induced oxidative stress and necroinflammation.J Ethnopharmacol,2012,139(2):462.
18姚莹华,刘强,陈育尧,等.丹参多糖对小鼠急性肝损伤的保护作用.中国实验方剂学杂志,2010,16(6):227-230.
19肖志勇.薏苡仁多糖防治化学性肝损伤实验研究.湖南中医杂志,2014,30(7):168-170.
20刘聪燕,黄萌萌,周静,等.不同产地薏苡仁药效成分含量与体外抗肺癌活性的相关性分析.中国实验方剂学杂志,2015,21(11):7-10.
21向智敏,祝明,陈碧莲,等.HPLC-MS分析薏苡仁油中的甘油三酯成分.中国中药杂志,2005,30(18):1436-1438.
22 Xi X J,Zhu Y G,Tong Y P,et al.Assessment of the Genetic Diversity of Different Job's Tears(Coix lacryma-jobiL.)Accessions and the Active Composition and Anticancer Effect of Its Seed Oil].Plos One,2016,11(4):e0153269.
23钟方晓,任海华,李岩.多糖含量测定方法比较.时珍国医国药,2007,18(8):1916-1917.
24 Wang J,Mao W,Lock L L,et al.The Role of Micelle Size in Tumor Ac⁃cumulation,Penetration,and Treatment.Acs Nano,2015,9(7):7195-206.
25李孟秋,窦洁,杜伟,等.雷公藤红素对小鼠的免疫抑制作用及其对IL-6 mRNA表达影响的研究.中国临床药理学与治疗学,2008,13(2):158-163.
26王冬平,曾林,尚世臣.实验动物血液生理生化参考手册.科学出版社,2011.
27 Aranya M,Mathukorn S,Charinya C,et al.Potent in vitro anti-prolifer⁃ative,apoptotic and anti-oxidative activities of semi-purified Job's tears(Coix lachryma-jobi Linn.)extracts from different preparation methods on 5 human cancer cell lines.J Ethnopharmacol.2016,187:281-292.
28 Zhan Y P,Huang X E,Cao J,et al.Clinical safety and efficacy of Kan⁃glaite® (Coix Seed Oil)injection combined with chemotherapy in treat⁃ing patients with gastric cancer.Asian Pac J Cancer P,2012,13(10):5319-5321.

