巧用实验计算提高教学效能
■郝蓉燕
巧用实验计算提高教学效能
■郝蓉燕
教师以实验探究方式引入对某一问题的解决,再将题型由探究题转换为抽象的计算题,并逐步改变问题或条件,与其他章节知识结合,逐步加深难度,能够让学生感性地、渐进式地掌握探究的方法以及一系列类似计算题的解法。
实验计算效能
当前,学生对化学计算题发怵,首先计算题相对于丰富多彩的化学世界来说显得单调枯燥,难以引起学生的兴趣;其次一道计算题往往包含题意的正确理解、隐含知识点的正确剖析、化学方程式的正确书写、数学计算的能力以及细心等诸多因素,综合性较强,因此对学生的要求较高。如何让学生爱做计算题、做好计算题,成了教师需要思考的问题。
我们可以将实验探究思想渗透到计算题的教学中,从身边的化学中发现问题、提出问题,让学生用探究的方法解决,然后将此实验探究题涉及的知识点改编为计算题。学生已经亲手做过实验,亲身体验过实验过程,解决计算题时对题意的理解就能非常准确,对列式中可能出现的错误也能避免。接着我们通过改变题目中的问题或已知条件的给出方式来逐渐加深题目的难度,引导学生积极思考、比较异同,逐步解决问题。这样的教学方法使学生能够从以往的被动接受知识、简单记忆中走出来,变为积极主动地去寻找相似点、相通点解决问题,解题能力将得到了极大的提高。
一、探究实验引入
下面以铜锌合金与酸反应的一类计算题型为例:
【提出问题】
“药金”又称“愚人金”,实为铜锌合金。由于“药金”外观与黄金相似,常被不法商贩用来冒充黄金牟取暴利。怎样甄别它?
【学生进行讨论并设计鉴别方案】
指导思想:利用“药金”中的成分铜或者锌与金的不同点进行区分。
设计原理:利用铜在空气中加热变成黑色的氧化铜,而金加热不变色加以区分;或利用锌能与稀盐酸(或稀硫酸)反应产生气体而金不与稀盐酸(或稀硫酸)反应加以区分。
【学生进行实验、观察现象、得出结论】
通过这样一个探究过程,学生不仅复习了原有的知识,而且能够灵活运用知识解决实际问题,还掌握了一整套解决问题的探究手法。
二、巧用计算
这个问题的解决并非到此结束,此时教师可以对问题进行适当改编,引申出下面一条常见的计算题。
例1:某化学兴趣小组称取10g“药金”(铜锌合金)于烧杯中,加入100g稀硫酸,充分反应后测得产生的氢气的质量为0.2g,求合金中锌的质量。
[分析]该题条件比较明确,什么样的物质以及对应的量都清楚给出,学生在做完实验的基础上能迅速理解。但教师讲解时要让学生明确:第一,铜锌合金的10g是合金的总质量,方程式中的Zn指的是参加反应的锌的质量,铜未参加反应,因此不能将10g代入方程式求解;第二,稀硫酸的100g是溶液的质量,既包括溶质硫酸的质量也包括溶剂水的质量,方程式中H2SO4指的是参加反应的溶质硫酸的质量,因此不能将100g代入方程式求解。两点综合起来最终让学生明确:不能将混合物的质量直接代入方程式中求解。
学生明确了注意点并顺利解决了例1后,教师可趁热打铁,将问题进行延伸,逐层加大难度,如改变为:
(1)求“药金”中铜的质量;(2)求“药金”中锌的质量分数;(3)求“药金”中铜的质量分数。
由于例1已知条件的明确给出,问题的改变并没有加大题目的难度,当学生为问题的解决而逐一沉浸在喜悦中时,教师可以向学生展示例2和例3。
例2:某化学兴趣小组称取10g“药金”于烧杯中,加入100g稀硫酸充分反应后,称得总质量减少了0.2g,求生成氢气的体积(标准状况下氢气的密度为0.089g/L)。
例3:某化学兴趣小组称取10g“药金”于烧杯中,加入100g稀硫酸充分反应后,称得烧杯内物质总质量为109.8g,求合金中铜的质量分数。
[分析]分析此两例,发现与例1最大的区别为:将例1中生成的氢气的质量为0.2g这一明确条件转变角度,用溶液质量的减轻和反应后各物质总质量的数值这种隐含的方式给出,由于学生已做过探究活动,可以很快分析出总质量之所以会减轻就是由于产生的氢气从整个体系中逸出,因此例2中减轻的0.2g即为氢气的质量,例3中反应后总质量比反应前总质量(合金的质量10g+硫酸溶液的质量100g=110g)减少了0.2g(110g-109.8g=0.2g),这就是氢气的质量。这一点明确以后,问题就迎刃而解了。
三、逐层推进,效能提升
以上例题的完成主要还是局限在金属材料这一单元,此时可以通过条件与问题的改变,与溶液这一单元联系起来,拓展学生的思路,开阔学生的眼界。具体见例4。
例4:某化学兴趣小组称取10g“药金”于烧杯中,加入100g稀硫酸充分反应后,称得烧杯内物质总质量为109.8g。求:(1)稀硫酸的溶质质量分数;(2)反应后溶液中溶质质量分数;(3)过滤,将滤液恒温蒸发掉6.2g水后,析出0.1g晶体(晶体不含结晶水),求所得溶液中溶质的质量分数。
[分析]问题(1)较简单,只要通过方程式求出参加反应的硫酸的质量再除以硫酸溶液的质量即可。问题(2)中必须向学生讲明两点:第一,反应后溶液中的溶质是什么,必须从方程式的右边即生成物中去找;第二,反应后溶液的质量不能直接视为倒入的稀硫酸的质量,而是发生了改变,到底怎样改变,由于学生已进行探究,可用图示法形象给出(见图1)。以质量守恒定律为依据,反应后溶液质量应等于所有原料质量之和(合金质量+稀硫酸质量),但必须扣除:①不溶于溶液的杂质质量,即m杂(如烧杯中铜的质量);②从体系中逸出的气体的质量,即m气(如氢气的质量);③以沉淀形式从体系中析出的固体质量,即m沉(此题未涉及),最终得到m溶液=(m固+m液)-(m杂+m气+m沉),当然生成溶液的质量也可用溶质质量加溶剂质量来求,但如果反应前后有多种溶液参与,而水又作为反应物或生成物之一,那么计算就会变得很繁琐,不如此法来得简单直观;第(3)问为一个完全的溶液方面的题目,只要将溶质减去0.1g晶体的质量,溶液减去6.2g水和0.1g晶体质量即可。

图1
我们还可以将其改编为实验处理型的题目。这种题目往往为了解决某一问题,设计一定的实验方案,给出图表,考查学生分析处理图形表格中的数据并最终解决问题的能力。对学生的各方面能力要求较高。如例5、例6。
例5:为了测定铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):

第三次50 100 0.4所取合金的质量/g所用稀硫酸的质量/g生成氢气的质量/g第一次25 120 0.4第二次25 160 0.4
(1)计算该铜锌合金中锌的质量分数;
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为_____时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应。
[分析]本题是一道利用所取原料质量的改变,比较生成物质的质量来确定原料最合适的质量比的实验型计算题。关键要着眼于化学方程式中参加反应的各物质以及生成的各物质的质量成正比例关系,通过比较各组中数据发现:第一次与第二次所取合金质量相同,第二次所用稀硫酸的质量比第一次多,但生成的氢气的质量却相等,由此说明第二次所用稀硫酸是过量的,合金是完全反应的,即25g合金完全反应掉会生成0.4g氢气;第三次所取的合金的质量为前两次的两倍,但产生的氢气却与前两次一样多,说明第三次所取合金为过量,而酸是完全反应的,即100g稀硫酸完全反应掉生成0.4g氢气,因此,生成0.4g氢气需要25g合金和100g稀硫酸,即25g合金与100g稀硫酸是恰好完全反应的,并且生成0.4g氢气。
例6:某同学利用日常生活用品制作了一套装置(见图2),用该装置对粗锌样品进行实验。请帮助其完成下列实验报告。
(一)实验目的:

图2
(二)实验用品:托盘天平、药水瓶、铜网、铜丝、饮料瓶、粗锌、稀盐酸、碱石灰(CaO和NaOH)
(三)实验步骤:
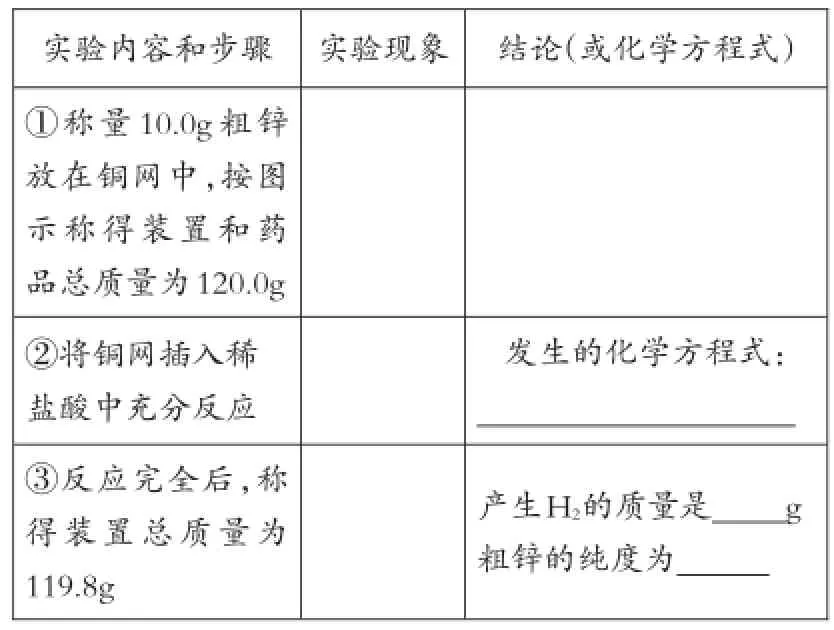
实验内容和步骤①称量10.0g粗锌放在铜网中,按图示称得装置和药品总质量为120.0g②将铜网插入稀盐酸中充分反应③反应完全后,称得装置总质量为119.8g实验现象结论(或化学方程式)发生的化学方程式:产生H2的质量是g粗锌的纯度为
[分析]此题实际上是例3的另一种给出形式,将一道简单的计算题设计成了一道非常新颖的实验题,关键是要从繁杂的文字中找出考查的知识点所在。此题实际上是利用铜网不与酸反应,而锌与酸反应,将铜网作为实验仪器将粗锌包住,伸入酸中,让锌与酸反应并产生氢气。氢气逸出时须经过碱石灰,其目的是将氢气可能带出的水蒸气以及挥发的氯化氢气体完全留在体系中,保证减少的是纯净氢气质量,减小误差。
利用装置总质量在反应前后的差值即氢气的质量(m氢气=120.0g-119.8g=0.2g)计算锌的质量,进而计算粗锌的纯度。明白了题意,实际就简化为了例3,解法略。
通过探究式实验的引入,题型的转换,难度的加深,学生能够逐步掌握探究的方法以及一系列计算题的解法。
(作者为江苏省江阴市暨阳中学教师)

