腌菜中亚硝酸盐的电化学检测
董哲,王力,刘宗瑞
(1.内蒙古民族大学分析测试中心,内蒙古通辽 028043;2.集美大学生物工程学院,福建厦门 361021)
腌菜中亚硝酸盐的电化学检测
董哲1*,王力2,刘宗瑞1
(1.内蒙古民族大学分析测试中心,内蒙古通辽 028043;2.集美大学生物工程学院,福建厦门 361021)
采用电沉积的方法将磷钨酸(H3PW12O40)沉积到预先用PDDA处理的玻碳电极上制得磷钨酸(H3PW12O40)修饰玻碳电极,通过循环伏安法分析该电极的电化学性质,研究其对亚硝酸盐的电化学作用,并测定腌菜中亚硝酸盐的含量。亚硝酸盐在6.67×10-6~8.01×10-5mol/L浓度范围内与电极还原电流呈线性关系,I(μA)=1.4508+0.0581c(μmol/L),R2=0.9985(n=12)。最低检出限:1.41× 10-6mol/L。响应电流达到95%时所需时间小于4s。该电极具有制备简单、响应快、灵敏度高、检测限低等特点,用于检测亚硝酸盐,效果良好。
多金属氧酸盐;电沉积;亚硝酸盐
腌制食品中大多含有亚硝酸盐,腌菜由于其加工品风味独特、营养丰富,既可满足不同的口味,又可增进食欲、帮助消化、促进健康,是人们最喜爱的食物之一。但蔬菜在腌制过程中,因其组织中含有硝酸盐,若制作过程控制不当,硝酸盐还原菌便可将菜体中的硝酸盐还原成亚硝酸盐[1,2],体内亚硝酸盐过量积累,可使血液中二价铁离子氧化为三价铁离子,使正常血红蛋白转变为高铁血红蛋白,失去携氧的能力,出现亚硝酸盐中毒症状[3-5]。此外,亚硝酸盐又是强致癌物N-亚硝基化合物的前体物,人体内和食物中的亚硝酸盐只要与胺类或酰胺类同时存在,就有可能形成强致癌性的亚硝基化合物[6-8],因此,对亚硝酸盐含量的测定十分必要。目前,亚硝酸盐的分析方法主要有电化学方法[9-11]、光谱法、色谱法[12]、荧光法等。多金属氧酸盐具有良好的氧化还原活性,常用作电化学催化剂[13]。本文通过制备磷钨酸(H3PW12O40)修饰玻碳电极来检测腌菜中亚硝酸盐的含量,该检测方法具有响应快、灵敏度高、检测限低等特点。
1 材料与方法
1.1 材料与试剂
H3PW12O40(以下简写为PW12)按文献[14]方法合成。邻苯二甲酸二乙二醇二丙烯酸酯(PDDA)(MW=450)购自Aldrich公司,且未经进一步纯化直接使用。亚硝酸钠(NaNO2)购自国药集团化学试剂有限公司,实验所用缓冲溶液是由1mol/L无水硫酸钠与1mol/L硫酸按1∶1混合而成。其余试剂都是分析纯,所有溶液均由超纯水配制。腌菜样品购于内蒙古通辽市大润发超市。
1.2 主要仪器与设备
ASCO FT/IR-480PLUS型傅立叶变换红外光谱仪 日本Jasco公司;CHI660C型恒电位仪 上海辰华仪器厂;KBr压片;电化学实验均在CHI660C型恒电位仪上进行,所用电解池为三电极玻璃电解池体系,电化学实验所采用的工作电极为玻碳电极(GCE),辅助电极为铂片电极,参比电极为Ag/AgCl电极。所有实验均在室温下进行。
1.3 实验方法
玻碳电极在使用前用1.0,0.3,0.05μm的Al2O3粉末从大尺寸到小尺寸依次仔细抛光成镜面后,在二次蒸馏水中超声波清洗20min,取出晾干后备用。将处理好的玻碳电极(基片)浸入50g/L的PDDA溶液中持续20min,取出后用水冲洗,再用缓慢的氮气流将基片吹干。将PDDA处理过的电极浸入10-2mol/L的磷钨酸溶液中,恒电位沉积2h。取出后用水洗净和吹干,制得组成为[PW12/PDDA]的复合膜。
2 结果与分析
2.1 磷钨酸红外吸收光谱
磷钨酸的IR光谱图见图1,在700~1100cm-1内出现4个Keggin结构的特征峰,806.7,895.1,982.5,1083.1cm-1分别归属于W-Od-W,W-Oc-W,W-Od,P-Oa反对称伸缩振动,表明该化合物具有杂多阴离子骨架。
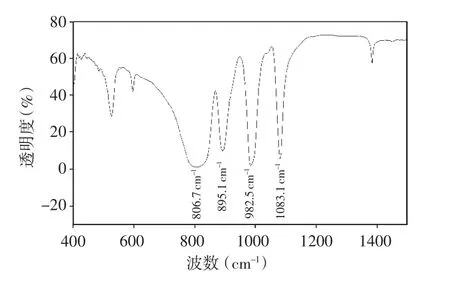
图1 磷钨酸红外光谱图Fig.1Infrared spectrogram of phosphotungstic acid
2.2 磷钨酸的电化学行为
空白电极在1mol/L H2SO4+1mol/L Na2SO4缓冲溶液中的循环伏安图见图2(a),在-0.8~0.2V的电位范围内未出现氧化还原峰。空白玻碳电极在加入6mmol/L PW12缓冲溶液中的循环伏安图见图2(b),可观察到PW12的3对氧化还原峰(I-I',II-II',III-III'),表明PW12在缓冲溶液中的电化学行为为三步还原过程。
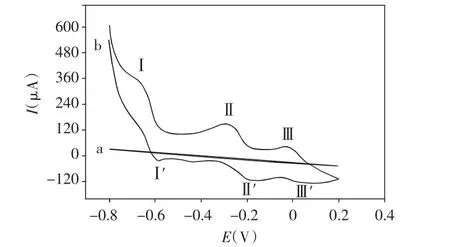
图2 (a)空白玻碳电极在1mol/L H2SO4+1mol/L Na2SO4缓冲溶液中的循环伏安图(b)空白玻碳电极在加入6mmol/mL PW12缓冲溶液中的循环伏安图Fig.2(a)Cyclic voltammogram of glassy carbon electrode(GCE)in 1mol/L H2SO4+1mol/L Na2SO4buffer solution(b)Cyclic voltammogram of glassy carbon electrode(GCE)in 6mmol/L PW12buffer solution
2.3 磷钨酸修饰电极的电化学行为
2.3.1 磷钨酸修饰电极在缓冲溶液中的电化学行为[PW12/PDDA]膜修饰玻碳电极在1mol/LH2SO4+Na2SO4缓冲溶液中的循环伏安图见图3,在-0.8~0.4V的电位范围内只出现2对氧化还原峰(I-I',II-II'),表明PW12在膜中的电化学行为为两步还原过程。

图3 [PW12/PDDA]膜修饰玻碳电极在1mol/L H2SO4+1mol/L Na2SO4缓冲溶液中的循环伏安图Fig.3Cyclic voltammogram of modified PW12/PDDA-GCE in 1mol/L H2SO4+1mol/L Na2SO4buffer solution
2.3.2 电流与扫速的关系

图4 [PW12/PDDA]膜修饰玻碳电极在1mol/L H2SO4+1mol/L Na2SO4缓冲溶液中当扫描速度不同时的峰电流循环伏安图Fig.4Peak current cyclic voltammogram of modified PW12/PDDA-GCE in 1mol/L H2SO4+1mol/L Na2SO4buffer solution at different scanning speeds
由图4可知,以I还原峰为例,在10~100mV/s的扫速范围内,I还原峰的峰电流与扫描速度成正比,表明[PW12/PDDA]膜修饰玻碳电极的电极过程为表面控制过程。
2.3.3 [PW12/PDDA]膜修饰玻碳电极对亚硝酸根电化学响应

图5 100mV/s扫描速度下修饰电极在pH 3.8的1mol/L H2SO4+1mol/L Na2SO4缓冲液中随着不同浓度NO2-离子的变化(由下到上为0,3.0,4.0,5.0mmol/L)的循环伏安图Fig.5Cyclic voltammogram of modified GCE pH 3.8in 1mol/L H2SO4+1mol/L Na2SO4buffer solution with different NO2-(from bottom to top:0,3.0,4.0,5.0mmol/L)at a scanning speed of 100mV/s
由图5可知,随着NO2-的加入,还原电流增大,I还原峰电流明显增大。而II-II'这一对峰电流变化很小。上述实验现象表明:该修饰电极对溶液中NO2-的还原反应具有良好的催化作用,该修饰电极有希望用作NO2-传感器。
2.3.4 [PW12/PDDA]膜修饰玻碳电极在溶液中对亚硝酸根的安培响应
在15mL的缓冲液中连续加入20μL 50mmol/mL的NO2-,以-0.2236V为工作电位,可得到修饰电极的稳态电流-时间响应曲线见图6,随着亚硝酸盐的连续加入,响应电流也发生阶梯式上升。该电极对NO2-响应迅速,达到响应电流95%时所需的时间小于4s。由图6可知,在6.67×10-6~8.01×10-5mol/L浓度范围内,NO2-的浓度与响应电流具有良好的线性关系:I(μA)=1.4508+0.0581c(μmol/L),R2=0.9985,表明该修饰电极对亚硝酸根具有良好的安培传感效应。

图6 [PW12/PDDA]膜修饰玻碳电极在15mL 1mol/L H2SO4+1mol/L Na2SO4缓冲溶液中连续加入20μL 50mmol/mL亚硝酸盐的电流-时间曲线Fig.6Curves(current-time)of modified PW12/PDDA-GCE in 15mL(1mol/mL H2SO4+1mol/mL Na2SO4)buffer solution with continuous addition of 20μL 50mmol/mL nitrite
2.3.5 [PW12/PDDA]膜修饰玻碳电极的稳定性
用电沉积的方法制备的[PW12/PDDA]膜修饰玻碳电极具有很好的稳定性,当电极在1mol/L H2SO4溶液中,在-800~+200mV的电位范围内,扫速为100mV/s的条件下扫描100周,其阴极电流下降不到10%。如果将电极在1mol/L H2SO4溶液中放置40天,其电极响应基本不发生变化。这种好的稳定性可能来源于膜内H4PW12O40与PDDA间的静电作用。
2.4 腌菜样品中亚硝酸根离子的测定
上述研究表明:制备的[PW12/PDDA]膜修饰玻碳电极对亚硝酸盐还原反应的催化作用具有迅速、灵敏度高、检出限低、操作简便等诸多特点,可以作为安培传感器对具体样品中的亚硝酸盐进行测定。
本实验用电化学法和盐酸萘乙二胺法分别对腌菜样品中亚硝酸盐的含量进行测定,测量结果见表1。
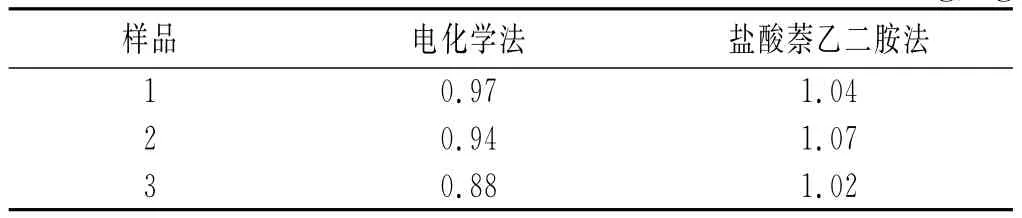
表1 两种方法的测定结果Table 1The determination results of two methods mg/kg
由表1可知,两种方法的测定结果很接近,说明[PW12/PDDA]膜修饰玻碳电极对亚硝酸盐含量测定的准确性高,方法可行。
3 结论
本文运用电沉积的方法制备[PW12/PDDA]膜修饰玻碳电极,研究其电化学行为,该电极对亚硝酸盐的还原具有很明显的催化活性,进而对腌菜中的亚硝酸盐含量进行测定,结果准确度高且快速、简便,进而为多金属氧酸盐应用于传感器领域提供了更为广阔的空间。
[1]Fytianos K,Zarogiannis P.Nitrate and nitrite accumulation in fresh vegetables from greece[J].Bull.Environ.Contam.Toxicol,1999,62(2):187-192.
[2]Zhang Qingfang,Chi Naiyu,Zheng Yan.Making inquiry about nitrite in fermentation of pickled vegetables[J].J.Microbiol.,2003,23(4):41-44.
[3]Van Staden J F,Makhafola M A.Spectrophotometric determination of nitrite in food stuffs by flow injection analysis[J].Fresenius J.Anal.Chem.,1996,356(1):70-74.
[4]Li Nan,Wang Peng,Liu Qingsong,et al.Microwave enhanced chemical reduction process for nitrite-containing wastewater treatment using sulfaminic acid[J].J.Environ.Sci.,2010,22(1):56-61.
[5]Pinar Erkekoglu,Hande Sipahi,Terken Baydar.Evaluation of nitrite in ready-made soups[J].Food Anal.Methods,2009,2(1):61-65.
[6]Huang Zuyun,Takashi Korenaga,Murad I H Helaleh.Kinetic spectrofluorimetric determination of nitrite in water samples and nitrogen dioxide in the atmosphere sampled by the liquid droplet method[J].Mikrochim.Acta.,2000,134(3-4):179-183.
[7]Mohammad Reza Ganjali,Simindokht Shirvani-Arani,Parviz Norouzi,et al.Novel nitrite membrane sensor based on cobalt(II)salophen for selective monitoring of nitrite ions in biological samples[J].Microchim.Acta.,2004,146(1):35-41.
[8]Kelley J R,Duggan J M.Gastric cancer epidemiology and risk factors[J].J.Clin.Epidemiol.,2003,56(1):1-9.
[9]Zhao Ge,Liu Kuaizhi,Lin Song,et al.Electrocatalytic reduction of nitrite using a carbon nanotube electrode in the presence of cupric ions[J].Microchim.Acta.,2004,144(1-3):75-80.
[10]Dai Zhihui,Bai Hongyan,Hong Mei,et al.A novel nitrite biosensor based on the direct electron transfer of hemoglobin immobilized on CdS hollow nanospheres[J].Biosens.Bioelectron.,2008,23(12):1869-1873.
[11]Zhang Zhiqiang,Xia Siqing,Didier Leonard,et al.A novel nitrite biosensor based on conductometric electrode modified with cytochromecnitrite reductase composite membrane[J].Biosens.Bioelectron.,2009,24(6):1574-1579.
[12]Siu D C,Henshall A.Ion chromatographic determination of nitrate and nitrite in meat products[J].J.Chromatogr.A.,1998,804(1-2):157-160.
[13]Jin Yana,Xu Lin,Zhu Liande,et al.Nanocomposite multilayer films containing Dawson-type polyoxometalate and cationic phthalocyanine:fabrication,characterization and bifunctional electrocatalytic properties[J].Thin Solid Films,2007,515(3):5490-5497.
[14]Phillips M A,Romford Essex.The preparation of phosphotungstic acid and of sodium and barium phosphotungstates[J].Journal of Chemical Technology and Biotechnology,1950,69(9):282-284.
Electrochemical Detection of Nitrite in Pickled Vegetables
DONG Zhe1*,WANG Li2,LIU Zong-rui1
(1.Analysis and Test Center,Inner Mongolia University for Nationalities,Tongliao 028043,China;2.College of Bioengineering,Jimei University,Xiamen 361021,China)
Phosphotungstic acid is fabricated on the glassy carbon electrode pretreated with PDDA by the electro-deposition method to obtain the POM modified electrode.Cyclic voltammetry technique is used to study the electrochemical properties of[PW12/PDDA]modified electrode,the electrode has a significant catalytic activity on the reduction of nitrite.The electrode reduction current has a linear relationship,I(μA)=1.4508+0.0581c(μmol/L),R2=0.9985(n=12)for nitrite in the range of 6.67× 10-6~8.01×10-5mol/L,the detection limit is 1.41×10-6mol/L.The preparation method is simple,with quick response,great sensitivity,low detection limit.The proposed method shows remarkable advantages and it should be applied in the practical aspects.
polyoxometalates;electro-deposition;nitrite
TS207.3
A
10.3969/j.issn.1000-9973.2017.03.026
1000-9973(2017)03-0114-04
2016-09-16 *通讯作者
国家自然科学基金(21261014);内蒙古民族大学博士启动基金(BS369)
董哲(1983-),男,实验师,博士,研究方向:生物无机化学。

