脂肪干细胞对角膜基质细胞增殖凋亡的调节及其机制研究
郑青青 沈江 沈婷 李秋实 洪朝阳 李文伟
脂肪干细胞对角膜基质细胞增殖凋亡的调节及其机制研究
郑青青 沈江 沈婷 李秋实 洪朝阳 李文伟
目的 探讨在体外共培养中,兔脂肪干细胞(ADSCs)对兔角膜基质细胞(CSCs)的影响及其作用机制,为角膜基质损伤治疗提供实验依据。方法 取新西兰大白兔腹股沟皮下脂肪组织,用I型胶原酶消化分离出ADSCs进行培养,贴壁细胞至3代,评价其多向分化能力。另取新西兰大白兔角膜基质层组织,用II型胶原酶消化分离出CSCs,传代至2代后备用。将CSCs及ADSCs(实验组)共培养3d后,与单纯CSCs(对照组)采用CCK-8法检测CSCs增殖情况,流式细胞术检测细胞凋亡情况,Western blot法检测细胞金属蛋白酶(MMPs)、胶原相关蛋白水平,评估在体外共培养中ADSCs对CSCs的影响。 结果 与对照组比较,CCK-8法检测结果提示实验组CSCs数量显著增高(P<0.05),流式细胞术检测结果提示实验组CSCs细胞凋亡减少,Western blot法检测结果提示实验组MMPs表达水平降低,胶原相关蛋白表达水平增加。结论ADSCs不仅可以促进CSCs增殖并抑制其凋亡,还可以促进细胞外基质的合成,在角膜基质损伤治疗中具有较好的应用前景。
脂肪干细胞 角膜基质细胞 损伤 增殖 基质金属蛋白酶
脂肪干细胞(adipose-derived stem cells,ADSCs)是一类存在于脂肪组织基质中、具有极强的自我更新和多向分化潜能的干细胞,具有来源丰富、取材方便及对机体损伤小等优势,被广泛应用于组织修复和细胞替代治疗[1-4]。ADSCs能够刺激干细胞微环境来分化产生所需的干细胞,且具有高度增殖的特性,可以分化成脂肪、骨骼、软骨、神经元和其他细胞谱[5-7]。据报道,目前我国角膜盲患者接近400万人,全国每年新增病例达45万。角膜移植术是目前角膜盲唯一可靠、有效的治疗手段。为了克服角膜来源匮乏和术后免疫排斥的困难[8],以细胞为基础治疗角膜损伤是目前一种有前景的治疗方法。Nishida等[9]最早尝试了应用口腔黏膜上皮细胞取代角膜缘干细胞治疗眼表疾病取得了很好的临床效果。然而临床上很多严重的眼表疾病都是引起角膜基质层损伤而最终致盲,给患者造成了巨大的痛苦[10-11]。因此,临床上急需具有正常生理功能的组织工程角膜。本实验通过体外共培养,观察兔ADSCs对角膜基质细胞(corneal stromal cells,CSCs)的影响及其作用机制,为角膜基质损伤治疗提供实验依据。
1 材料和方法
1.1 实验动物 健康新西兰大白兔(无锡菩禾生物医药技术有限公司);DMEM/F12培养液(美国Hyclone公司);胎牛血清(南京维森特生物技术有限公司);胶原酶(美国Invitrogen公司);茜素红检测试剂盒(西安赫特生物科技有限公司);CCK-8试剂盒(日本Dojindo公司);Annexin V-FITC/PI试剂盒(中国贝博公司);BCA蛋白定量试剂盒(美国thermo公司);RIPA组织细胞快速裂解液(美国Solarbio公司);Goat Anti-Rabbit(二抗,WB)和Alexa Fluor 488 conjugated Affinipure Goat(武汉三鹰生物技术有限公司);β-actin(一抗,WB)(美国Abcam公司);本实验其余所有抗体(北京博奥森生物技术有限公司)。
1.2 主要仪器 CO2细胞培养箱(美国Thermo Scientific公司);倒置拍照显微镜、激光共聚焦显微镜(德国徕卡公司);荧光显微镜(日本奥林巴斯公司);流式细胞仪(美国贝克顿-迪金森公司);离心机(湖南湘仪公司);电泳仪(北京六一仪器厂);酶标仪(芬兰雷勃公司)。
1.3 实验方法
1.3.1 兔ADSCs的分离培养[12]无菌状态下切取兔腹股沟皮下脂肪组织,用无钙镁磷酸盐缓冲液(含双抗)反复冲洗2~3次,再用眼科剪和眼科镊除去脂肪组织膜和血管。PBS缓冲液冲洗3次,脂肪球置于平皿内,眼科剪刀剪碎至糊状,移入25cm2培养瓶,加入2倍体积的 0.1%Ⅰ型胶原酶。在37.5℃预热的振荡培养箱内,190r/min消化30~35min。消化内容物移入离心管,用等量的含有10%FBS的DMEM/F12培养基终止消化,1 500r/min离心10min后弃去上清液。沉淀物用14ml含10%FBS的DMEM/F12培养基重新悬浮,接种于2个75cm2培养瓶,置于37℃5%CO2饱和湿度的培养箱中培养。24h后更换一次培养基,以后1次/3d换液,7~9d后细胞生长融合达80%~90%,经0.25%胰蛋白酶消化,按1∶2进行传代培养。
1.3.2 兔ADSCs的多向分化潜能 选取第3代兔ADSCs,以每孔1×105个细胞接种到置有盖玻片的6孔板中,37℃,孵育24h。待细胞贴壁后,分别加入成脂诱导培养基(含有10%FBS、10-6M地塞米松、10mg/L胰岛素、0.5mM 3-异丁基-1-甲基黄嘌呤和0.02mM吲哚美辛)、成骨诱导培养基(含有10%FBS、10-6M地塞米松、10-2M β-甘油磷酸、50μg/ml抗坏血酸的高糖-DMEM培养基),并设立加入普通培养基的孔为空白组,2次/周换液,分别于培养2周和3周后进行油红O及茜素红染色,倒置显微镜下观察并拍照。
1.3.3 兔CSCs的分离培养 无菌条件下摘取兔眼球,自角膜缘内侧1mm剪下全层组织片,D-Hank液冲洗2遍,显微镜下撕去角膜上皮层、前弹力层、后弹力层及内皮层,将获得的基质片剪成碎块,碎块应尽量小,加入1.5%Ⅱ型胶原酶消化液,37℃振荡消化45min,见仅有少许组织块剩余时,加入基质细胞完全培养液终止消化,1 000r/min离心5min×2次,制成细胞悬液,采用20%FBS+DMEM/F12将细胞悬液接种于培养皿或培养瓶中,置于37℃、体积分数5%CO2的细胞培养箱中培养。48h后换液,以后1次/2d换液。培养1周后待细胞融合达80%~90%后,胰蛋白酶消化,1 000r/min离心7min,弃上清液,按1∶2进行传代培养,传代培养时将胎牛血清浓度改为10%。
1.3.4 观察兔CSCs及细胞鉴定 选取第2代细胞,制备密度为1×104/ml的细胞悬液,细胞接种,分别于培养3、5、7、9d观察细胞形态,显微镜下拍照。采用免疫荧光方法检测CSCs中波形蛋白及CK12蛋白表达情况。
1.3.5 兔ADSCs与兔CSCs体外间接共培养 实验组(CSCs及ADSCs共培养)采用Transwell双层非接触共培养系统,将兔ADSCs接种在下室内,兔CSCs接种于上室内,上下层培养液以0.4μm聚碳酸酯膜相隔,进行体外共培养3d。将兔CSCs单独培养作为对照组(单纯CSCs)。
1.3.6 CCK-8法检测细胞增殖情况 将两组细胞接种于96孔板内,每孔100μl,培养时间0、24、48、72、96、120h后,用CCK-8孵育2h左右,酶标仪测定各孔450nm下吸光度,并计算各组细胞增殖率。
1.3.7 流式细胞术检测细胞凋亡 两组细胞分别用不含EDTA的0.25%胰酶消化细胞终止消化,1 500r/min离心5min,弃去上清液,收集细胞。用PBS重悬并洗涤细胞后,加入300μl含Ca2+的缓冲液悬浮细胞,并加入5μl的Annexin V-FITC混匀后,避光,室温孵育15min,再加入10μl的PI染色,轻轻混匀细胞,于避光条件下室温孵育10min,最后采用流式细胞仪检测,采用Cell Quest软件分析。
1.3.8 Western blot法检测细胞金属蛋白酶(MMPs)、胶原相关蛋白水平 将两组细胞分别加入100μl的RIPA裂解液,放入4℃冰箱,10min,充分裂解后收集裂解液,并置于离心机,12 000r/min离心5min,取上清液待用。配制SDS-PAGE分离胶,分别取30μg蛋白量的细胞总蛋白样品及maker加样,将预先设计处理好的两组样本按顺序加入上样孔,电泳,转膜后,将膜放入含5%脱脂奶粉封闭液,摇床振荡1.5h。封闭结束后将膜放入含一抗稀释液(β-actin、ALDH、MMP1、MMP2、MMP9稀释比为1∶500,Ⅰ型胶原、Ⅱ型胶原、Ⅲ型胶原、Ⅳ型胶原、Ⅴ型胶原稀释比为1∶400)的平皿中,4℃摇床振荡孵育过夜。第2天取出,室温振荡30min,吸弃一抗,TBST洗10min×3次,再用5%脱脂奶粉封闭液稀释二抗(二抗稀释比为1∶500),室温摇床振荡反应1~2h,然后用 TBST洗膜。最后将膜置于配置好的化学发光试剂液中显色,并使用FluorChen E型凝胶成像仪扫描成像。
2 结果
2.1 兔ADSCs的形态观察及分化潜能 兔ADSCs培养24h后可见少量散在的贴壁细胞,以长梭形细胞为主,部分呈三角形或不规则形。3d后可见较多的梭形贴壁细胞,生长速度快,后增生为形态相对均一稳定的成纤维样梭形细胞,7d后细胞融合至80%~90%。第3代ADSCs为长梭形,形态均一,增殖速度较快。ADSCs经成脂诱导2周后,可见细胞由长梭形变为椭圆形,经油红O染色可见细胞内大量红色脂滴形成(图1,见插页)。ADSCs在成骨诱导培养3周后,可见细胞呈多层生长,经茜素红染色可见细胞周围基质出现红色钙盐沉积(图2,见插页)。
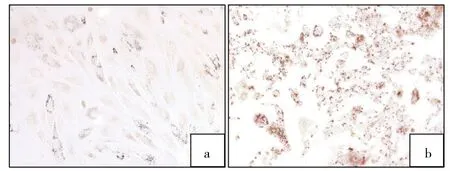
图1 兔CSCs油红O染色所见(a:空白组;b:成脂诱导组)
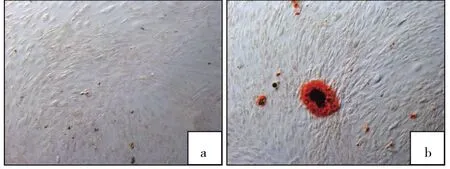
图2 兔CSCs茜素红染色(a:空白组;b:成骨诱导组)
2.2 兔CSCs的形态观察及鉴定 体外培养中兔CSCs经培养3d后,可见少量散在的贴壁细胞,多呈纺锤形,且生长较快,一般7~9d融合(图3,见插页),这表明角膜基质细胞状态良好,细胞活性高。细胞鉴定结果:兔CSCs胞质中特异性表达的波形蛋白阳性表达率>95%,CK12蛋白阳性表达率<5%(图4,见插页),这表明CSCs分离后纯度较高。

图3 兔CSCs形态特点

图4 兔CSCs免疫荧光检测结果
2.3 CCK-8法检测细胞增殖情况 从图5可见,两组细胞均随着时间的增长,细胞增殖明显。细胞培养24h后,实验组较对照组细胞数显著增高(P<0.05);细胞培养48h后,实验组较对照组细胞数极其显著增高(P<0.01);细胞培养72h后,实验组较对照组细胞数极其显著增高(P<0.01);细胞培养96h后,实验组较对照组细胞数显著增高(P<0.05);细胞培养120h后,实验组较对照组细胞数显著增高(P<0.05)。这表明ADSCs可促进CSCs的增殖。
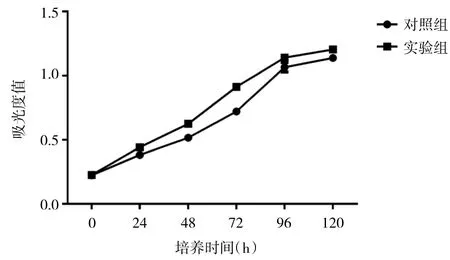
图5 CCK-8法检测细胞增殖情况
2.4 流式细胞术检测细胞凋亡情况 与对照组相比,实验组兔ADSCs对兔CSCs的凋亡有抑制作用。实验组通过共培养3d后,采用Annexin V-FITC试剂盒定量检测细胞凋亡率,结果显示对照组总凋亡率为7.81%,实验组总凋亡率为4.86%,差异有统计学意义(P<0.05),提示实验组细胞凋亡率较小(图6,见插页)。这表明ADSCs抑制角膜基质细胞的凋亡。
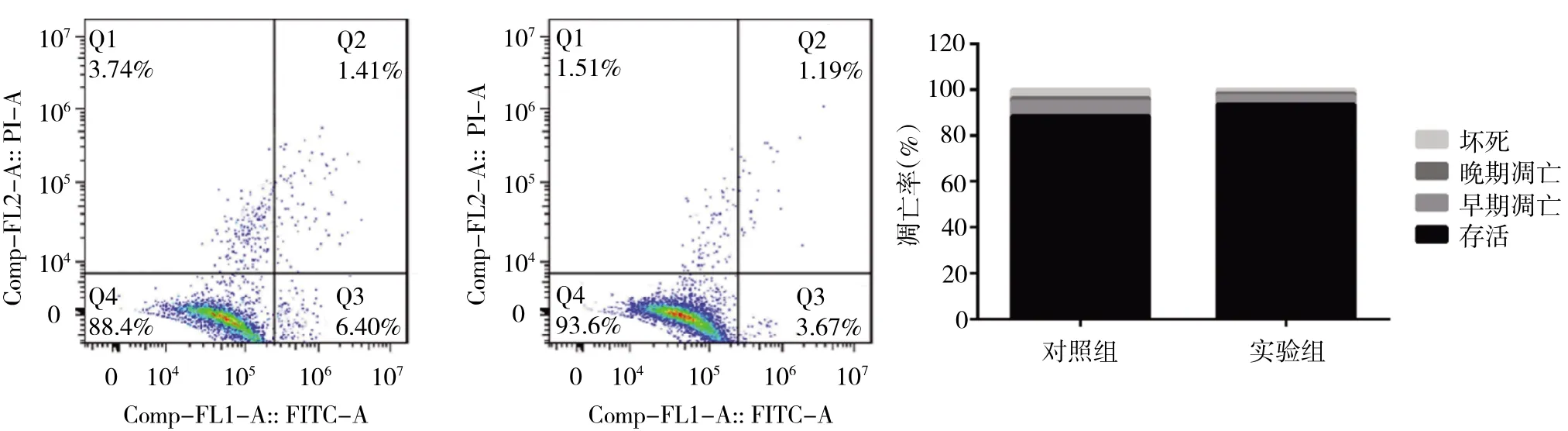
图6 两组细胞凋亡情况
2.5 Western blot法检测MMPs、胶原相关蛋白水平 实验组ALDH、Ⅰ型胶原、Ⅱ型胶原、Ⅲ型胶原、Ⅳ型胶原、Ⅴ型胶原表达均较对照组上调,MMP1、MMP2、MMP9蛋白表达均较对照组下调(图7)。这表明ADSCs有效抑制MMPs表达,促进胶原相关蛋白表达。
3 讨论
临床上因角膜疾病致盲的患者比例较高,同种异体角膜移植手术是目前治疗该类疾病的主要方式。但由于供体匮乏,加上术后免疫排斥发生率高,限制了其应用。因此,寻求有效的治疗角膜损伤的方法成为目前迫切需要解决的问题。利用种子细胞诱导转化或共培养为治疗此类疾病提供了一个新的思路。自2001年Zuk等[1]发现ADSCs以来,ADSCs因其具有取材方便、获取率高、对供区组织损伤小、体外扩增迅速以及多向分化潜能等优点,被广泛应用于再生医学中[4]。在分离培养兔ADSCs中,笔者取兔腹股沟区皮下脂肪组织,在取材时剔除血管及筋膜并用PBS反复冲洗,利用贴壁筛选法去除血细胞成分并分离出ADSCs。分离培养的ADSCs具有很好的增殖能力,与成脂及成骨诱导液作用后可向脂肪细胞及骨细胞分化,油红O及茜素红染色进一步证实了其多向分化的能力。
有研究表明,ADSCs在治疗多种再生疾病方面有着重要作用[13-14]。最新一项研究表明ADSCs在一定诱导条件下,可分化为血管内皮细胞及血管平滑肌细胞,在血管再生中发挥关键作用[15]。本研究主要观察兔ADSCs对CSCs的可塑性。在兔ADSCs与兔CSCs共培养中,CSCs的形态上未发生明显改变,在间接共培养72h后,通过CCK-8法检测发现兔ADSCs显著促进兔CSCs增殖,通过流式细胞术检测发现兔ADSCs能抑制CSCs凋亡。这与Arnalich-Montiel等[16]研究发现的在兔角膜基质缺损处注射人ADSCs悬液,ADSCs能存活在兔角膜基质中12周以上并进行了基质结构的重建相类似。
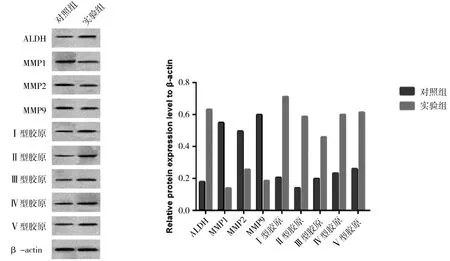
图7 两组细胞MMPs、胶原相关蛋白表达情况
1962年Gross首次发现MMPs,它是一类重要的蛋白酶,在细胞外基质的降解过程中起关键作用。在已经被发现的MMPs家族中共有五大类,其中第一类为胶原酶(包括MMP1),他们的主要水解底物是纤维类胶原,即Ⅰ、Ⅱ、Ⅲ型胶原;第二类为明胶酶(包括MMP2、MMP9),他们的主要水解底物是变性胶原及基膜的主要成分Ⅳ型胶原和Ⅴ型胶原等;第三类为基质水解酶类(MMP3和MMP10),水解底物比较广泛,如Ⅲ、Ⅳ、Ⅴ型胶原、明胶、蛋白聚糖以及糖蛋白等;第四类及第五类分别为膜型基质金属蛋白酶和基质溶解酶[17]。本研究发现实验组MMP1、MMP2、MMP3蛋白表达较对照组下降,而Ⅰ型胶原、Ⅱ型胶原、Ⅲ型胶原、Ⅳ型胶原、Ⅴ型胶原表达均上调,这表明ADSCs有效抑制MMPs表达,促进胶原相关蛋白表达。角膜主要由角膜上皮层、前弹力层、基质层、后弹力层及内皮细胞层组成,其中基质层占了90%。CSCs静息状态下呈纺锤形,且CD14及ALDH表达阳性[18]。胶原纤维特定排序及ALDH的均匀分布维持了角膜的透明性[19],有研究发现外伤后角膜透明度的减少与基质层ALDH表达减少相关[20]。本研究实验组ALDH蛋白表达较对照组明显增加,提示兔ADSCs在维持兔角膜基质层透明度可能有一定作用。
综上所述,本研究发现兔ADSCs可以促进CSCs增殖、抑制其凋亡,促进细胞外基质的合成,在角膜基质损伤治疗中具有较好的应用前景,这为后期角膜基质损伤治疗动物实验研究提供一定依据。
[1] Zuk P A,Zhu M,Mizuno H,et al.Multilineagecells from human adipose tissue:implications for cell based therapies[J].Tissue Eng,2001,7(2):211-228.doi:10.1089/107632701300062859.
[2]Ma X Y,Bao H J,Cui L,et al.The graft of autologous adipose-derived stem cells in the corneal stromal after mechanic damage[J].PLoS One,2013,8(10):e76103.doi:10.1371/journal.pone.0076103.eCollection2013.
[3]Cho S W,KimS S,Rhie J W,et al.Engineeringof volume stable adiposetissues[J].Biomaterials,2005,26(17):3577-3585.
[4]Strem B M,Hicok K C,Zhu M,et al.Multipotential differentiation of adipose tissue-derivedstemcells[J].KeioJMed,2005,54(3):132-141.
[5]Kaewkhaw R,Scutt A M,Haycock J W.Anatomical site influences the differentiation of adipose-derived stem cells for Schwann-cell phenotypeandfunction[J].Glia,2011,59(5):734-749.doi:10.1002/ glia.21145.
[6]van Dijk A,Niessen H W,ZandiehDoulabi B,et al.Differentiation of humanadipose-derivedstem cells towards cardiomyocytes is facilitated by laminin[J].Cell Tissue Res,2008,334(3):457-467.doi: 10.1007/s00441-008-0713-6.
[7] Anghileri E,Marconi S,Pignatelli A,et al.Neuronal differentiation potential of human adipose-derived mesenchymal stem cells[J].StemCellsDev,2008,17(5):909-916.doi:10.1089/scd.2007.0197.
[8]Alldredge O C,Krachmer J H.Clinical types of corneal transplant rejection.Their manifestations,frequency,preoperative correlates,and treatment[J].Arch Ophthalmol,1981,99(4):599-604.
[9] Nishida K,Yamato M,Hayashida Y,et al.Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium[J].N Engl J Med,2004,351(12):1187-1196.doi:10.1056/NEJMoa040455.
[10] Shimmura S,Tsubota K.Deep anterior lamellar keratoplasty[J].Curr Opin Ophthalmol,2006,17(4):349-355.
[11] Terry M A,Ousley P J.Small-incision deep lamellar endothelial keratoplasty (DLEK):six-month results in the first prospective clinical study[J].Cornea,2005,24(1):59-65.
[12]李春波,王红,陈增淦,等.兔脂肪干细胞(ADSCs)与聚羟基乙酸/壳聚糖(PLGA/CS)支架材料生物相容性研究[J].复旦学报:医学版, 2014,41(5):610-616.
[13]Rigotti G,Marchi A,Sbarbati A.Adipose-derived mesenchymal stemcells:past,present,andfuture[J].AestheticPlastSurg,2009, 33(3):271-273.doi:10.1007/s00266-009-9339-7.
[14] Wankhade U D,Shen M,Kolhe R,et al.Advances in adipose-derived stem cells isolation,characterization,and applicationinregenerativetissueengineering[J].StemCellsInt,2016, 2016:3206807.doi:10.1155/2016/3206807.
[15]Zhong Z,Gu H,Peng J,et al.GDNF secreted from adipose-derived stem cells stimulates VEGF-independent angiogenesis[J].Oncotarget,2016,7(24):36829-36841.doi:10.18632/oncotarget.9208.
[16] Arnalich-Montiel F,Pastor S,Blazquez-Martinez A,et al.Adipose-derived stem cells are a source for cell therapy of the corneal stroma[J].Stem Cells,2008,26(2):570-579.doi:10.1634/ stemcells.2007-0653.
[17] 赵云阁,欧尔比特·安尼瓦尔,祝诚.细胞外基质与基质金属蛋白酶[J].生物化学与生物物理进展,1999,26(3):223-228.
[18] Jester J V,Moller-Pedersen T,Huang J,et al.The cellular basis of corneal transparency:evidence for'corneal crystallins'[J].J Cell Sci,1999,112(Pt 5):613-622.
[19] Maatta M,Vaisanen T,Vaisanen M R,et al.Alteredexpression of type XIIIcollagen in keratoconus and scarred human cornea:Increased expression in scarred cornea is associated with myofibroblastTransformation[J].Cornea,2006,25(4):448-453.doi: 10.1097/01.ico.0000183537.45393.1f.
[20]Funderburgh J L,Mann M M,Funderburgh M L.Keratocyte phenotype mediates proteoglycan structure:a role for fibroblasts in corneal fibrosis[J].J Biol Chem,2003,278(46):45629-45637.doi:10.1074/jbc.M303292200.
Effect of rabbit adipose-derived stem cell on proliferation and apoptosis of corneal stromal cells
Objective To investigate the effects of rabbit adipose-derived stem cells(ADSCs)on proliferation and apoptosis of rabbit corneal stromal cells(CSCs).MethodsADSCs were isolated from subcutaneous adipose tissue in groin area of New Zealand white rabbit with the method of collagenase type I digestion.The isolated ADSCs were cultured and passed to 3 generation and its differentiation ability was evaluated.CSCs were obtained from the corneas of New Zealand rabbits with the method of collagenase II digestion.After initial expansion,the CSCs were cultured up to passage 2 and then prepared for experiment.The CSCs were cultured alone(control group)or co-cultured with ADSCs(indirect co-culture group).After incubation for 72 h the proliferative capacity of CSCs was evaluated by CCK-8 assay,apoptosis of CSCs was determined by flow cytometry, the expression of matrix metalloproteinases(MMPs)and collagens was detected by Western blot,and the invasion activity of corneal stromal cells was also examined in vitro. Results Compared with the control group,ADSCs significantly promoted proliferation and invasion of CSCs in indirect co-culture group(P<0.05).The group with ADSCs showed low percentage of apoptotic cells.CSCs secreted lower levels of MMPs and higher levels of collagens in indirect co-culture group. Conclusion ADSCs can promote plasticity and EMC synthesis of corneal stromal cells,and suppress the apoptosis at the same time.It suggests that application of ADSCs may be a promising approach for corneal injury therapy.
Adipose-derived stem cells Corneal stromal cells Injury Proliferation Matrix metalloproteinases

2016-09-08)
(本文编辑:陈丽)
10.12056/j.issn.1006-2785.2017.39.5.2016-1361
浙江省科技厅重大专项(2013C03048-1)
310014 杭州,浙江省人民医院、杭州医学院附属人民医院眼科(郑青青、沈婷);温州医科大学眼视光学院(沈江、李秋实、洪朝阳);浙江省立同德医院眼科(李文伟)
李文伟,E-mail:wenwei60306@163.com

