蒲公英绿原酸固体分散体性能分析与比较
李 妍 王 杰 曹珂珂 - 汪张贵 - 王 娣
(蚌埠学院食品与生物工程学院,安徽 蚌埠 233030)
蒲公英(Herba Taraxaci)又叫婆婆丁,为菊科多年生草本植物。其含有绿原酸、蒲公英醇、有机酸、菊糖等多种健康营养成分。绿原酸是由咖啡酸与奎尼酸生成的缩酚酸,是植物有氧呼吸过程中经过莽草酸途径所产生的一种苯丙素类物质。绿原酸在热水中的溶解度较大,易溶于乙醇及丙酮,微溶于乙酸乙酯,难溶于三氯甲烷、苯等亲脂性有机溶剂。绿原酸具有广泛的生物活性,具有抗菌、抗病毒、降血压、保肝利胆和兴奋中枢神经系统等作用[1-5]。蒲公英及其绿原酸不仅在医药卫生领域引起关注,在食品特别是功能性食品的研究开发上也成为热点,在开发保健饮料、果汁的护色和增香及果品的保鲜和防腐等方面[5],也展现出较好的应用前景。
绿原酸存在着诸如水溶性差、吸收较差[十二指肠中,绿原酸组的表观吸收系数Papp为(1.700±0.53)×10-6cm/s]等问题[6]。有研究将绿原酸制成冻干粉针剂、滴丸、脂肪乳注射剂等以期改善其生物利用度,但采用上述各类方法虽然可以提高生物利用度但是工艺复杂,成本较高。相比之下,将难溶性药物制成固体分散体是一种提高生物利用度较为简便有效的手段[7]。固体分散体具有显著增加难溶性药物的溶出度,提高其生物利用度并延迟吸收,减小服药剂量等诸多特点[8-9]。制备固体分散体所用载体的性质以及制备工艺[10-12]都将影响固体分散体的体外溶解度、溶出速度和稳定性。
为了进一步提高制剂中绿原酸的溶解度和溶出度,增加其口服给药的吸收程度,采用2种载体材料制备成绿原酸固体分散体,并与物理混合物相比较以探讨不同高分子载体制备出的固体分散体提高药物溶解度和溶出度的潜力。
鉴于此,本试验拟以绿原酸固体分散体的体外溶解度、累积溶出度和稳定性为综合指标,考察绿原酸固体分散体的制备对绿原酸的体外溶解度和溶出速度的影响,以期对绿原酸新制剂的开发与利用提供帮助。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
蒲公英:产地蚌埠;
绿原酸对照品:纯度≥98%,上海源叶生物科技有限公司;
无水乙醇、盐酸:分析纯,国药集团化学试剂有限公司;
水:标准去离子水,实验室自制;
聚乙二醇:PEG4000,上海山浦化工有限公司;
聚乙烯吡咯烷酮:PVPK30,上海化学试剂有限公司;
胃蛋白酶:120 U/g,上海展云化工有限公司。
1.1.2 主要仪器设备
旋转蒸发仪:RE-2000B型,巩义市予华仪器有限责任公司;
循环水式真空泵:SHZ-D(III)型,巩义市予华仪器有限责任公司;
电子天平:FA214型,上海海康电子仪器厂;
紫外可见分光光度计:TU-1901型双光束,北京普析通用仪器有限责任公司;
溶出度测试仪:RC-6型,天津市新天光分析仪器技术有限公司;
扫描电镜:ZEISS Merlin Compact型场发射,Carl Zeiss MERLIN Compact Germany;
冷冻干燥机:FD5-2.5型,Gold SIM International Group Co.,Ltd.;
数控超声清洗器:JK-500DB型,合肥金尼克机械制造有限公司;
药物稳定性检查仪:WD-A型,天津市新天光分析仪器技术有限公司。
1.2 方法
1.2.1 标准曲线的制作 准确称取干燥的绿原酸标准品1.0 mg,用62%乙醇将其溶解,定容至100 mL,摇匀,配置成10 μg/mL的绿原酸对照品储备液[13]。在波长200~800 nm扫描,确定绿原酸对照品最大吸收波长为334 nm。精确吸取0.00,2.00,4.00,6.00,8.00,10.00,12.00 mL上述储备液分别置于10 mL容量瓶中,用62%乙醇定容,摇匀。配制成质量浓度为0.0,2.0,4.0,6.0,8.0,10.0,12.0 μg/mL的溶液,在最大吸收波长处测定其吸光度(A),同时用62%乙醇试剂作为空白对照品,以吸光度A为纵坐标、绿原酸质量浓度C(μg/mL)为横坐标,绘制标准曲线,得出标准曲线的线性回归方程:y=0.030 5x+0.000 2,R2=0.999 1,见图1。
1.2.2 蒲公英绿原酸提取工艺流程
蒲公英→烘干(低温30 ℃干燥至含水量将至1%以下)→粉碎(过80目筛)→乙醇溶液浸泡[液料比1∶19 (mL/g)、乙醇浓度62%]→超声波处理(超声功率480 W、58 ℃、40 min)→抽滤→减压浓缩(至无醇味)→冷冻干燥24 h (冷冻温度-50 ℃,真空度达到9 Pa)→绿原酸粗品[13]

图1 绿原酸标准曲线Figure 1 The Chlorogenic acid standard curve
1.2.3 绿原酸固体分散体的制备
(1) 绿原酸-PVP固体分散体的制备:绿原酸原料药和载体PVPK30分别按1∶2,1∶4,1∶6,1∶8(质量比)的料辅比混合,加入无水乙醇10 mL,搅拌至绿原酸与载体完全溶解,转入旋转蒸发仪中60 ℃除去溶剂,将其置于干燥箱中60 ℃充分干燥,粉碎过80目筛,即得绿原酸-PVPK30固体分散体,备用[14]。
(2) 绿原酸-PEG固体分散体的制备:绿原酸原料药与载体PEG4000分别按1∶2,1∶4,1∶6,1∶8的质量比混合,重复上述1.2.3(1)中的步骤制备绿原酸-PVPK30固体分散体,备用。
1.2.4 绿原酸与载体混合物的制备 将绿原酸与载体PVPK30、PEG4000分别按1∶2、1∶4、1∶6、1∶8的质量比混合研细,过80目筛,即得不同载体、不同配比的绿原酸混合物,备用。
1.2.5 固体分散体的性质检测
(1) 溶解度的测定:以10 mL人工胃液(pH 1.3)为溶解介质,依次加入过量的绿原酸、绿原酸固体分散体和绿原酸与载体混合物,置于37 ℃恒温水浴中,0.45 μm微孔滤膜滤过,测吸光度并计算溶解度[15]。按式(1)计算溶解度。
(1)
式中:
C——溶解度,μg/mL;
A——吸光度。
(2) 溶出度的测定:以600 mL人工胃液(pH 1.3)为溶出介质,温度设定为(37±0.5) ℃,转速100 r/min[16]。取绿原酸50 mg,绿原酸固体分散体适量(含绿原酸50 mg),绿原酸与载体混合物适量(含绿原酸50 mg),分别于5,10,20,30,40,50,70,90 min取样,每次取2 mL,同时补充同一温度与同一体积的新鲜溶出介质。样品经0.45 μm微孔滤膜滤过,测量其吸光度计算绿原酸质量浓度,并换算成累积溶出率。累积溶出率按式(2)计算:
(2)
式中:
C——累积溶出度,%;
An——各时间点测得溶出度;
V1——各时间点固定取样体积,mL;
V2——溶出介质体积,mL。
1.2.6 稳定性试验 将4种不同料辅比制成的样品分别分为两组,一组放入药物稳定性检查仪中,设定温度50 ℃、光照强度(5 000±500)Lx条件下[17]检测样品的稳定性;将另一组放在外界环境中检测样品的稳定性,作为对照组。每天取样,观察各样品的外观性状,并对绿原酸的浓度和溶出度进行检测。
1.2.7 扫描电镜观察绿原酸固体分散体结构 将绿原酸固体分散体研磨,彻底干燥后真空镀金70 s,用扫描电镜通过不同的分辨率观察绿原酸-PVPK30固体分散体(1∶4的质量比)表面和晶体结构[18]。
2 结果与分析
2.1 样品溶解度
由图2可知,随着辅料比(质量比)从1∶2增加到1∶4时,各处理组溶解度变化不大,略有下降;在同一辅料比下,各处理组溶解度大小变化顺序为:绿原酸-PVPK30固体分散体>绿原酸-PEG4000固体分散体>绿原酸-PVPK30混合物>绿原酸-PEG4000混合物,可能是由于制备成固体分散体,提高了其溶解度。
2.2 样品溶出度
2.2.1 样品溶出度 由图3可知,绿原酸原料药固体在溶出度测试仪中的溶出度和累积溶出度很小,表明绿原酸在没有载体的情况下,其在体外溶解速度较慢,且溶解需要有一定条件。这是由于PVPK30、PEG4000是水溶性高分子,与水完全互溶,绿原酸溶解度随 PVPK30、 PEG4000 比例的增大而增大。相同处方配比下,绿原酸-PEG4000固体分散体溶解度小于绿原酸-PVPK30的,可能是在固体分散体中绿原酸存在形式发生了变化,大部分以分子形式分散在 PVPK30中,其它则以更微小的结晶和无定型形式存在。当制备成固体分散体加入到人工胃液时,PVPK30很快溶解,其中的绿原酸分子随之转移并溶解,加上以微晶、无定型等形式存在,使绿原酸的溶解度大大提高[19]。

图2 不同方法制备成的样品溶解度曲线Figure 2 Solubility curves of solid dispersions with different material
2.2.2 载体材料的选择 由图4可知,在最佳料辅质量比为1∶4时绿原酸与载体材料制备的各类样品的溶出速率较绿原酸原料药均有显著提高,其中以绿原酸-PVPK30固体分散体的体外累积溶出率最大,50 min内累积溶出率达60%,明显高于绿原酸-PEG4000固体分散体和绿原酸与载体混合物,可能是PVPK30高分子材料作为载体可以有效地提高药物的溶出速度。因此,选用聚乙烯吡咯烷酮(PVPK30)为制备绿原酸固体分散体的最佳载体[20-22]。

图3 比较不同载体与不同料辅比制备成的样品随时间变化的溶出度曲线Figure 3 Dissolution curves of solid dispersions with different carriers and material ratio

图4 相同料辅比样品的溶出度曲线Figure 4 Dissolution curves of solid dispersions with the same material ratio
2.3 稳定性试验
绿原酸-PVPK30固体分散体与绿原酸-PEG4000固体分散体稳定性试验结果见图5、6。结果表明,绿原酸-PVPK30固体分散体在药物稳定仪中外观性状未变化,仍为淡绿色晶体,外界环境中的固体分散体有轻微潮解现象。
由图5、6显示,绿原酸固体分散体在强光照射下随着时间的延长,放在药物稳定性检查仪内的固体分散体中绿原酸的溶解度与外界环境条件下基本保持不变,可能是制备成固体分散体能够有效地提高药物的物理稳定性。

图5 绿原酸-PVPK30固体分散体稳定性试验结果Figure 5 Chlorogenic acid-PVPK30 solid dispersion stability tests
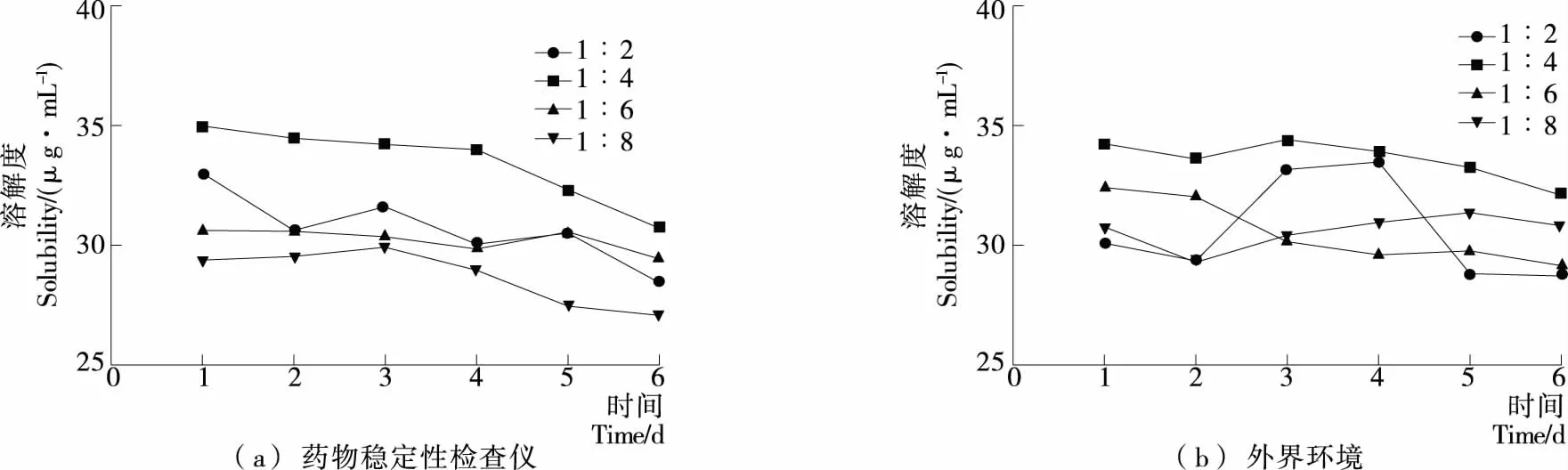
图6 绿原酸-PEG4000固体分散体稳定性试验结果Figure 6 Chlorogenic acid-PEG4000solid dispersion stability tests
2.4 扫描电镜观察结果
图7给出了绿原酸-PVPK30固体分散体表面和晶体结构的电镜照片,固体分散体中没有明显的晶体存在,表明制备的固体分散体中药物以无定形形式均匀地分散在PVPK30载体中,这是由于PVPK30在旋转蒸发的过程中黏度逐渐增大,抑制了绿原酸晶体的生长,所以晶体以无定形的形态存在于载体材料中。图7显示,固体分散体的表面有很多小孔,可能是由溶剂法制备固体分散体时乙醇蒸发造成的。正是这些小孔的存在,增加了绿原酸固体分散体的表面积,有利于药物的溶出[23]。蒲公英绿原酸固体分散体中溶解度和累计溶出度的增加,可能是PVPK30属于无定形高分子聚合物在溶液中呈现网状的结构与药物共蒸发溶剂,由于氢键或络合作用形成固体桥,阻滞了蒲公英绿原酸聚集结晶,使药物形成非结晶型无定形物,从而提高其溶解度和溶出度[24-26]。

A、B:绿原酸-PVPK30固体分散体1∶4(质量比)扫描尺寸1 μm×1 μm C、D:绿原酸-PVPK30固体分散体1∶4(质量比)扫描尺寸2 μm×2 μm图7 电镜扫描图Figure 7 SEM photos of Chlorogenic acid-PVPK30 solid dispersion
3 结论
研究表明,绿原酸固体分散体及物理混合物的溶解度、累计溶出度与原料药相比均有较显著差异。PEG4000、PVPK30为高分子药用载体均可以有效增加绿原酸体外溶出度,提高溶解度并且有效提高制剂的稳定性,尤以质量比1∶4 的绿原酸-PVPK30固体分散体更佳。
绿原酸-PVPK30的固体分散体显著改善绿原酸溶出和提高绿原酸稳定性的机制:① 绿原酸在固体分散体中以无定型形式存在,从而显著增加其与溶液接触的比表面积,提高其溶解度;② 绿原酸部分可与PVPK30分子形成氢键以无定型状态进入 PVP中,同时氢键也可增加PVP的溶水性,达到难溶的绿原酸分子通过氢键分散于 PVP中使其变得易解[19];③ PVP能置换绿原酸表面的H2O和OH-,通过共价键和氢键吸附在绿原酸分子表面,产生的吸附降低了表面自由能,防止绿原酸分子积聚,从而稳定分散在PVP中。
综上所述,通过绿原酸-PVPK30固体分散体解决了绿原酸稳定性差、溶出度差等难题, 同时不影响绿原酸结构中的功能基团酚羟基,对于其在食品杀菌、保鲜和抗氧化中的应用具有显著性意义。
[1] WEI Yun, GAO Ya-li, XIE Qian-qian, et al. Isolation of chlorogenic acid fromFlaveriabidentis(L.) Kuntze by CCC and synthesis of chlorogenic acid-intercalated layered double hydroxide[J]. Chro-matographia, 2011, 73(1): 97-102.
[2] WANG Zhi-hua, LI Xiao-liang, ZHEN Sai-jing, et al. The important role of quinic acid in the formation of phenolic compounds from pyrolysis of chlorogenic acid[J]. J Therm Anal Calorim, 2013, 114: 1 231-1 238.
[3] 向福, 刘亮, 秦婷, 等. 罗田金银花叶中绿原酸的提取工艺改进[J]. 食品与机械, 2013, 29(6): 150-152, 196.
[4] 山永凯. 枸杞中绿原酸的提取工艺研究[J]. 食品与机械, 2012, 28(5): 127-130.
[5] 国家医药管理局中草药情报中心站. 植物药有效成分手册[M]. 北京: 人民卫生出版社, 1986: 209-210.
[6] 时军, 翟李翔, 许维桐. 白芷提取物对绿原酸肠吸收的影响[J]. 中成药, 2016, 38(11): 2 355-2 359.
[7] 祁雯, 施斌, 黄雄伟, 等. 熊果酸共晶固体分散体的体外特性研究[J]. 中草药, 2013, 44(20): 2 845-2 851.
[8] PARK Y J, LEE H K, IM Y B, et al. Improved pH-independent dissolution and oral absorption of valsartan via the preparation of solid dispersion[J]. Archives of Pharmacal Research, 2010, 33 (8): 1 235-1 240.
[9] QIU Ming-feng, WEI Jia, LI Shao-shun, et al. A new silymarin preparation based on solid dispersion technique[J]. Adv Ther, 2005, 22(6): 595-600.
[10] URBANETZ N A, LIPPOLD B C. Solid dispersions of nimodipine and polyethylene glycol2000: Dissolution properties and physico-chemical characterization[J]. Eur J Pharm Biopharm, 2005, 59(1): 107-118.
[11] WASFY M, OBEIDA T, AL-SAYED A, et al. Erratum to: Evaluation of tadalafil nanosuspensions and their PEG solid dispersion matrices for enhancing its dissolution properties[J]. Pharm Tech, 2014, 15(3): 802-807.
[12] TARO Kojima, KENJIROU Higashi, TOYOFUMI Suzuki, et al. Erratum to: Stabilization of a super saturated solution of mefenamic acid from a solid dispersion with EUDRAGIT®EPO[J]. Pharm Res, 2012, 29: 1 419.
[13] HAO Hai-jun, JIA You-zhi, ZHANG Hong-qin, et al. Preparation of monolithic osmotic tablet of quercetin loaded by solid dispersion[J]. Chin Pharm, 2015, 24(6): 383-392.
[14] 赵安权, 王倩倩, 李佳, 等. 绿原酸磷脂复合物固体分散体的体外溶出和药动学研究[J]. 中国测试, 2015, 41(1): 54-57.
[15] 王雪梅, 蒋丽, 袁红江, 等. 金银花中绿原酸提取浓缩工艺[J]. 重庆理工大学学报, 2011, 25(3): 47-50.
[16] 韩刚, 阎林奇, 索炜, 等. 大黄素固体分散体的制备及其溶出度测定[J]. 中草药, 2011, 42(3): 487-490.
[17] 高振珅, 张晓丽, 王建夺. 姜黄素固体分散体与包合物的制备及其性能研究[J]. 中药材, 2011, 34(11): 1 784-1 788.
[18] 焦艳, 任红暖, 袁堂娟, 等. 白藜芦醇固体分散体的制备及其性质研究[J]. 中药材, 2014, 37(3): 517-520.
[19] 陈雅芬, 刘永红, 刘永琼, 等. 癸氧喹酯固体分散体的稳定性分析[J]. 武汉工程大学学报, 2010, 32(12): 19-22.
[20] 许东晖, 王胜, 梅雪婷, 等. 聚乙烯吡咯烷酮K30对姜黄素的增溶作用研究[J]. 中药材, 2008(3): 438-442.
[21] 王康, 赵彤, 何志敏. 穿心莲内酯固体分散体的制备及体外溶出实验[J]. 中国现代应用药学杂志, 2009, 26(8): 638-641.
[22] 陈国广, 张柯萍, 李学明, 等. 灯盏花素缓释固体分散体的制备及溶出度的研究[J]. 华西药学杂志, 2007, 22(2): 169-171.
[23] 王敏, 王淑君, 侯巍. 杨梅素固体分散体的制备以及体外溶出试验[J]. 实用药物与临床, 2012, 15(5): 281-283.
[24] 孙彩霞, 尹蓉莉, 赵俊霞, 等. 水蜈蚣总黄酮固体分散体的制备及其性质研究[J]. 中草药, 2014, 45(14): 2 018-2 021.
[25] 潘菲, 王昆, 李琳玉, 等. 大黄酚固体分散体在大鼠体内药动学研究[J]. 中国实验方剂学杂志, 2015, 21(10): 91-93.
[26] 陈小云, 张振海, 郁丹红, 等. 丹参酮组分缓释固体分散体的研究[J]. 中草药, 2013, 44(17): 2 391-2 396.

