茯苓多糖对急性胰腺炎大鼠肠道屏障功能损伤和炎性反应的作用
石振国,苏锦,任永乐,白筱晞
(榆林市府谷县人民医院普通外科,陕西 榆林 719499)
茯苓多糖对急性胰腺炎大鼠肠道屏障功能损伤和炎性反应的作用
石振国,苏锦,任永乐,白筱晞
(榆林市府谷县人民医院普通外科,陕西 榆林 719499)
目的 探究茯苓多糖对急性胰腺炎(AP)大鼠肠道屏障功能损伤和炎性反应的作用。方法将60只大鼠随机分为假手术组、AP组、AP+低剂量茯苓多糖组、AP+中剂量茯苓多糖组和AP+高剂量茯苓多糖组,每组12只。AP组大鼠腹腔注射50 g/kg雨蛙素,给药组在AP组大鼠造模前分别灌胃给予50 mg/kg、100 mg/kg、200 mg/kg茯苓多糖。模型构建12 h后,检测大鼠腹水量、血清淀粉酶和脂肪酶含量;检测大鼠小肠黏膜厚度、绒毛高度和病理学评分;RT-PCR检测肿瘤坏死因子α(TNF-α)水平,ELISA检测TNF-α、白介素-1β(IL-1β)、IL-6水平;Western blot检测JAK2和STAT3的表达。结果实验发现,与AP组相比,AP+低剂量茯苓多糖组、AP+中剂量茯苓多糖组和AP+高剂量茯苓多糖组茯苓多糖均可显著减少AP大鼠腹水量、血清淀粉酶和脂肪酶含量;增加小肠黏膜厚度和绒毛高度,减少上皮损伤;降低TNF-α,IL-1β和IL-6水平;抑制JAK2,STAT3蛋白磷酸化;且以上作用均呈现明显量效关系。结论茯苓多糖可减轻AP大鼠肠道屏障功能损伤和炎性反应,且可能与抑制JAK2/STAT3通路相关。
茯苓多糖;急性胰腺炎;肠道屏障功能;炎性反应;JAK2/STAT3
急性胰腺炎(acute pancreatitis,AP)作为临床常见的急腹症之一,其本质是全身炎症反应综合征[1]。目前急性胰腺炎的发病机制尚无定论,但多数与肠黏膜屏障破坏引起的细菌易位相关[2],因此,加强肠道屏障功能的保护和抑制炎性反应是急性胰腺炎治疗的核心和关键[3]。茯苓[Poria cocos(Schw.)Wolf]为多孔菌科卧菌属真菌的干燥菌核,是一种常用的传统中药[4]。茯苓多糖(pachymaran)作为其主要有效成分,占茯苓干重的70%~90%,由线型β(1~3)-D-葡聚糖构成[5]。早期研究表明,茯苓多糖具有显著的增强免疫和抗肿瘤作用,近来被证实,茯苓多糖也具有一定的抗炎效果[6]。本文构建AP大鼠模型,探究茯苓多糖对AP大鼠肠道屏障功能损伤和炎性反应的影响及可能的作用机制,为其在临床上治疗AP提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD大鼠60只,6~8周,体质量(200±20)g,由西安交通大学医学院实验动物中心提供。
1.1.2 实验试剂 茯苓多糖购于宁波德康生物制品有限公司;雨蛙素购于美国Sigma公司;血清淀粉酶、脂肪酶试剂盒购于南京建成有限公司;肿瘤坏死因子α(TNF-α),白介素-1β(IL-1β)和IL-6试剂盒购于江苏晶美生物科技公司;RNA提取和PCR扩增试剂盒购于日本Takara公司;所用抗体均购于英国Abcam公司。
1.2 方法
1.2.1 动物分组和模型制备 将60只SD大鼠随机分为假手术组、AP组、AP+低剂量茯苓多糖组、AP+中剂量茯苓多糖组、AP+高剂量茯苓多糖组,每组12只。实验前给予动物充足的饲料和水,12 h灯光/12 h黑暗环境下适应一周。假手术组大鼠开腹后仅翻动肠管和胆胰管,不做其他处理。大鼠进行诱导前12 h禁食水。AP组大鼠腹腔注射50 g/kg雨蛙素,连续7次,每次间隔1 h。给药组即在AP组大鼠造模前连续两周分别灌胃给予50 mg/kg、100 mg/kg、200 mg/kg茯苓多糖。各组大鼠在处理完成后12 h分别取材。
1.2.2 检测大鼠的腹水量、血清淀粉酶和脂肪酶 10%水合氯醛麻醉各组大鼠,打开胸腔和腹腔,用干棉球吸附大鼠腹水,电子天平分别记录干棉球重量(干重,mg)及汲取腹水之后的重量(湿重,mg),计算腹水量(mg)=湿重-干重。收集大鼠腹部主动脉血液,待血液凝固后离心获得血清样本。分别用血清淀粉酶试剂盒和脂肪酶试剂盒检测血清淀粉酶和脂肪酶含量。
1.2.3 检测大鼠小肠黏膜厚度、绒毛高度和上皮损伤指数 取大鼠距幽门10 cm处小肠,甲醛固定后进行光镜检查,测定小肠绒毛高度及黏膜厚度,并且进行病理学评分。
1.2.4 RT-PCR检测TNF-α水平 取胰腺组织总RNA,采用RT-PCR试剂盒检测A水平,TNF-α的引物序列为:上游:5'-CCTGCTGACGGGTTTACCT-3',下游:5'-ATGGCAGACAGGATGTTGACC-3',扩增产物长度为159 bp。
1.2.5 ELISA检测TNF-α、IL-1β和IL-6水平 采用ELISA试剂盒检测血清中炎性因子TNF-α、IL-1β和IL-6水平。
1.2.6 Western blot检测JAK2/STAT3通路蛋白磷酸化水平 提取胰腺组织蛋白,采用BCA法进行蛋白定量,进行SDS-PAGE凝胶电泳,再将蛋白转移至膜上,5%脱脂奶粉室温封闭1 h,分别加入一抗为鼠抗人的JAK2,p-JAK2、STAT3和p-STAT3(稀释比例均为1:1 000),4℃孵育过夜。TBST洗涤3次。加入HRP标记的兔抗鼠二抗(1:10 000)37℃孵育45 min,TBST洗涤3次,利用ECL液显影检测。
1.3 统计学方法 应用SPSS10.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,多组计量数据间比较采用ANOVA分析,两组间比较采用独立样本t检验,以P<0.01为差异有统计学意义。
2 结果
2.1 茯苓多糖对AP大鼠腹水量、血清淀粉酶和脂肪酶的影响 与假手术组相比,AP组大鼠腹水量、淀粉酶、脂肪酶显著增多(P<0.01)。与AP组相比,给予不同剂量茯苓多糖AP组大鼠的腹水量、淀粉酶、脂肪酶呈现剂量依赖性下调,给予高剂量茯苓多糖AP组的下调效果最显著(P<0.01),见表1。
2.2 茯苓多糖对AP大鼠小肠黏膜厚度、绒毛高度以及上皮损伤指数的影响 与假手术组相比,AP组大鼠小肠黏膜厚度和绒毛高度显著降低,上皮损伤指数显著升高(P<0.01)。与AP组相比,给予不同剂量茯苓多糖AP组大鼠的小肠黏膜厚度和绒毛高度显著升高,上皮损伤指数显著降低,其作用呈明显的量效关系(P<0.01),见表2。
表1 茯苓多糖对AP大鼠腹水量、淀粉酶和脂肪酶的影响(±s)

表1 茯苓多糖对AP大鼠腹水量、淀粉酶和脂肪酶的影响(±s)
注:与假手术组比较,aP<0.01;与AP组比较,bP<0.01。
组别假手术组(n=12) AP组(n=12) AP+低剂量茯苓多糖组(n=12) AP+中剂量茯苓多糖组(n=12) AP+高剂量茯苓多糖组(n=12) F值P值脂肪酶(U/L) 6072.45±550.24 12341.52±402.56a11036.23±321.09 9566.41±259.45ab8070.70±408.52ab28.78 0.00腹水量(mL) 0.90±0.53 2.36±0.55a2.10±0.88 1.75±0.53ab1.44±0.62ab13.74 0.00淀粉酶(U/L) 2241.20±109.45 6852.40±335.78a5969.45±268.47 4772.13±440.21ab3407.40±288.42ab687 0.00
表2 茯苓多糖对AP大鼠小肠黏膜厚度、绒毛高度以及上皮损伤指数的影响(±s)

表2 茯苓多糖对AP大鼠小肠黏膜厚度、绒毛高度以及上皮损伤指数的影响(±s)
注:与假手术组比较,aP<0.01;与AP组比较,bP<0.01。
组别假手术组(n=12) AP组(n=12) AP+低剂量茯苓多糖组(n=12) AP+中剂量茯苓多糖组(n=12) AP+高剂量茯苓多糖组(n=12) F值P值小肠黏膜厚度(µm) 687.16±20.66 385.44±20.72a400.12±21.17 432.72±20.60ab510.62±21.52ab25.78 0.00绒毛高度(µm) 447.32±24.16 185.42±24.33a227.45±26.73 259.43±27.70ab333.50±24.15ab19.48 0.00上皮损伤指数0.75±0.14 5.53±0.22a4.90±0.17 3.86±0.19ab2.85±0.17ab78.51 0.00
2.3 茯苓多糖对AP大鼠TNF-α、IL-1β和IL-6的影响 与假手术组比较,AP组大鼠胰腺组织TNF-α mRNA水平和血清中TNF-α、IL-1β和IL-6水平均显著升高(P<0.01)。与AP组比较,给予不同剂量茯苓多糖AP组大鼠胰腺组织TNF-α mRNA水平和血清中TNF-α、IL-1β和IL-6水平均剂量依赖性显著降低,给予高剂量茯苓多糖AP组的下调效果最显著(P<0.01),见表3。
表3 茯苓多糖对AP大鼠炎性反应指标的影响(±s)
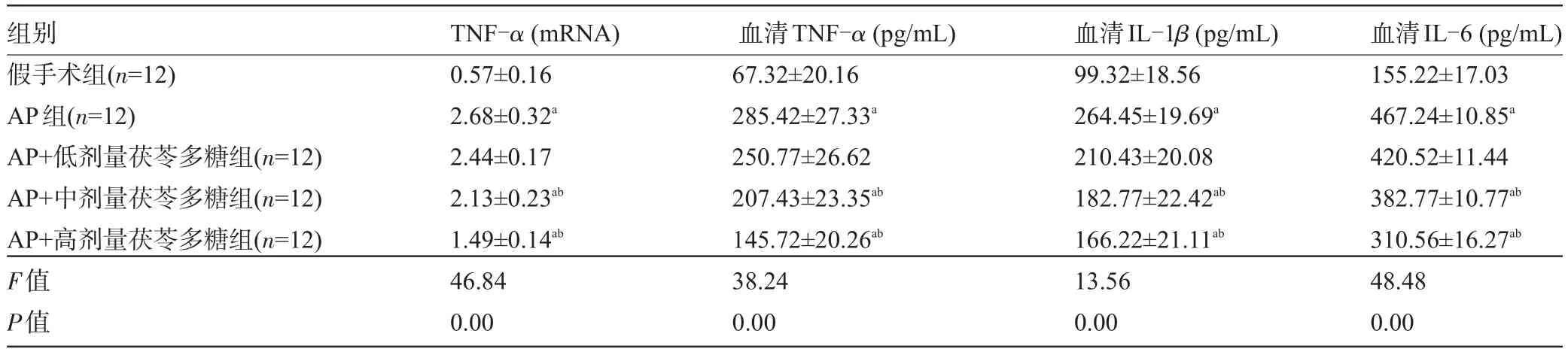
表3 茯苓多糖对AP大鼠炎性反应指标的影响(±s)
注:a与假手术组比较,P<0.01;b与AP组相比较,P<0.01。
组别假手术组(n=12) AP组(n=12) AP+低剂量茯苓多糖组(n=12) AP+中剂量茯苓多糖组(n=12) AP+高剂量茯苓多糖组(n=12) F值P值血清IL-6(pg/mL) 155.22±17.03 467.24±10.85a420.52±11.44 382.77±10.77ab310.56±16.27ab48.48 0.00 TNF-α(mRNA) 0.57±0.16 2.68±0.32a2.44±0.17 2.13±0.23ab1.49±0.14ab46.84 0.00血清TNF-α(pg/mL) 67.32±20.16 285.42±27.33a250.77±26.62 207.43±23.35ab145.72±20.26ab38.24 0.00血清IL-1β(pg/mL) 99.32±18.56 264.45±19.69a210.43±20.08 182.77±22.42ab166.22±21.11ab13.56 0.00
2.4 茯苓多糖对AP大鼠JAK2/STAT3信号通路的影响 与假手术组比较,AP组大鼠胰腺组织JAK2和STAT3磷酸化水平均显著升高,差异有显著统计学意义(P<0.01)。与AP组比较,给予不同剂量茯苓多糖AP组大鼠JAK2和STAT3磷酸化水平均剂量依赖性显著降低,给予高剂量茯苓多糖AP组的抑制效果最显著,差异有显著统计学意义(P<0.01),见图1和表4。

图1 茯苓多糖对AP大鼠JAK2/STAT3信号通路蛋白的影响
表4 茯苓多糖对AP大鼠JAK2/STAT3信号通路蛋白磷酸化水平的影响(±s)

表4 茯苓多糖对AP大鼠JAK2/STAT3信号通路蛋白磷酸化水平的影响(±s)
注:a与假手术组相比较,P<0.01;b与AP组比较,P<0.01。
p-STAT3 0.43±0.13 1.24±0.27a1.17±0.28 1.03±0.28ab0.82±0.15ab19.49 0.00组别假手术组(n=12) AP组(n=12) AP+低剂量茯苓多糖组(n=12) AP+中剂量茯苓多糖组(n=12) AP+高剂量茯苓多糖组(n=12) F值P值p-JAK2 0.55±0.07 1.74±0.13a1.49±0.13 1.23±0.16ab1.06±0.27ab17.26 0.00
3 讨 论
AP的病理生理过程复杂,具有发病急、并发症多、预后差的特点,尤其是并发细菌感染后死亡率较高[3]。因此,寻找新型有效的药物对临床AP的治疗具有重要意义。在桃仁提取物、姜黄素、细菌脂多糖等对AP的诊断研究中,腹水量、血清淀粉酶和脂肪酶等常用检测指标均明显降低[3,7-8]。本文研究表明,茯苓多糖均可剂量依赖性减少AP大鼠腹水量,降低血清淀粉酶和脂肪酶,高剂量的茯苓多糖作用效果最显著,初步确定了茯苓多糖对缓解大鼠AP具有一定的作用。AP患者肠道黏膜缺血、缺氧可以导致肠黏膜上皮损伤,肠通透性增加,而当肠黏膜通道增高到一定程度时,细菌和内毒素可穿过肠黏膜进入组织,导致肠源性感染,甚至诱发败血症和器官多功能障碍综合征[3,9-10]。因此,肠黏膜屏障高通透性导致的肠道细菌和内毒素的易位是AP高致死率的主要原因,而维持AP患者肠道黏膜结构和功能的稳定显得尤为重要[3,11-12]。已有研究证实,中药柴芍承气汤可有效增加重症胰腺炎(SAP)的肠绒毛高度和黏膜厚度,在SAP早期使用可对肠黏膜屏障起到保护作用[13]。生长抑素和大黄附子汤也可通过增加长绒毛高度和黏膜厚度减轻坏死性胰腺炎(ANP)对大鼠肠道屏障的损伤[14-15]。本文研究表明,茯苓多糖均可剂量依赖性增加AP大鼠小肠黏膜厚度和绒毛高度,降低上皮损伤指数,且高剂量的茯苓多糖作用效果最显著,此结果证实了茯苓多糖可有效缓解AP大鼠肠道屏障损伤。
AP发病机制复杂,除肠道屏障损伤外,炎症介质的大量释放是其病理生理过程发展的关键因素[16]。而炎性因子的释放与肠道屏障损伤也有密切联系。AP患者的胰腺局部炎症可触发并激活炎症细胞产生一系列炎性介质和促炎因子,包括TNF-α,IL-1β和IL-6等,而这些促炎症细胞因子反过来进一步激活炎症细胞,从而引起正反馈式的“炎症级联瀑布反应”,导致微循环障碍,且进一步加重肠黏膜屏障损伤[17]。在AP早期,血必净可降低大鼠血清TNF-α、IL-1β和IL-6浓度,被认为是其治疗AP可能的作用机制之一[1]。本文研究表明,茯苓多糖可剂量依赖性减少AP大鼠血清TNF-α、IL-1β和IL-6水平,缓解AP级联反应中的炎症反应程度,降低局部胰腺组织损伤,有助于AP的早期恢复。
进一步研究发现,酪氨酸蛋白激酶/信号转导与转录激活因子(JAK/STAT)通路与AP的发生发展密不可分[18-19]。TNF-α、IL-1β和IL-6是通过活化JAK2/ STAT3通路进行转导,从炎性层面加重胰腺的病理损伤[20]。又发现在AP中,高迁移率蛋白B1(HMGB1)能增加大鼠胰腺腺泡细胞JAK2,STAT3,TNF-α和IL-1的mRNA和蛋白表达,提示HMGB1可能是通过诱导JAK/STAT通路活化来加重AP[18]。本研究表明,茯苓多糖均可剂量依赖性抑制AP大鼠JAK2和STAT3的磷酸化,高剂量茯苓多糖抑制效果尤为显著,此结果提示,茯苓多糖可能通过抑制JAK2/STAT3通路缓解AP大鼠肠道屏障和炎性反应等病理损伤。
本研究证实了茯苓多糖可减小AP大鼠肠道黏膜屏障损伤和炎性反应,且其机制可能与抑制JAK2/ STAT3通路相关,对茯苓多糖的研究开发具有重大意义,并开拓了AP治疗的新思路。
[1]徐伟松,范辉,刘玉峰,等.血必净对急性胰腺炎大鼠血清中TNF-α,IL-1β和IL-6浓度的影响[J].世界华人消化杂志,2012,20 (29):2777-2781.
[2]蔡笃雄,陈卫昌,曾仕平,等.乙酰半胱氨酸及氢化可的松对重症急性胰腺炎治疗作用的实验研究[J].重庆医学,2010,39(2):137-139.
[3]王桂华,兰涛,吴向军,等.桃仁提取物对急性胰腺炎大鼠肠道屏障功能及炎性反应的影响[J].中药材,2014,37(12):2267-2270.
[4]游昕,熊大国,郭志斌,等.茯苓多种化学成分及药理作用的研究进展[J].安徽农业科学,2015,43(2):106-109.
[5]王青,胡明华,董燕,等.茯苓多糖对免疫抑制小鼠粘膜淋巴组织及脾脏中CD3+和CD19+细胞变化的影响[J].中国免疫学杂志,2011, 27(3):228-231.
[6]曹颖.茯苓多糖药理作用的研究[J].中国现代药物应用,2013,7 (13):217-218.
[7]于文光,许刚,任桂杰,等.姜黄素对小鼠实验性急性坏死性胰腺炎的抑制作用[J].山东大学学报(医学版),2009,47(8):25-28.
[8]张迎媚,薛东波,王海洋,等.细菌脂多糖对急性胰腺炎大鼠核因子-κB及肿瘤坏死因子的影响[J].中华医院感染学杂志,2005,15 (7):747-750.
[9]Tang ZF,Ling YB,Lin N,et al.Glutamine and recombinant human growth hormone protect intestinal barrier function following portal hypertension surgery[J].World J Gastroenterol,2007,13(15): 2223-2228.
[10]侯斐,刘瑞霞,阴赪宏.急性胰腺炎微循环障碍的发生机制及其治疗进展[J].临床肝胆病杂志,2014,30(8):815-818.
[11]陈健,齐菲,王磊,等.急性胰腺炎患者肠黏膜屏障功能损害的相关性[J].世界华人消化杂志,2014,22(33):5063-5068.
[12]仓晓凤,万荣.急性胰腺炎肠屏障功能障碍研究及治疗进展[J].现代消化及介入诊疗,2013,18(4):260-262.
[13]黄旻,吴小翎.柴芍承气汤对大鼠重症胰腺炎肠道屏障功能的影响[J].疑难病杂志,2008,7(10):588-590.
[14]金纯,洪伟,殷宝兵,等.生长抑素对大鼠坏死性胰腺炎GH-IGF-1-白蛋白轴的影响及其对肠黏膜屏障的保护作用[J].肝胆胰外科杂志,2004,16(2):97-99.
[15]路小光,战丽彬,康新,等.大黄附子汤对急性坏死性胰腺炎大鼠小肠黏膜屏障功能的保护作用[J].中华胰腺病杂志,2011,11(2): 113-116.
[16]杨卫振,脱红芳,彭彦辉.急性胰腺炎治疗新靶点的研究进展[J].山东医药,2013,52(40):99-101.
[17]Chi DZ,Chen J,Huang DP.Influence of interleukin-1β and interleukin-6 gene polymorphisms on the development of acute pancreatitis [J].Genet Mol Res,2015,14(1):975-980.
[18]陈杏苑,杨元生,陈垦,等.JAK-STAT细胞信号转导通路与急性胰腺炎关系的研究进展[J].世界华人消化杂志,2015,23(6):932-937.
[19]Yu JH,Kim H.Role of janus kinase/signal transducers and activators of transcription in the pathogenesis of pancreatitis and pancreatic cancer[J].Gut Liver,2012,6(4):417-422.
[20]王国良,兑丹华.JAK/STAT信号转导通路在重症急性胰腺炎中的研究进展[J].中国普外基础与临床杂志,2015,22(1):45-49.
Effects of pachymaran on intestinal barrier function damage and inflammation in rats with acute pancreatitis.
SHI Zhen-guo,SU Jin,REN Yong-le,BAI Xiao-xi.Department of General Surgery,Fugu People's Hospital,Yulin 719499, Shaanxi,CHINA
ObjectiveTo explore the effects of pachymaran on intestinal barrier function damage and inflammation in rats with acute pancreatitis.MethodsSixty rats were randomly divided into 5 groups including the sham group,AP group,low-dose pachymaran group,medium-dose pachymaran group and high-dose pachymaran group,with twelve rats in each group.AP group rats received intraperitoneal injection of 50 mg/kg cerulein.The low-dose,medium-dose and high-dose pachymaran group were given intragastric administration of 50 mg/kg,100 mg/kg and 200 mg/kg pachymaran respectively before model construction of AP group.After twelve hours,the contents of the ascitic fluid,amylase and lipase were detected in rats with AP.The small intestinal mucosal thickness,villus height and epithelial damage index were detected in rats with AP.The levels of tumor necrosis factor α(TNF-α)were determined by RT-PCR, and the TNF-α,interleukins-1β(IL-1β)and IL-6 levels were determined by ELISA.The expressions of JAK2 and STAT3 proteins were determined by western blot.ResultsCompared to the AP group,different doses of pachymaran (low-dose,medium-dose and high-dose pachymaran group)reduced the contents of ascitic fluid,amylase and lipase,elevated the small intestinal mucosal thickness and villus height,reduced the epithelial damage index,decreased the levels of TNF-α,IL-1β and IL-6,and inhibited the expression of p-JAK2 and p-STAT3,all in a dose-dependent manner(P<0.01).ConclusionPachymaran ameliorates the intestinal barrier function damage and inflammation in rats with AP, which may be associated with the inhibition of JAK2/STAT3 pathway.
Pachymaran;Acute pancreatitis;Intestinal barrier function;Inflammation;JAK2/STAT3
R-332
A
1003—6350(2017)03—0356—04
10.3969/j.issn.1003-6350.2017.03.004
2016-06-30)
石振国。E-mail:lijieyulin@163.com

