白藜芦醇对脑缺血大鼠突触可塑性的影响
李华钢,饶艳,聂华
(武汉大学中南医院神经内科,湖北 武汉 430071)
白藜芦醇对脑缺血大鼠突触可塑性的影响
李华钢,饶艳,聂华
(武汉大学中南医院神经内科,湖北 武汉 430071)
目的 探究白藜芦醇对脑缺血大鼠突触可塑性的影响。方法60只雄性Wistar大鼠采用数字随机法随机分为假手术组(Sham,n=15),脑缺血大鼠模型组(CCH,n=15),给予40 mg/kg白藜芦醇预处理四周的脑缺血大鼠模型组(CCH+Resveratrol,n=15)以及白藜芦醇处理组(Resveratrol,n=15)。采用莫里斯水迷宫检测大鼠空间感知能力和记忆能力;透射电子显微镜下测量神经元突触界面结构参数;高尔基体染色法检测齿状回区树突刺的形态学变化;Western blot检测突触相关蛋白的表达情况。结果CCH组大鼠逃脱时间长于Sham组(P<0.05)。CCH+ Resveratrol白藜芦醇预处理缺血组逃脱时间与CCH组相比显著降低(P<0.05),但是与假手术组和白藜芦醇组比较差异无统计学意义(P>0.05)。CCH组大鼠突触界面曲率、突触活性区长度以PSD厚度显著低于Sham组(P<0.05),且突触间隙宽度显著高于Sham组(P<0.05),白藜芦醇处理后大鼠突触界面参数恢复正常。CCH组大鼠树突刺和蘑菇状刺与Sham组相比显著减少(P<0.05),CCH+Resveratrol组减少量明显下降。在CCH组脑缺血大鼠中的PSD95、PSD93、NR2A/B三类蛋白水平显著下降,而通过白藜芦醇预处理可以部分改善这一现象。结论白藜芦醇预处理的脑缺血大鼠在功能以及结构方面有效的恢复了其突触可塑性,而突触相关蛋白的表达在白藜芦醇介导的脑缺血大鼠模型的神经元保护作用中起到关键作用。
血管性痴呆;白藜芦醇;突触可塑性;树突刺
血管性痴呆(vascular dementia,VD)是继阿尔茨海默病(Alzheimer's disease,AD)之后在老年人群中又一比较常见的痴呆型疾病[1]。在全世界确诊的痴呆病例中有约20%是血管型痴呆[2]。突触的可塑性是指突触的形态和功能可发生较为持久改变的特性或现象。突触可塑性主要包括短期突触可塑性(short-term synaptic plasticity,STSP)与长期突触可塑性(long-term synaptic plasticity,LTSP)。短期突触可塑性主要包括易化、抑制以及增强。长期突触可塑性主要表现形式为长时程增强(long-term potentiation,LTP)和长时程抑制(long-term depression,LTD),这两者已被公认为是学习及记忆活动的生物学基础。大量的研究证明,痴呆型大鼠的突触可塑性已被严重损害[3]。因此,保护突触可塑性是治疗记忆衰退行之有效的方法。先前的研究已经发现,双侧颈总动脉结扎会引起大脑皮层和海马体中神经元的缺失和损害,进而影响大鼠的认知能力[4-5]。鉴于此,大鼠脑缺血模型(chronic cerebral hypoperfusion,CCH)在血管性痴呆模型中广泛使用[6]。
白藜芦醇[(E)-3,5,4-三羟基二苯乙烯]是一种来源于葡萄、蓝莓、草莓、桑葚等植物的芪类化合物,它是一种抗毒素,主要功能是防御细菌和真菌对植物的伤害[7]。已有研究证明,白藜芦醇在增加寿命以及延缓衰老方面具有很多有益的作用[8]。在神经系统当中,白藜芦醇的保护机制已有广泛研究。例如,白藜芦醇抑制组蛋白去乙酰化酶激活后对轴突的损害,减弱体外蛋白激酶激活后所导致的多肽诱导性神经元损伤效应,而且在线虫和哺乳动物神经元中可以缓解由于多聚谷氨酰胺所致的细胞毒性[9-10]。在沙鼠脑缺血性损伤模型试验中,白藜芦醇同样可以降低由于非化学因素所导致的神经元细胞死亡率,这样的结果也可进一步说明白藜芦醇在由于血管因素所引起的脑损伤中的保护作用。然而,在脑缺血大鼠模型试验中,白藜芦醇是否对突触可塑性具有保护作用仍不清楚。
本研究通过白藜芦醇预处理脑缺血大鼠,以大鼠空间辨识能力和记忆力、神经元突触界面参数、树突刺形态学变化以及突触相关蛋白的表达水平为指标,探究白藜芦醇对脑缺血大鼠突触可塑性的影响。
1 材料与方法
1.1 实验动物 60只雄性维斯塔(Wistar)大鼠[(200±10)g]购买自湖北省疾病预防与控制中心。所有动物试验均依据“神经系统科学研究中对动物及人类的使用政策”进行。实验动物在实验室适应性饲养一周后开始使用。按照数字随机法将其随机分为四组:对照组(Sham,n=15),脑缺血大鼠模型组(CCH,n=15),给予40 mg/kg白藜芦醇预处理四周的脑缺血大鼠模型组(CCH+Resveratrol,n=15)以及白藜芦醇处理组(Resveratrol,n=15,只通过白藜芦醇预处理)。所有的大鼠置于22℃的聚丙烯笼子中,光照时间为8 am,均给予正常食物和水。
1.2 药物和抗体 白藜芦醇购买自Sigma-Aldrich公司并溶于二甲亚砜备用。抗体pAb PSD95(1:1 000)、pAb PSD93(1:1 000)、Syp(1:1 000)、pAb NR2B(1:1 000)均购自Bioworld科技有限公司(St.Louis Park,MN)。羊抗兔多克隆免疫球蛋白G(IgG)(1:10 000)以及羊抗鼠IgG(1:10 000)均购自拜力生物科技有限公司。
1.3 脑缺血大鼠模型建立 将大鼠双侧颈动脉结扎,得到脑缺血大鼠模型。使用10%的水合氯醛(350 mg/kg)麻醉大鼠,使用电热毯维持该大鼠体温在(37.0±0.2)°C。将金属线圈缠绕于双侧颈动脉,使其血流量保持在70%左右,控制整个过程在15 min之内完成。外科手术4周过后,对大鼠进行行为检测和生理生化指标检测。
1.4 水迷宫检测 水迷宫是一个直径150 cm、高50 cm的循环池。分为四个虚拟象限(NW、NE、SW和SE)并装满约20℃的水。通过水迷宫检测来考察动物的记忆能力。大鼠通过五周的训练过后,依据池外所提供的线索在西南(SW)象限找到一个低于水面1~2 cm的平台。在每次的实验中,给予大鼠60 s时间来找到隐藏的平台并使其在平台上停留30 s。直到大鼠离开平台实验结束。如果大鼠在60 s内未找到平台,实验员将其引导找到平台,但是该实验数据不需记录。最终的结果包括20次实验,4次/d,连续5 d。根据天数记录实验结果。通过游泳或潜水来找到平台都需在实验中记录。
1.5 电镜切片制作及突触界面结构参数测量 将经过多次漂洗组织块,依次经2%锇酸固定2 h、磷酸盐缓冲液(PBS)冲洗3次、乙醇逐级脱水(50%、70%、90%、100%)、Epon812环氧树脂包埋,超薄切片机(R型)切片,切片厚度约50 nm,醋酸铀、硝酸铅双重染色。在透射电子显微镜(日本,日立,H7500)下放大20 000倍并随机摄片,使用德国莱卡DM1000图像分析软件测量神经元突触的突触界面曲率(参照Jones等[11]的方法)、突触活性区长度与突触后致密物厚度(PSD)(参考Guldner[12]方法)、突触间隙宽度(用多点平均法测定)。
1.6 高尔基体染色法 将组织切片(约3 mm厚度)放入染色剂(5%水合氯醛、5%重铬酸钾、10%福尔马林)3 d。将切片放入1%的硝酸银中并真空保存4 d。使用振动切片机将脑组织切成厚度为50 μm的截面,用光学显微镜100倍物镜进行分析,树突刺的数量和蘑菇状树突所占的百分比。在每组实验中,每个动物(n=4)至少分析40个细胞。
1.7 Western blot 在显微镜下将大脑半球取出,并将海马体移出放入裂解液当中。匀浆后于10 000×g离心30 min,取上清进行蛋白免疫印迹实验分析。通过二辛可宁酸(bicinchonininc acid,BCA)试剂盒提取蛋白后进行浓度测量,之后添加10%的β-巯基乙醇和0.05%溴酚蓝,将混合物煮沸10 min。混合物中的蛋白质通过10%十二烷基磺酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE),之后转移到硝化纤维膜。此硝化纤维膜使用5%的脱脂棉封闭后使用抗体(PSD95、PSD93、NR2B、Syp)4℃过夜培养。24 h后,将膜清洗3次,室温二抗孵育2 h,使用双色红外荧光扫描成像系统(Odyssey Infrared Imaging System)取像以及柯达数字科学1D软件进行蛋白定量分析。
1.8 统计学方法 应用SPSS18.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,多组计量数据比较采用单因素方差分析(one-way ANOVA),均数的两两比较采用LSD法,以P<0.05表示差异有统计学意义。
2 结 果
2.1 白藜芦醇对脑缺血大鼠的记忆力与空间感知能力的影响 水迷宫检测结果如图1A所示,随着测量次数的增多所有大鼠的逃脱时间都显著下降,而且四组之间差异有统计学意义。从第三天开始,CCH组脑缺血大鼠的逃脱时间明显长于Sham组大鼠(P<0.05)。与CCH组相比,CCH+Resveratrol组大鼠的逃脱时间显著降低(P<0.05),但是与Sham组和Resveratrol组大鼠比较差异无统计学意义。在实验过程中大鼠的逃脱线路同样做了记录,发现Sham组的大鼠走直线并在20 s之内完成逃脱,找到平台,但是CCH组脑缺血大鼠至少需要40 s,其线路不是直线,而是随机的曲线(如图1B)。在整个实验过程中,大鼠的游泳速度没有明显差异。
2.2 大鼠突触界面结构变化 四组大鼠神经元突触界面结构参数测量结果如表1,CCH组大鼠突触界面曲率、突触活性区长度以PSD厚度显著低于Sham组,且突触间隙宽度显著高于Sham组。CCH+ Resveratrol组及Resveratrol组的活性区长度及PSD厚度显著高于CCH组(P<0.05),但与Sham组比较无显著性变化(P>0.05);突触间隙宽度显著低于CCH组 (P<0.05)。
2.3 齿状回区树突刺的形态学变化 高尔基体染色实验结果如图2所示。CCH组大鼠的树突刺和蘑菇状刺显著减少(P<0.05),而CCH+Resveratrol组大鼠树突刺减少量明显(P<0.05)。这些结果证明,白藜芦醇的预处理可以改变树突刺的形态。
2.4 白藜芦醇对突触相关蛋白表达的影响 通过Western blot检测PSD95、PSD93、NR2A/B以及海马体中的突触小泡蛋白(synaptophysin,Syp)的水平,我们发现,在CCH组大鼠中的PSD95、PSD93、NR2A/B三类蛋白水平显著下降,而通过白藜芦醇预处理可以部分改善这一现象(图3)。突触小泡蛋白的变化在四组中差异无统计学意义(P>0.05),因此我们推测白藜芦醇所致的蛋白水平的变化可能发生在突触前端。

图1 水迷宫中大鼠的逃脱时间和线路统计
表1 四组大鼠突触结构参数测量结果(±s)

表1 四组大鼠突触结构参数测量结果(±s)
注:a表示与假手术组比较,P<0.05;b表示与脑缺血组比较,P<0.05。
组别Sham组CCH组CCH+Resveratrol组Resveratrol组F值P值例数10 10 10 10突触界面曲率1.409 6±0.023 1 1.324 7±0.056 2a1.384 7±0.032 3 1.375 2±0.024 5 6.170 0.018活性区长度(nm) 378.92±18.67 243.57±15.43a354.62±21.47b346.97±16.72b7.610 0.010 PSD厚度(nm) 75.48±3.78 51.73±6.52a69.73±5.89b65.98±4.63b8.644 0.007突触间隙宽度(nm) 19.17±1.89 25.65±1.57a21.43±1.17b18.96±1.73b10.23 0.004
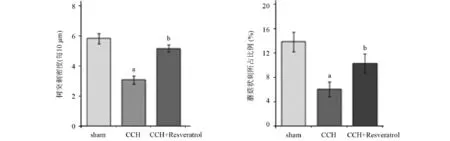
图2 树突刺的形态学改变

图3 海马体中突触相关蛋白的表达水平
3 讨 论
白藜芦醇对神经的保护作用与大量的生理过程相关,如减少线粒体的功能紊乱、降低氧化性损伤以及慢性炎症;改善血管功能;可以激活长时程增强基因如抗衰老酶的相关基因的表达。由于白藜芦醇可以很好的解决脑血液的供应,而且其在大脑中的活性持续时间长达4 h,因此它被广泛的使用在改善老年人记忆力的治疗中[13-14]。白藜芦醇通过激活脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在抑郁症的治疗中发挥重要作用[15]。有研究显示白藜芦醇可以抑制脑缺血大鼠空间感知能力以及记忆力的衰退[16]。本研究发现,CCH+Resveratrol组大鼠在水迷宫中的停留时间显著降低,且出逃路线也相对简单,表明白藜芦醇可以降低脑缺血对脑部认知功能的损伤。
本研究扩展了白藜芦醇对脑缺血大鼠突触不规则性的抑制作用,结果发现,白藜芦醇可以改善脑缺血大鼠的突触结构而且可以治疗恢复脑缺血对大鼠其树突刺的损害。树突刺作为树突能量的储存场所,它可以将信号传递给神经元细胞[17]。而树突刺由包括复杂的具有特异性物质组成,这些物质可以形成复杂的信号通路,并在突触前体中具有重要的作用,因此保护树突刺对保护突触可塑性具有重要作用。
本研究同样证明,白藜芦醇的治疗可以增加PSD95、PSD93、NR2A/B的蛋白表达水平,但是对突触小泡蛋白的表达无显著性影响。说明白藜芦醇可以通过调节突触前端蛋白水平的表达,修复脑缺血对突触的损伤。突触相关蛋白的表达与突触的结构和功能密切相关,是突触发挥信号传导功能的重要标志。研究早已证实,白藜芦醇能增强大鼠海马齿状回神经发生,改善认知功能障碍,增加神经细胞之间形成的突触联系增多[18-19]。本研究结果也表明,白藜芦醇可以通过上调PSD95、PSD93、NR2A/B的表达促进脑缺血大鼠神经突触的重塑。
突触可塑性是指突触结构在形态学上以及功能上的修饰作用,表现为在突触在一定条件下调整功能的调整、形态的改变形态和数目的增减增减数目的能力,包括突触结构的改变以及突触信号转导转到能力的改变[20]。本研究选取与突触形态结构和功能紧密相关的突触结构参数以及突触调节蛋白Syp、PSD95、PSD93和NR2A/B为观察指标,证实了白藜芦醇治疗可以修复脑缺血大鼠模型的突触损伤,增强突触可塑性。白藜芦醇治疗后脑缺血大鼠模型突触活性区长度和PSD厚度恢复正常值,表明白藜芦醇可以提高突触连接区面积,促进突触前后距离的缩短,提高信息传递效率,且PSD95、PSD93和NR2A/B的上调表达也在蛋白水平证实白藜芦醇的作用机制。总之,本研究证明了在脑缺血大鼠模型中白藜芦醇的潜在作用机制以及疗效,为血管性痴呆治疗提供了基础性的实验证据。
[1]Battistin L,Cagnin A.Vascular cognitive disorder.A biological and clinical overview [J].Neurochemical Research,2010,35(12): 1933-1938.
[2]Dubois MF,Hébert R.The incidence of vascular dementia in Canada: a comparison with Europe and East Asia[J].Neuroepidemiology, 2001,20(3):179-187.
[3]Yang HY,Liu Y,Xie JC,et al.Effects of repetitive transcranial magnetic stimulation on synaptic plasticity and apoptosis in vascular dementia rats[J].Behav Brain Res,2015,281(1):149-155.
[4]Ye X,Wang M,Zhang W,et al.RETRACTED:Neuronal damage, central cholinergic dysfunction and oxidative damage correlate with cognitive deficits in rats with chronic cerebral hypoperfusion[J]. Neurobiology of Learning&Memory,2013,109(3):7-19.
[5]Cechetti F,Pagnussat AS,Worm PV,et al.Chronic brain hypoperfusion causes early glial activation and neuronal death,and subsequent long-term memory impairment[J].Brain Research Bulletin,2012,87 (1):109-116.
[6]Ni JW,Ohta H,Matsumoto K,et al.Progressive cognitive impairment following chronic cerebral hypoperfusion induced by permanent occlusion of bilateral carotid arteries in rats[J].Brain Research, 1994,653(1-2):231-236.
[7]Kpl B,Kosmeder JW,Pezzuto JM,et al.Biological effects of resveratrol[J].Antioxidants&Redox Signaling,2002,3(6):1041-1064.
[8]Baur JA,Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nature Reviews Drug Discovery,2006,5(6):493-506.
[9]Han Y,Zheng W,Bastianetto S,et al.Neuroprotective effects of resveratrol against β-amyloid-induced neurotoxicity in rat hippocampal neurons:involvement of protein kinase C[J].British Journal of Pharmacology,2004,141(6):997-1005.
[10]Parker AJ,Arango M,Abderrahmane S,et al.Resveratrol rescues mu-tant polyglutamine cytotoxicity in nematode and mammalian neurons [J].Médecine Sciences M/S,2005,21(5):556-557.
[11]Jones DG,Devon RM.An ultrastructural study into the effects of pentobarbitone on synaptic organization[J].Brain Research,1978,147 (1):47-63.
[12]Güldner FH.Sexual dimorphisms of axo-spine synapses and postsynaptic density material in the suprachiasmatic nucleus of the rat[J]. Neuroscience Letters,1982,28(2):145-150.
[13]Wang Q,Xu J,Rottinghaus GE,et al.Resveratrol protects against global cerebral ischemic injury in gerbils[J].Brain Research,2002, 958(2):439-447.
[14]Witte AV,Kerti L,Margulies DS,et al.Effects of resveratrol on memory performance,hippocampal functional connectivity,and glucose metabolism in healthy older adults[J].Journal of Neuroscience, 2014,34(23):7862-7870.
[15]Hurley LL,Akinfiresoye L,Kalejaiye O,et al.Antidepressant effects of resveratrol in an animal model of depression[J].Behavioural Brain Research,2014,268(2):1-7.
[16]Anastácio JR,Netto CA,Castro CC,et al.Resveratrol treatment has neuroprotective effects and prevents cognitive impairment after chronic cerebral hypoperfusion[J].Neurological Research,2014,36 (7):627-633.
[17]Bourne JN,Harris KM.Balancing structure and function at hippocampal dendritic spines[J].Annual Review of Neuroscience,2008, 31(1):47-67.
[18]Murphy TH,Corbett D.Plasticity during stroke recovery:from synapse to behavior[J].Nature Reviews Neuroscience,2009,10(12): 861-872.
[19]Zhao J,Harada N,Kurihara H,et al.Cilostazol improves cognitive function in mice by increasing the production of insulin-like growth factor-I in the hippocampus[J].Journal of Pharmacology&Experimental Therapeutics,2011,330(1):2-12.
[20]Silva AJ.Molecular and cellular cognitive studies of the role of synaptic plasticity in memory[J].Journal of Neurobiology,2003,54(1): 224-237.
Effect of resveratrol on synaptic plasticity in cerebral ischemic rats.
LI Hua-gang,RAO Yan,NIE Hua.Department of Neurology,Zhongnan Hospital of Wuhan University,Wuhan 430071,Hubei,CHINA
ObjectiveTo investigated the influence of resveratrol on synaptic plasticity in cerebral ischemic rats.MethodsSixty male Wistar rats were randomly divided into 4 groups:a sham group(sham,n=15),a chronic cerebral hypoperfusion group(CCH,n=15),a CCH with resveratrol pretreatment for 4 weeks(CCH+resveratrol,n=15)and resveratrol administration group(resveratrol,n=15).The Morris water maze(MWM)test was used to assess the spatial memory of rats;transmission electron microscopy(SEM)was used to measure the neuron synaptic interface structure parameters;the morphological changes of synapse by detecting dendritic spines in the dentate gyrus region was detected by Golgi staining;the expression levels of synaptic-related proteins were detected by Western blot.ResultsCompared to the sham group,the escape latency of CCH group was increased significantly(P<0.05).And the escape latency of the CCH+resveratrol group was significantly lower than the CCH group(P<0.05),but there was no significant difference compared to the sham group and the resveratrol group(P>0.05).Compared to the sham group,the curvature of synaptic interface,synaptic active area length and PSD were decreased significantly and the synaptic cleft width was significantly increased in CCH group(P<0.05),while synaptic interface parameters in rats returned to normal after the rats were pretreated with resveratrol.The density of dendritic spine and the percentage of mushroom-type spines in the CCH group were decreased compared to the sham group(P<0.05),but pre-administration with resveratrol strongly improved the inhibited spinogenesis.Compared to Sham group,the protein levels of PSD95,NR2A/B,and PSD93 were significantly decreased in the CCH group,which was partially improved by pre-administration with resveratrol.ConclusionResveratrol pre-application recovery the synaptic plasticity in the aspect of functional and structural in cerebral ischemia rats,and the expression levels of Synaptic synaptic related protein play a key role in the protection of neurons in rat model of resveratrol-mediated cerebral ischemia.
Vascular dementia;Resveratrol;Synaptic plasticity;Dendritic spine
R-332
A
1003—6350(2017)03—0348—05
10.3969/j.issn.1003-6350.2017.03.002
2016-09-29)
李华钢。E-mail:lihg0909@sina.com

