Kimura法腹腔镜胰体尾切除术中脾血管分离技巧探讨
吴宝强,安勇,江勇,陈学敏,孙冬林
(江苏省常州市第一人民医院 肝胆胰外科,江苏 常州 213003)
随着保脾观念的广泛接受和腹腔镜技术的发展,采用腹腔镜下保留脾脏的胰体尾切除术(laparoscopic spleen-preserving distal pancreatectomy,LSPDP)已被认为是胰腺体尾部良性或交界性肿瘤的理想术式[1-3]。LSPDP有Washaw法和Kimura法两种术式[4],前者断离脾动静脉,仅保留胃网膜左血管和胃短血管对脾脏的血供,虽简化了手术,但术后有脾梗死、脾脓肿发生的风险;后者保留完整的脾动静脉,脾脏血供良好,为理想的LSPDP术式,但将脾血管从血管床中分离出来,费时、易出血,手术难度较高。本单位从2015年1月—2016年12月成功实施例Kimura手术18例,笔者就术中脾血管分离的临床体会报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2016年12月本单位采用Kimura法实施的18例胰腺体尾部肿瘤患者的临床资料,其中男6例,女12例;年龄19~61岁,平均年龄(37.8±10.6)岁。10例为体检发现,无明显临床症状;8例伴有上腹部饱胀不适或隐痛。术前常规B超、CT或MRI检查,确认肿瘤位于胰腺体尾部,其中囊性占位8例,囊实性占位6例,实性占位4例;肿块大小3.5~10.5 cm,平均(5.5±2.3)cm。所有患者行CAl9-9、CAl25、CA50、CEA、AFP等肿瘤标志物检测 阴性,结合患者一般状况、影像学检查和血清肿瘤标记物检测,经科内讨论后考虑为胰腺体尾部良性或交界性肿瘤,纳入Kimura手术标准。
1.2 手术方法
所有患者采用气管插管全身麻醉,取仰卧位,轻度头高脚低位。术者及扶镜手站于患者右侧,第一助手站于患者左侧。Trocar孔设置采用“五孔法”(图1A),即于脐下正中做12 mm垂直小切口,作为观察和取标本孔,气腹压力12 mmHg(1 mmHg=0.133 kPa),直视下分别在右侧腹直肌外缘脐上2 cm水平置12 mm套管1个为主操作孔,另取3个5 mm孔分别位于左、右腋前线肋缘下及脐稍上方左侧腹直肌外缘。手术步骤如下:探查腹腔后,使用超声刀打开胃结肠韧带,显露胰体尾部,在胰腺上缘找到脾动脉主干(图1B),悬吊以备用。接着从胰腺颈部下缘分离,切开胰颈下缘脂肪结缔组织显露肠系膜上静脉,沿其前壁向上分离,打通肠系膜上静脉、门静脉与胰颈之间的隧道,上下缘贯通后,使用窄条布带提拉悬吊胰腺,在距病灶1~2 cm胰腺头端用直线切割闭合器(EC60白钉强生公司)切断胰腺(图1C),如胰腺肿瘤靠近胰腺尾部,为了保留更多的胰腺组织也可选用脾静脉前方入路,即在离肿块右侧1~2 cm处、肠系膜上静脉门静脉汇合部左侧的脾静脉上方离断胰腺(图1D)。胰腺离断后,提起胰腺远端,用超声刀沿脾动静脉与胰腺之间的疏松组织向左游离,逐步将脾动静脉从胰腺实质内分离出来,遇到较粗的脾动静脉分支撕裂出血予5-0的Prolene线缝合裂口(图1E-F),如遇到胰腺组织与脾静脉之间隙小,分离困难,可直接紧贴血管侧壁施以可吸收夹后,超声刀沿着夹子分离胰腺,对于脾静脉被胰腺组织粘连包裹、辨别困难的情况,可先大范围游离胰腺下缘,将胰腺向上翻转,从脾静脉后方和下方来帮助显露脾静脉的走行(图1G),从右向左直至完全游离胰体尾。标本装袋后,将观察孔经脐扩大取出标本,检查无活动性出血后,胰床常规放置引流。
1.3 术后处理
术后入病房监护室24~48 h,重点观察腹腔引流量及性状,检测血液、引流液淀粉酶。常规使用生长抑素、抑酸剂、抗生素等。胰瘘诊断参考国际胰瘘研究小组的标准[5],术后至少1周内复查腹部增强CT,观察有无腹腔积液、脾血管通畅情况 。18例患者出院后均进行门诊随访,随访时间1~16个月,随访内容为上腹部CT或腹部B超、血常规、X胸片等 。
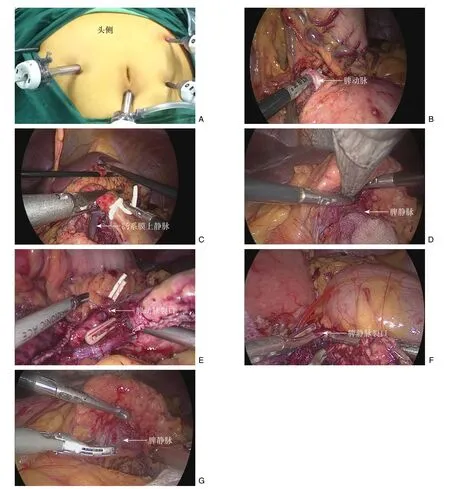
图1 手术相关图片 A:Trocar孔设置采用“五孔法”;B:在胰体部上缘分离脾动脉主干;C:于胰颈部上下贯穿胰腺后,采用切割闭合器切断胰腺;D:为保留更多的胰腺组织,在肠系膜上静脉左侧断胰;E:5-0的Prolene线修补脾动脉裂口;F:5-0的Prolene线修补脾静脉裂口;G:游离胰腺下缘,将胰腺向上翻转,暴露脾静脉Figure 1 Images related to the surgical procedure A: The 5-port Trocar arrangement; B: Isolation of the main trunk of the splenic artery along the superior border of the pancreatic body; C: Transection of the pancreas using a laparoscopic Endo GIA stapler after separation of the neck of the pancreas; D: Transection of the pancreas on the left side of the superior mesenteric vein for preservation of more pancreatic parenchyma; E: Repair of the splenic artery rupture with a 5-0 Prolene suture; F: Repair of the splenic vein rupture with a 5-0 Prolene suture; G: Exposure of the splenic vein after dissociation of the inferior margin of the pancreas and then upward traction of the isolated pancreas
2 结 果
2.1 手术情况及术后病理
本组18例均顺利完成Kimura手术,手术时间136~220min,平均(170±65)min;出血量50~450 mL,平均(180±45)mL,无再次手术者;术后住院时间6~21 d,平均(9.6±6.5)d。术后病理:胰腺浆液性囊腺瘤8例,黏液性囊腺瘤6例,实性假乳头状瘤2例,神经内分泌肿瘤1例,无功能胰岛细胞瘤l例 。18例患者中有10例使用5-0的Prolene线缝合脾静脉或脾动脉1~3个裂口。
2.2 术后并发症及处理
术后并发A级胰瘘8例(44.4%),引流治愈。B级胰瘘2例(11.1%),保持引流通畅并带管出院,其中1例出院后引流不畅并有发热再次住院,行腹腔积液穿刺引流,效果良好,2例分别于出院后27、35 d顺利拔管。所有患者无腹腔大出血、C级胰瘘、膈下脓肿、肠瘘等重大并发症。
2.3 随访
18例患者出院后均进行门诊随访,随访时间1~16个月。2例患者术后随访中发现出现局限性脾梗死,无发热、腹痛等临床症状,未经特殊治疗,分别于术后2、6个月复查CT脾脏灌注已恢复正常。所有患者随访中血小板计数稳定,无门静脉系统血栓形成。
3 讨 论
随着健康体检的普及,越来越多的胰腺体尾部良性、交界性肿瘤被发现,对于该类患者目前多主张行腹腔镜下保留脾脏的胰体尾部切除术,其不但体现了微创优势,还可保留脾脏功能,避免脾切术后的相关并发症[6-10]。保留脾血管的Kimura法,理论上讲更符合解剖生理,应作为首选,但将脾血管主干从胰腺体尾部完整分离出来手术难度较大,尤其是当脾静脉与胰体尾关系密切、肿块较大范围压迫脾静脉、胰尾部肥大嵌入脾门或合并慢性胰腺炎周围粘连致密时,Kimura法有较高的手术失败率[11]。因此,笔者科室常规行科内讨论,结合患者术前详细的影像学检查、肿瘤标志物、超声内镜检查等结果,群策群力,18例患者均为科内讨论后纳入Kimura手术对象。
本组所有患者虽已做好充分的术前准备,但多数术中仍会遇到相当大的困难,主要技术难点是如何将脾动、静脉全程安全游离以及出血后控制,这也是Kimura手术成功的关键[12-13]。笔者的体会如下:⑴ 术前通过薄层螺旋CT,最好有脾血管的三维成像来判断肿瘤与脾血管的关系,了解脾动静脉的走行及主要分支情况,在游离脾血管和处理大的胰腺穿支血管时起着导航作用,做到“心中有数”。⑵ 一般而言,在胰体部后上缘分离脾动脉主干并不困难,因此应首先解剖脾动脉主干并在其近端置阻断带备用,如遇到脾动脉分支出血,可暂时行主干阻断,第一助手通过牵拉、吸引、推剥等技术,显露出血裂口,如血管断端蒂较长可直接上可吸收夹或Hem-o-lock夹处理,如裂口基底宽或主干损伤,则应在主刀控制血管近端、一助控制出血远端的默契配合下,使用5-0的Prolene血管缝线缝合裂口,也可先用钛夹暂时夹闭出血裂口,待妥善缝合后再去掉钛夹。由近及远随着胰腺的分离逐步向脾门分离脾动脉,在脾门处有时易将脾动脉的下极分支误认为胰腺分支而切断,造成局限性脾梗死,应予仔细辨认,本组中有2例因损伤下极分支而出现局限性脾梗死,但一般认为[14]不会造成不良后果。⑶ 脾动脉分离悬吊后,在分离胰腺下缘时应紧贴胰腺组织进行,有时为了保留更多的胰腺组织,可适当在肠系膜上静脉、门静脉轴左侧分离胰腺下缘[15],注意保留结肠系膜前后叶间的脂肪组织,避免分离过深进入脾静脉后方层面导致脾静脉的意外损伤。在胰腺体部上下贯通后,采用切割闭合器切断胰腺,一助右手适当牵开远端胰腺,左手使用吸引器,通过使用推剥、吸引或压迫等多种技巧帮助显露胰腺脾静脉之间隙,疏松的粘连或<2 mm的分支血管可使用超声刀直接离断,较粗的分支予夹闭后离断。由于脾静脉壁薄,易被压迫,易撕裂,且与胰腺的关系更为紧密,因此脾静脉的分离需要更多的耐心和技巧,如遇到胰腺与脾静脉侧壁之间隙小且粘连较致密不易推剥分开时,可直接紧贴静脉血管侧壁长轴施以可吸收生物夹,超声刀沿着夹子分离胰腺,残留极少量胰腺组织不会造成不良后果。稍有不慎可遇到脾静脉较大分支甚至主干撕裂,术者必须沉着冷静,主刀左手控制静脉近端,一助可在胰腺后方顶住血管远端以暂时控制出血,而后采用5-0的Prolene线仔细缝合裂口。一般情况下,脾静脉的游离采用胰体→胰尾→脾门的方向进行,但对于脾静脉上方被胰腺组织粘连包裹、辨别困难的情况,也可先大范围游离胰腺下缘,将胰腺向上翻转,从脾静脉后方和下方来暴露脾静脉,以利于判断血管走向和出血时压迫止血用。在分离即将靠近脾门时,采用由右向左、由下而上翻转胰腺的方法,务必看清胰尾整体轮廓和脾血管分支情况,避免误伤脾血管上下极主要分支和意外捅伤脾脏。本组18例患者中有10例使用5-0的Prolene线缝合脾静脉或脾动脉1~3个裂口,效果良好,术后随访无门静脉系统血栓形成。
术后胰腺残端漏是最常见的并发症,使用切割闭合器虽不能避免胰瘘的发生[16-19],但可以简化手术,尤其是目前电动切割闭合器的使用可以减少人力带来的不稳,在保持原位的基础上切断胰腺,效果更理想。研究[20]表明,腔镜下的胰体尾手术后的胰瘘发生率与开放下无明显差异,本组18例术后并发A级胰瘘8例(44.4%),B级胰瘘2例(11.1%),只要明确诊断,保持引流通畅,对症处理多可治愈。
综上所述,Kimura法治疗胰体尾部良性及交界性肿瘤是安全可行的,完善的术前准备、娴熟的腔镜下血管的缝合技术及助手的默契配合是完成手术的关键。
[1]田开亮, 朱立新, 赵红川, 等. 腹腔镜与开腹胰体尾切除术疗效比较的Meta分析[J]. 中华肝胆外科杂志, 2013, 19(7):507–512.doi:10.3760/cma.j.issn.1007–8118.2013.07.007.Tian KL, Zhu LX, Zhao HC, et al. Laparoscopic versus open distal pancreatectomy for pancreatic disease: a meta analysis[J].Chinese Journal of Hepatobiliary Surgery, 2013, 19(7):507–512.doi:10.3760/cma.j.issn.1007–8118.2013.07.007.
[2]de Rooij T, Sitarz R, Busch OR, et al. Technical Aspects of Laparoscopic Distal Pancreatectomy for Benign and Malignant Disease: Review of the Literature[J]. Gastroenterol Res Pract, 2015,2015:472906. doi: 10.1155/2015/472906.
[3]俞泽元, 龙勃, 郭凌云, 等. 完全腹腔镜保留脾脏胰体尾切除术的临床应用[J]. 中华普通外科杂志, 2016, 31(5):419–420.doi:10.3760/cma.j.issn.1007–631X.2016.05.017.Yu ZY, Logn B, Guo LY, et al. Application of total laparoscopic spleen-preserving distal pancreatectomy[J].Zhong Hua Pu Tong Wai Ke Za Zhi, 2016, 31(5):419–420. doi:10.3760/cma.j.issn.1007–631X.2016.05.017.
[4]吕国悦, 王广义, 蒋超, 等. 腹腔镜Warshaw法与Kimura法保脾胰体尾切除的临床对照研究[J]. 中华胰腺病杂志, 2013, 13(4):278–279. doi:10.3760/cma.j.issn.1674–1935.2013.04.022.Lu GY, Wang GY, Jiang C, et al. Clinical comparison between laparoscopic Warshaw and Kimura procedures in resection of the body and tail of the pancreas with spleen preservation[J]. Chinese Journal of Pancreatology, 2013, 13(4):278–279. doi:10.3760/cma.j.issn.1674–1935.2013.04.022.
[5]Butturini G, Daskalaki D, Molinari E, et al. Pancreatic fistula:de fi nition and current problems[J]. J Hepatobiliary Pancreat Surg,2008, 15(3):247–251. doi: 10.1007/s00534–007–1301–y.
[6]AddeoP. Splenic vein thrombosis and pancreatic fistula after minimally invasive distal pancreatectomy (Br J Surg 2014; 101:114–119)[J]. Br J Surg, 2014, 101(2):119–120. doi: 10.1002/bjs.9365.
[7]Pendola F, Gadde R, Ripat C, et al. Distal pancreatectomy for benign and low grade malignant tumors: Short-term postoperative outcomes of spleen preservation-A systematic review and update meta-analysis[J]. J Surg Oncol, 2017, 115(2):137–143. doi:10.1002/jso.24507.
[8]Kooby DA, Gillespie T, Bentrem D, et al. Left-sided pancreatectomy: a multicenter comparison of laparoscopic and open approaches[J]. Ann Surg, 2008, 248(3):438–446. doi: 10.1097/SLA.0b013e318185a990.
[9]Zhang AB, Wang Y, Hu C, et al. Laparoscopic versus open distal pancreatectomy for pancreatic ductal adenocarcinoma: a singlecenter experience[J]. J Zhejiang Univ Sci B, 2017, 18(6):532–538.doi: 10.1631/jzus.B1600541.
[10]Riviere D, Gurusamy KS, Kooby DA, et al. Laparoscopic versus open distal pancreatectomy for pancreatic cancer[J]. Cochrane Database Syst Rev, 2016, 4:CD011391. doi: 10.1002/14651858.CD011391.
[11]Kim H, Song KB, Hwang DW, et al. A single-center experience with the laparoscopic Warshaw technique in 122 consecutive patients[J]. Surg Endosc, 2016, 30(9):4057–4064. doi: 10.1007/s00464–015–4720–x.
[12]Inoko K, Ebihara Y, Sakamoto K, et al. Strategic Approach to the Splenic Artery in Laparoscopic Spleen-preserving Distal Pancreatectomy[J]. Surg Laparosc Endosc Percutan Tech, 2015,25(4):e122–125. doi: 10.1097/SLE.0000000000000182.
[13]赵龙, 姚捷, 钱建军, 等. 腹腔镜下保留脾脏血管的保留脾脏胰体尾切除术19例分析[J]. 中华普外科手术学杂志:电子版, 2015,9(6):82–84. doi:10.3877/cma.j.issn.1674–3946.2015.06.158.Zhao L, Yao J, Qian JJ, et al. Laparoscopic splenic vessel preserving splenic-preserving distal pancreatectomy: Report of 19 cases[J]. Chinese Journal of Operative Procedures of General Surgery:Electronic Version, 2015, 9(6):82–84. doi:10.3877/cma.j.issn.1674–3946.2015.06.158.
[14]胡浩, 金昌国, 欧阳才国, 等. 腹腔镜下保留脾脏的胰体尾切除术23例[J]. 肝胆外科杂志, 2015, 23(3):173–175.Hu H, Jin CG, Ouyang CG, et al. Twenty-three cases of Laparoscopic Spleen-preserving Distal Pancreatectomy[J]. Journal of Hepatobiliary Surgery, 2015, 23(3):173–175.
[15]姚捷, 钱建军, 柏斗胜, 等. 完全腹腔镜下保留脾脏胰体尾切除术18例分析[J]. 中华胰腺病杂志, 2015, 15(1):6–9. doi:10.3760/cma.j.issn.1674–1935.2015.01.002.Yao J, Qian JJ, Bai DS, et al. Total laparoscopic spleenpreserving distal pancreatectomy: report of 18 cases[J]. Chinese Journal of Pancreatology, 2015, 15(1):6–9. doi:10.3760/cma.j.issn.1674–1935.2015.01.002.
[16]陈金水, 胡先贵, 金钢, 等. 切割闭合器在胰体尾切除术中的应用[J]. 肝胆胰外科杂志, 2013, 25(1):13–15. doi:10.3969/j.issn.1007–1954.2013.01.004.Chen JS, Hu XG, Jin G, et al. Application of Endo-GIA stapler in resection of pancreatic body and tail[J]. Journal of Hepatopancreatobiliary Surgery, 2013, 25(1):13–15. doi:10.3969/j.issn.1007–1954.2013.01.004.
[17]周尊强, 张正筠, 佟大年, 等. 缓慢实质闭合技术在远端胰腺切除术中的应用[J]. 中华外科杂志, 2014, 52(12):950–951.doi:10.3760/cma.j.issn.0529–5815.2014.12.016.Zhou ZQ, Zhang ZJ, Tong DN, et al. Application of slow parenchymal flattening technique in distal pancreatectomy[J].Chinese Journal of Surgery, 2014, 52(12):950–951. doi:10.3760/cma.j.issn.0529–5815.2014.12.016.
[18]Zhou W, Lv R, Wang X, et al. Stapler vs suture closure of pancreatic remnant after distal pancreatectomy: a meta-analysis[J]. Am J Surg,2010, 200(4):529–536. . doi: 10.1016/j.amjsurg.2009.12.022.
[19]Miyasaka Y, Mori Y, Nakata K, et al. Attempts to prevent postoperative pancreatic fi stula after distal pancreatectomy[J]. Surg Today, 2017, 47(4):416–424. doi: 10.1007/s00595–016–1367–8.
[20]Jusoh AC, Ammori BJ. Laparoscopic versus open distal pancreatectomy: a systematic review of comparative studies[J].Surg Endosc, 2012, 26(4):904–913. doi: 10.1007/s00464–011–2016–3.

