携Jagged 2基因siRNA慢病毒表达载体的构建及其转染对胰腺癌细胞影响
徐林,易超,依马木买买提江·阿布拉,苏雅婷,晏冬,李海军,丁伟
(1. 新疆医科大学第三附属医院 肝胆外科,新疆 乌鲁木齐 830000;2. 新疆医科大学第五附属医院 医务部,新疆乌鲁木齐 830000;3. 广东省深圳市罗湖区人民医院 普通外科,广东 深圳 518001)
长久以来,胰腺癌一直是困扰着临床医师的难题,其早期发病隐匿进展迅速,多数患者一经发现已属晚期,丧失了最佳的手术机会,而其对放化疗又均不敏感,以根治性切除为主的综合治疗模式仍是目前最主要的治疗方法,致使胰腺癌已成为严重影响全人类生命健康的疾病[1-3]。随着近年来分子生物化学技术的不断发展,胰腺癌的发生发展机制已逐渐明了,多数学者[4-6]认为其恶性生物学特性的产生与维持是一个多细胞信号转导通路共同作用的过程。本研究通过Jagged 2(JAG2)基因针对Notch信号通路在胰腺癌细胞增殖、凋亡及侵袭转移过程中的作用进行研究,旨在为进一步阐明胰腺癌的发病发展机制及探寻有效的早期诊断与靶向治疗位点提供可靠的实验依据。
1 材料与方法
1.1 试剂与仪器
主要试剂:人胰腺癌组织源细胞培养试剂盒(Human Cancer PrimaCell™:Pancreatic Cancer Tissues Cells)及人胰腺癌组织源细胞鉴定试剂盒(Human Pancreatic Cancer Tissues Cell Primarker™ Kit)购自齐氏生物科技有限公司;DMEM/F12培养基、青霉素-链霉素双抗、Transwell 试剂盒购自Corning公司;胎牛血清购自Ausbian公司;胰蛋白酶购自生工生物工程(上海)股份有限公司;慢病毒载体构建包装试剂盒、转染试剂盒、RNA提取纯化试剂盒、逆转录试剂盒、Western blot试剂盒及抗体购自吉凯基因技术有限公司;TRIzol试剂盒购自上海普飞公司;MTT试剂盒购自Genview公司;Annexin V-APC细胞凋亡检测试剂盒购自eBioscience公司;碘化丙啶购自igma公司。仪器设备:超净工作台产自苏州佳宝净化工程设备有限公司;PCR仪产自Applied Biosystems公司;Real time PCR仪产自Roche公司;凝胶成像仪产自天能公司;CO2培养箱产自SANYO公司;高速离心机产自Thermo Scientific公司;荧光显微镜产自Olympus公司;倒置显微镜产自上海蔡康光学仪器有限公司;生物安全柜产自上海振样创空气净化设备有限公司;酶标仪产自Tecan infinite公司;流式细胞仪产自Millipore公司;96孔板产自Cornning公司。
1.2 胰腺癌原代细胞的分离培养与传代
胰腺癌组织来源:收集新疆医科大学附属第三医院2014年1月—2016年6月间行胰十二指肠切除术的胰腺恶性肿瘤患者的新鲜肿瘤组织标本共22例,并按如下的纳入与排除标准初步筛选出其中的12例拟用于后续研究的标本。纳入标准:⑴ 经快速病理证实为胰腺导管细胞癌;⑵ 经本院首次确诊的新发病例;⑶ 患者年龄≥18岁;⑷ 患者本人及患者家属同意留取组织标本并用于研究,允许研究资料交流发表。排除标准:⑴ 经常规病理及免疫组化证实存在局部脉管侵犯、区域淋巴结转移,或为其他胰腺恶性肿瘤;⑵ 存在远处转移;⑶ 合并有其他恶性肿瘤或糖尿病、高血压、心脑血管疾病等全身系统性疾病;⑷ 术前已接受放疗、化疗或其他抗肿瘤药物治疗患者;⑸ 近3年内有手术史。
胰腺癌原代细胞的分离与纯化:参照美国IRB与HIPAA批准方案收集手术切除的胰腺癌组织标本后,采用人胰腺癌组织源细胞培养试剂盒分离并纯化获得胰腺癌原代细胞,加入完全培养基重悬细胞并置于37℃、5% CO2环境中继续培养,待细胞生长至覆盖培养瓶的80%及以上面积时用冻存液(DMEM/F12+40%FBS+10%DMSO)重悬细胞并置于冻存管中4℃放置0.5 h,-20℃放置1.5 h,-80℃放置过夜,24 h后转入液氮罐内冻存备用。12例组织样本成功分离胰腺癌原代细胞6例,3例细胞在分离过程中发生严重污染,2例细胞分离后出现大量细胞碎片成活细胞数极少至分离失败,1例细胞中成纤维细胞去除失败大量生长。
胰腺癌原代细胞的传代:冻存细胞经复苏后,用上述完全培养基培养至细胞覆盖培养瓶的80%以上,弃培养液洗涤细胞后加入0.25%胰蛋白酶1 mL 37℃孵育2min,倒置显微镜下观察细胞回缩变圆时立即加入完全培养基终止消化,细胞悬液1 500r/min离心5min,沉淀细胞并用完全培养基重悬后按1:2传代比例传5代,37℃ 5%CO2培养箱继续培养备用。细胞传代过程中,1例细胞发生严重污染,1例细胞出现大量脱落死亡。余成功传代培养细胞每例取1株经人胰腺癌组织源细胞鉴定试剂盒鉴定证实确为胰腺癌细胞。
1.3 JAG2基因siRNA慢病毒表达载体的构建与筛选
根据Genebank提供的基因信息设计3条siRNA靶点序列(siRNA1:GCT CTA CCA GTG CAA GAA CTT;siRNA2:CGC TGC TAC GAC CTG GTC AAT;siRNA3:CTG TGT GTA AAC AAG GGT GTA)并由吉凯基因技术有限公司代为合成siRNA片段(表1),将1μL上述合成的siRNA片段与1μL经双酶(AgeI、EcoR I)切的慢病毒载体(图1)混合后加入1μL T4 DNA ligase 16℃连接过夜(反应体系中加入10倍的T4 DNA ligase缓冲液并用ddH2O补足体检至20μL),10μL连接产物加入100μL感受态细胞中冰浴30min,42℃热激90 s,冰浴2min后加入500μL LB培养基,37℃振荡培养1 h,菌液均匀涂在含双抗的平板上恒温培养15 h,行PCR菌检(PCR引物为上游:CCA TGA TTC CTT CAT ATT TGC;下游:ATG TCC TTC TGC TGA TAC TGG G),阳性克隆接种至含双抗的LB培养基中37℃培养15 h后行测序,测序正确的菌液同上培养15 h后采用质粒提抽试剂盒提抽质粒并行质检。将经胰酶消化的293T细胞用含10%胎牛血清的完全培养基37℃ 5%CO2培养箱内培养24 h至细胞密度达70%~80%备用,转染前2 h更换为无血清培养基;上述构建的载体质粒20 μg、pHelper1.0载体15 μg、pHelper 2.0载体10 μg及相应转染试剂充分混匀调整体积至1 mL,室温下孵育15min,缓慢加入293T细胞中,37℃5%CO2培养箱内培养6 h洗涤细胞去除残余转染复合物后,缓慢加入含10%胎牛血清的完全培养基20 mL,37℃ 5%CO2培养72 h。收集293T细胞4℃、5 055r/min离心10min去除细胞碎片,以0.45 μm滤器过滤上清40 ml,25 000r/min离心2 h,弃去上清沉淀重悬后10 000r/min离心5min去上清获得目标病毒,采用荧光法测得病毒滴度分别为6×108、8×108、5×108TU/mL。
上述分离培养成功的胰腺癌原代细胞,参照转染试剂盒说明利用构建好的3条siRNA慢病毒表达载体转染后培养72 h收集细胞,采用TRIzol试剂提取细胞总RNA后,以GAPDH为内参,利用实时定量PCR法检测3组细胞中JAG2基因mRNA的相对表达量并采用Western blot法验证各组细胞中JAG2蛋白表达情况,选择抑制效率最高的siRNA慢病毒表达载体用于后续研究。反应程序为:95℃ 30 s、1个循环;95℃ 5 s、60℃ 30 s、40个循环;95℃15 s、60℃ 30 s、95℃ 15 s、1个循环。

表1 JAG2基因siRNA片段Table 1 The siRNA fragments for JAG2 gene
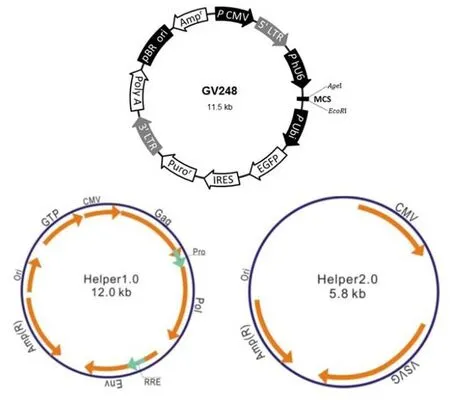
图1 慢病毒载体信息Figure 1 Information of the lentiviral vector
1.4 JAG2基因siRNA慢病毒表达载体对人胰腺癌原代细胞生物学特性影响分析
胰腺癌原代细胞培养至覆盖70%~80%培养瓶后分为2组,参照转染试剂盒说明,对照组细胞用不携带siRNA的空慢病毒载体(包含GV载体质粒、pHelper 1.0载体及pHelper 2.0)转染,JAG2 siRNA转染组细胞用siRNA慢病毒表达载体转染,转染培养72 h后观察2组细胞生长情况并于荧光显微镜下观察细胞荧光表达率(即转染率),当细胞生长至80%以上融合度且转染率达70%~80%时收集细胞行如下实验:参照MTT试剂盒说明,检测两组细胞5 d生长情况并绘制生长曲线,并依据细胞增殖抑制率=(1-JAG2 siRNA转染组细胞OD490值/对照组细胞OD490值)×100%公式计算JAG2 siRNA转染组细胞抑制率;两组细胞培养至第5天时收集细胞完全培养基重悬1300r/min离心5min,4℃预冷的D-Hanks洗涤细胞沉淀2次后1300r/min离心3min,用500μL结合缓冲液重悬细胞沉淀并与10μL Annexin V-APC混匀,避光室温反应15min,流式细胞仪检测细胞凋亡情况并对比分析;收集两组细胞1300 r/min离心5min,4℃预冷的D-Hanks洗涤细胞沉淀1次,1300 r/min离心5min,4℃预冷的75%乙醇固定细胞1h,再重复离心并用预冷D-Hanks洗涤细胞,加入含碘化丙啶(PI)细胞染色液染色细胞后流式细胞仪分析各组细胞的细胞周期;完全培养基重悬两组细胞后,参照Transwell试剂盒说明,上室中加入100μL细胞悬液调整每孔细胞数为1×105个,下室内加入600μL 30%FBS培养基37℃培养箱培养24h,去除培养基及非转移细胞后Giemsa染色3~5min,显微镜拍照并计数细胞,对比分析各组细胞侵袭转移能力。
1.5 统计学处理
应用SPSS 22.0软件统计分析,数据以均数±标准差(±s)表示,两组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 JAG2基因siRNA慢病毒表达载体的筛选
成功构建JAG2 siRNA慢病毒表达载体转染胰腺癌原代细胞(图2A);经构建的慢病毒表达载体转染后胰腺癌原代细胞中JAG2基因相对表达量见图2B,其中对照组为加入ddH2O的空白对照,3条siRNA慢病表达载体相较于对照组的抑制率分别为69.2%、4.8%、60.5%;Western blot结果显示JAG2蛋白表达情况与mRNA基本一致(图2C),故选择抑制效果最强的JAG2 siRNA1慢病毒表达载体进行后续研究。
2.2 细胞增殖检测
依据两组细胞经M T T处理后每天测得的O D490值绘制的生长曲线,结果显示,J A G 2 siRNA慢病毒表达载体可明显抑制胰腺癌细胞的生长(P<0.05),转染24、48、72、96、1 2 0 h的抑制率分别为(1 1.8 4±2.1 0)%、(2 6.9 1±0.8 9)%、(4 2.0 0±1.8 9)%、(40.26±2.74)%、(44.96±2.89)%(图3)。
2.3 细胞凋亡检测
经培养5 d后,对照组细胞的凋亡率为(4.98±0.33)%,JAG2 siRNA转染组细胞的凋亡率为(7.52±0.19)%,差异有统计学意义(P<0.05)(图4)。
2.4 细胞周期分析
经流式细胞仪分析,对照组细胞中处于G1期、S期及G2/M期的细胞占总细胞数的比例分别为(55.05±1.23)%、(23.53±0.94)%、(21.42±0.82)%,JAG2 siRNA转染组细胞各期细胞比例则分别为(6 1.0 6±0.8 0)%、(11.88±1.03)%、(27.07±0.39)%;与对照组比较,JAG2 siRNA转染组的胰腺癌细胞位于G1及G2/M期的细胞增多,而位于S期的细胞则明显减少(均P<0.05)(图5)。
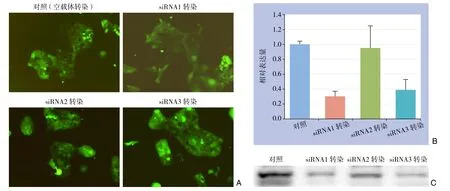
图2 转染效果观察 A:转染后胰腺癌细胞荧光照片(×100);B:转染后胰腺癌细胞JAG2 mRNA表达检测;C:转染后胰腺癌细胞JAG2蛋白表达检测Figure 2 Transfection effect observations A: Fluorescence microscopy images of the pancreatic cells after transfection (×100); B: JAG2 mRNA expressions in the pancreatic cells after transfection; C: JAG2 protein expressions in the pancreatic cells after transfection

图3 各组细胞生长曲线Figure 3 Growth curves of each group of cells
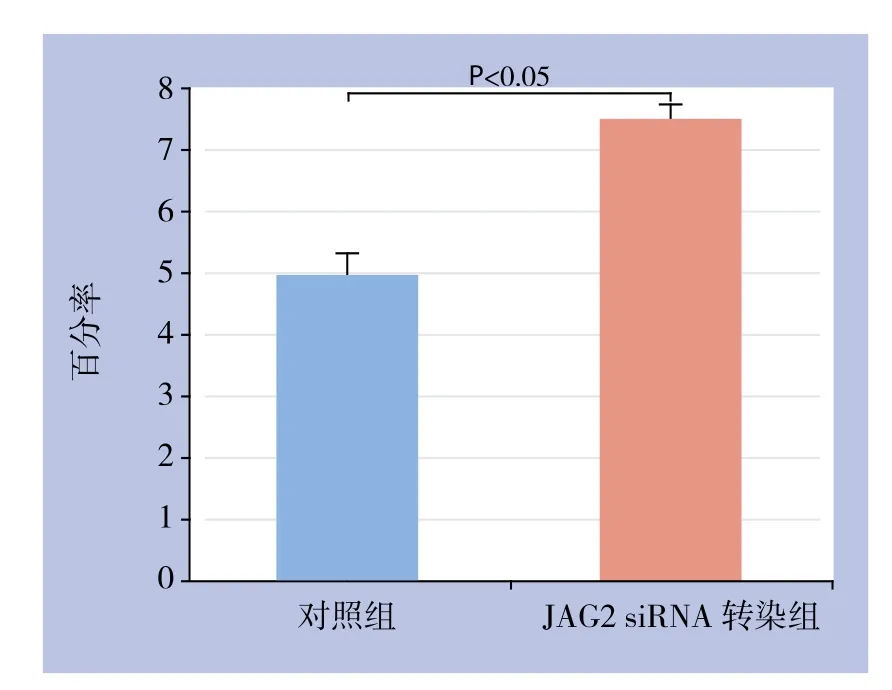
图4 各组细胞凋亡率Figure 4 Apoptosis rate of each group of cells
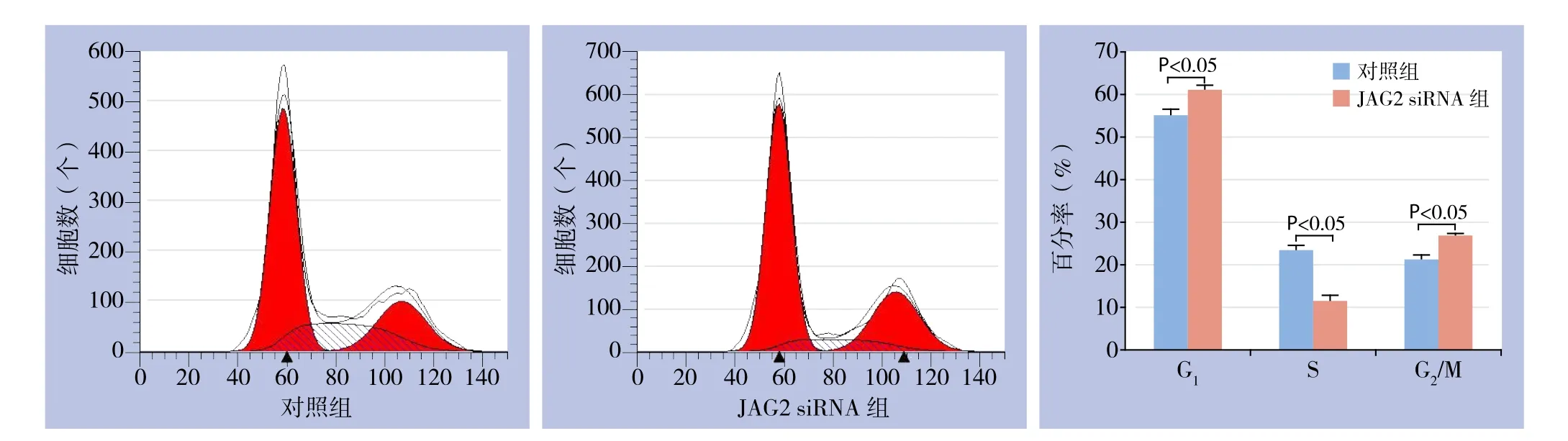
图5 各组细胞细胞周期分析Figure 5 Cell cycle analysis in each group of cells
2.5 细胞侵袭转移能力检测
Transwell小室实验结果显示,JAG2 siRNA转染组细胞小室内的细胞计数为(2.0±0.40)个/高倍视野,对照组细胞小室内计数(69±8.15)个/高倍视野,差异有统计学意义(P<0.05)(图6)。

图6 各组细胞侵袭转移能力测定 A:Transwell实验照片(×100);B:两组迁移细胞数比较Figure 6 Determination of invasion and metastasis ability in each group of cells A: Transwell assay fi ndings (×100); B: Comparison of the number of migrating cells between the two groups of cells
3 讨 论
Notch信号通路是一条广泛存在于脊椎动物与非脊椎动物进化上高度保守的信号转导通路,该通路由Notch受体家族、配体Delta和Serrate/Jagged、转录因子CSL(CBF-1、suppressor of hairless、Lag的合称)蛋白、调节因子及其它效应物构成,当相邻近细胞间的Notch受体与配体结合后,经过3次裂解产生其胞内活性成分NICD进入细胞核与转录因子CSL形成复合物激活下游靶基因,从而发挥其调节细胞的增殖、分化、凋亡及黏附等生物学功能[7-9]。Notch通路被认为是胚胎发育过程中的关键性细胞信号转导途径,而其异常激活则与多种肿瘤的发生发展及肿瘤血管的形成关联密切[10-13]。胰腺癌研究方面,Notch信号通路已被证实在动物胚胎胰腺早期发育中可促进胰腺前体的大量增生并维持胰腺细胞处于祖细胞状态,在成熟胰腺中该通路成员的表达量则处于较低的水平,只有当胰腺出现急慢性炎症时,该通路才再次被激活作用于胰腺的损伤修复,而胰腺癌组织中则可检测到该通路部分成员的过度表达[14-16]。Tang等[17]的研究显示,miR-34a可靶向阻断Notch通路从而影响胰腺癌细胞的增殖及侵袭转移能力,证实Notch信号通路的激活可能是胰腺癌恶性生物学特性产生的关键环节。Zhou等[18]通过体外阻遏胰腺癌细胞中Notch3的表达可显著抑制细胞的侵袭转移能力,进一步的研究结果也提示,Notch3的表达与胰腺癌脉管受侵、远处转移及TNM分期明显相关,且是缩短患者生存期的高危因素。杜潇等[19]的研究结果也提示,通过转染Notch1胞内段(NICD)质粒可上调Notch通路关键靶基因Hes1的表达抑制胰腺癌细胞株的凋亡从而促进细胞增殖与侵袭转移。
笔者课题组[20]在前期研究采用表达谱基因芯片对手术切除的胰腺癌及其癌旁正常组织间的差异表达基因进行了检测,研究结果显示,Notch信号通路中的主要成员Notch1、Notch2、Notch3、HES(hairy and enhancer of split)1、HES 5、CSHL(chorionic somatomammotropin hormone like)1及JAG2基因均存在不同程度的差异表达,经实时定量PCR验证,仅有Notch2基因的表达与基因芯片结果不相符,其余基因中以JAG2基因在胰腺癌细胞中的表达丰度最高。JAG2基因作为Notch信号通路的配体,其异常表达已被证实与结肠癌、乳腺癌、胃癌、非小细胞肺癌等多种恶性肿瘤的发生发展密切相关[21-24]。胰腺癌方面,目前国内外相关研究较少,Hu等[25]的研究结果显示,JAG2基因高表达与胰腺癌细胞的侵袭转移能力密切相关,但这种作用的发挥主要依赖于JAG2与Notch1间的相互作用,而不是通过激活Notch通路的下游靶基因来实现。为进一步分析JAG2基因及Notch信号通路在胰腺癌发生发展过程中的作用及其机制,本研究成功构建了3条携带JAG2 siRNA的慢病毒表达载体,并通过转染胰腺癌原代细胞后筛选出对JAG2基因表达抑制率最高的阻遏载体。经该阻遏表达载体转染抑制JAG2基因表达从而阻断Notch信号通路后,胰腺癌原代细胞的增殖与侵袭转移能力均出现明显的下降,而细胞凋亡比率则显著上升,证实Notch信号通路可能在胰腺癌的恶性生物学特性维持过程中起着重要的作用,同时也说明在胰腺癌发生发展过程中JAG2基因可能是Notch通路发挥调控作用的关键环节。
本研究在一定程度上证实了Notch信号通路在胰腺癌恶性生物学特性产生与维持过程中的重要作用,但因胰腺癌极低的手术切除率及胰腺癌原代细胞分离培养的困难,样本量较少,结果存在一定的偏倚,且该通路在胰腺癌细胞中的具体调控机制及其与其它通路的协同拮抗作用尚未明确,还需更为深入的研究论证。笔者相信,随着胰腺癌发生发展过程分子调控机制的不断明确,该通路势必会成为胰腺癌早期诊断甚至是靶向治疗的关键靶点。
[1]Kim CB, Ahmed S, Hsueh EC, 等. 胰腺癌的手术治疗现状[J].中国普通外科杂志, 2013, 22(9):1105–1113. doi:10.7659/j.issn.1005–6947.2013.09.001.Kim CB, Ahmed S, Hsueh EC, et al. Current surgical management of pancreatic cancer[J]. Chinese Journal of General Surgery, 2013,22(9):1105–1113. doi:10.7659/j.issn.1005–6947.2013.09.001.
[2]张亮, 王建方, 杨国山, 等. 胰腺癌多种治疗模式的临床疗效对比[J]. 中国普通外科杂志, 2013, 22(9):1138–1141. doi:10.7659/j.issn.1005–6947.2013.09.007.Zhang L, Wang JF, Yang GS, et al. Comparison of clinical ef fi cacy of different modalities for treatment of pancreatic cancer[J]. Chinese Journal of General Surgery, 2013, 22(9):1138–1141. doi:10.7659/j.issn.1005–6947.2013.09.007.
[3]杨尹默. 胰腺癌外科治疗的现状、存在问题与展望[J]. 中国普通外科杂志, 2016, 25(9):1231–1235. doi:10.3978/j.issn.1005–6947.2016.09.001.Yang YM. Surgical managements of pancreatic cancer:current status and future directions[J]. Chinese Journal of General Surgery,2016, 25(9):1231–1235. doi:10.3978/j.issn.1005–6947.2016.09.001.
[4]宁振, 谭广, 巩鹏, 等. 胰腺癌的分子病理学研究进展[J]. 中国普通外科杂志, 2014, 23(9):1253–1257. doi:10.7659/j.issn.1005–6947.2014.09.018.Ning Z, Tan G, Gong P, et al. Progression on molecular pathology of pancreatic cancer[J]. Chinese Journal of General Surgery, 2014,23(9):1253–1257. doi:10.7659/j.issn.1005–6947.2014.09.018.
[5]钟志惟, 殷香保. 胰腺癌的分子靶向治疗研究进展[J]. 中国普通外科杂志, 2016, 25(9):1351–1356. doi:10.3978/j.issn.1005–6947.2016.09.022.Zhong ZW, Yin XB. Research progress in molecular targeted therapy for pancreatic cancer[J]. Chinese Journal of General Surgery, 2016,25(9):1351–1356. doi:10.3978/j.issn.1005–6947.2016.09.022.
[6]朱建伟, 熊力, 马望, 等. 胰腺癌干细胞研究进展[J]. 中国普通外科杂志, 2015, 24(9):1304–1309. doi:10.3978/j.issn.1005–6947.2015.09.019.Zhu JW, Xiong L, Ma W, et al. Research progress of pancreatic cancer stem cells[J]. Chinese Journal of General Surgery, 2015,24(9):1304–1309. doi:10.3978/j.issn.1005–6947.2015.09.019.
[7]Haider S, Pollheimer J, Knöfler M. Notch signalling in placental development and gestational diseases[J]. Placenta, 2017, 56:65–72.doi: 10.1016/j.placenta.2017.01.117.
[8]Yu L, Fan Z, Fang S, et al. Cisplatin selects for stem-like cells in osteosarcoma by activating Notch signaling[J]. Oncotarget, 2016,7(22):33055–33068. doi: 10.18632/oncotarget.8849.
[9]Pannella M, Caliceti C, Fortini F, et al. Serum from advanced heart failure patients promotes angiogenic sprouting and affects the notch pathway in human endothelial cells[J]. J Cell Physiol, 2016,231(12):2700–2710. doi: 10.1002/jcp.25373.
[10]Yugawa T, Nishino K, Ohno S, et al. Noncanonical NOTCH signaling limits self-renewal of human epithelial and induced pluripotent stem cells through ROCK activation[J]. Mol Cell Biol,2013, 33(22):4434–4447. doi: 10.1128/MCB.00577–13.
[11]Brzozowa-Zasada M, Piecuch A, Dittfeld A, et al. Notch signalling pathway as an oncogenic factor involved in cancer development[J].Contemp Oncol (Pozn), 2016, 20(4):267–272. doi: 10.5114/wo.2016.61845.
[12]Bi P, Kuang S. Notch signaling as a novel regulator of metabolism[J]. Trends Endocrinol Metab, 2015, 26(5):248–255.doi: 10.1016/j.tem.2015.02.006.
[13]田青水, 张宝明, 刘毅. Notch信号通路相关蛋白在胃肠道间质瘤中的表达及临床意义[J]. 中国普通外科杂志, 2016, 25(4):547–551. doi:10.3978/j.issn.1005–6947.2016.04.014.Tian QS, Zhang BM, Liu Y. Expressions of Notch signaling pathway related proteins in gastrointestinal stromal tumors and their clinical signi fi cance[J]. Chinese Journal of General Surgery, 2016,25(4):547–551. doi:10.3978/j.issn.1005–6947.2016.04.014.
[14]Li XY, Zhai WJ, Teng CB. Notch signaling in pancreatic development[J]. Int J Mol Sci, 2015, 17(1). pii: E48. doi: 10.3390/ijms17010048.
[15]de Back W, Zhou JX, Brusch L. On the role of lateral stabilization during early patterning in the pancreas[J]. J R Soc Interface, 2013,10(79):20120766. doi: 10.1098/rsif.2012.0766.
[16]Wong CH, Li YJ, Chen YC. Therapeutic potential of targeting acinar cell reprogramming in ancreatic cancer[J]. World J Gastroenterol,2016, 22(31):7046–7057. doi: 10.3748/wjg.v22.i31.7046.
[17]Tang Y, Tang Y, Cheng YS. miR-34a inhibits pancreatic cancer progression through Snail1-mediated epithelial-mesenchymal transition and the Notch signaling pathway[J]. Sci Rep, 2017,7:38232. doi: 10.1038/srep38232.
[18]Zhou JX, Zhou L, Li QJ, et al. Association between high levels of Notch3 expression and high invasion and poor overall survival rates in pancreatic ductal adenocarcinoma[J]. Oncol Rep, 2016,36(5):2893–2901. doi: 10.3892/or.2016.5079.
[19]杜潇, 张思琴, 程中, 等. 激活Notch1信号通路对胰腺癌细胞增殖的影响[J]. 南方医科大学学报, 2013, (10):1494–1498. doi:10.3969/j.issn.1673–4254.2013.10.18.Du X, Zhang SQ, Cheng Z, et al. Effect of Notch1 signaling pathway activation on pancreatic cancer cell proliferation in vitro[J].Journal of Southern Medical University, 2013, (10):1494–1498. doi:10.3969/j.issn.1673–4254.2013.10.18.
[20]易超, 依马木买买提江·阿布拉, 丁伟, 等. Affymetrix基因表达谱芯片技术筛选胰腺癌异常表达基因的研究[J]. 中国普通外科杂志, 2017, 26(3):294–303. doi:10.3978/j.issn.1005–6947.2017.03.005.Yi C, Yimamumaimaiti·YBL, Diong W, et al.Screening of abnormally expressed genes in pancreatic cancer by Affymetrix gene expression chip[J]. Chinese Journal of General Surgery, 2017,26(3):294–303. doi:10.3978/j.issn.1005–6947.2017.03.005.
[21]Pancewicz-Wojtkiewicz J, Eljaszewicz A, Kowalczuk O, et al.Prognostic signi fi cance of Notch ligands in patients with non-small cell lung cancer[J]. Oncol Lett, 2017, 13(1): 506–510. doi: 10.3892/ol.2016.5420.
[22]He W, Chan CM, Wong SC, et al. Jagged2 silencing inhibits motility and invasiveness of colorectal cancer cell lines[J]. Oncol Lett, 2016, 12(6):5193–5198. doi: 10.3892/ol.2016.5321.
[23]Xing F, Okuda H, Watabe M, et al. Hypoxia-induced Jagged2 promotes breast cancer metastasis and self-renewal of cancer stemlike cells[J]. Oncogene, 2011, 30(39):4075–4086. doi: 10.1038/onc.2011.122.
[24]Huang TT, Ping YH, Wang AM, et al. The reciprocal regulation loop of Notch2 pathway and miR-23b in controlling gastric carcinogenesis[J]. Oncotarget, 2015, 6(20):18012–18026.
[25]Hu Y, Su H, Li X, et al. The NOTCH ligand JAGGED2 promotes pancreatic cancer metastasis independent of NOTCH signaling activation[J]. Mol Cancer Ther, 2015, 14(1):289–297. doi:10.1158/1535–7163.MCT–14–0501.

