美国白蛾几丁质脱乙酰酶的克隆、表达及酶学性质
闫晓平,赵丹,郭巍,2,王伟,张雅昆,郜玉杰,赵坤莉
美国白蛾几丁质脱乙酰酶的克隆、表达及酶学性质
闫晓平1,赵丹1,郭巍1,2,王伟1,张雅昆1,郜玉杰1,赵坤莉1
(1河北农业大学植物保护学院,河北保定071000;2北京农学院植物科学技术学院,北京102206)
【目的】研究美国白蛾()几丁质脱乙酰酶(chitin deacetylase,CDA)基因的酶学性质,了解其在昆虫生命过程中如何发挥功能,为美国白蛾的生物防治提供新靶标。【方法】 对家蚕()、棉铃虫()和云杉卷夜蛾()3种鳞翅目昆虫的几丁质脱乙酰酶2序列保守域进行分析,采用同源比对方法,设计几丁质脱乙酰酶2基因特异引物,利用PCR扩增该基因全长cDNA序列;构建原核重组表达载体pET30a-,克隆获得编码美国白蛾HcCDA2的基因,IPTG诱导蛋白表达,SDS-PAGE电泳检测;构建重组杆状病毒表达载体pFastBac-和pFastBac-,脂质体转染法转染昆虫细胞Hi5,分别获得P1、P2、P3病毒,收集P3病毒上清,得到美国白蛾HcCDA1(前期研究所得)和HcCDA2重组蛋白,Western blot分析;重组蛋白HcCDA1和HcCDA2经硫酸铵粗纯化后,以对硝基乙酰苯胺为底物,测定重组几丁质脱乙酰酶HcCDA1&2的酶活力,对其最适反应温度、最适pH以及金属离子的影响等酶学性质进行研究。【结果】 获得了编码美国白蛾几丁质脱乙酰酶2基因全长cDNA序列,命名为(GenBank登录号:KT781841),基因全长1.6 kb,该基因在大肠杆菌中成功表达61 kD目的蛋白,免疫家兔获得HcCDA2蛋白的特异性多克隆抗体。Western blot分析结果表明,和在昆虫细胞(Hi5)中均成功表达约80 kD蛋白。酶学性质研究表明,昆虫细胞中分泌表达的HcCDA1和HcCDA2均具有催化活性,两种酶的最适反应温度均为50℃,当温度达到80℃时,HcCDA2几乎失去酶活力;HcCDA1酶促反应适宜的pH范围为7.0—9.0,并且HcCDA1和HcCDA2酶促反应的最适pH均为8.0;在最适反应条件下,HcCDA2蛋白酶活力均高于HcCDA1蛋白酶活力;Mg2+、Zn2+、Mn2+和Ca2+对HcCDA1和HcCDA2酶促反应整体呈抑制趋势,随浓度增大,Zn2+对HcCDA1抑制作用逐渐增强,而Mg2+对HcCDA1的抑制作用则呈现先升高后降低的趋势,而且Mg2+和Ca2+对HcCDA2的抑制作用也是呈现先升高后降低的趋势。Co2+和Fe2+对HcCDA1和HcCDA2酶促反应有激活作用,随浓度增大,Fe2+激活作用越强,而Co2+激活作用则呈现先升高后降低的趋势。【结论】克隆了编码美国白蛾几丁质脱乙酰酶2基因(),在原核细胞中表达61 kD目的蛋白,免疫家兔获得HcCDA2蛋白的特异性抗体。得到具有活性的美国白蛾几丁质脱乙酰酶HcCDA1和HcCDA2,两者在体外均检测到催化活性,两种酶的最适反应温度均为50℃,最适pH均为8.0。
美国白蛾;几丁质脱乙酰酶;克隆表达;酶学性质
0 引言
【研究意义】美国白蛾()是一种重要的林木上的危险性害虫。几丁质作为结构内容物是昆虫表皮、中肠上皮细胞和围食膜的重要组成成分[1],对昆虫外骨骼和体内组织的形态和大小维持及蜕皮发育起着重要作用[2-3]。昆虫发育必须经历周期性去旧表皮和合成新表皮的过程,这一过程伴随着几丁质的合成和降解。多种酶参与几丁质的降解过程,几丁质脱乙酰酶(chitin deacetylase,简称CDA,EC.3.5.1.41)是几丁质降解酶系成员之一,能够催化几丁质中-1, 4-糖苷键连接的-乙酰基葡糖胺中乙酰氨基的水解[4]。酶是具有催化功能的蛋白质,研究其酶学性质有助于了解酶的催化机理,而研究酶学性质的前提是获得大量的高纯度的酶。【前人研究进展】早在1974年,Araki等[5]从接合菌纲的双相型真菌中发现了CDA,并对该酶的相关性质进行了研究;1975年,Araki等[6]又研究了金属离子对中CDA酶活力的影响;1982年,Kauss等[7]从植物病原体中提取到CDA,研究发现其酶活力不受乙酸的抑制,这是从非结合菌中发现该酶的最早报道;2005年,蔡俊等[8]采用固体平板培养和液体发酵从实验室保存的真菌中筛选出和两株产CDA酶活性较高的菌株,并研究了目标菌株的碳源、氮源、离子影响及酶学性质;2006年,蒋霞云等[9]对毛霉、根霉、曲霉和青霉4株霉菌在对数生长末期和稳定期末期的胞内和胞外CDA活力进行了研究;2008年,Toprak等在McCDAl原核表达的包涵体中测到蓓带夜蛾()CDA1的酶活,几丁质脱乙酰酶参与改变围食膜中几丁质的物理和化学性质,这一生化过程不仅改变几丁质的纤维结构,而且对围食膜蛋白的结合程度、围食膜的完整性和孔隙率产生影响[10-11]。2012年,ZHONG等[12]利用毕赤酵母真核表达系统表达获得家蚕()BmCDA7的可溶蛋白,经过硫酸铵粗纯化后,利用对硝基乙酰苯胺法测定其酶活力为1.85 U·mL-1;2015年,孙晓彤等[13]测得毕赤酵母中表达的重组SeCDA1蛋白酶活力为1.35 U·mL-1;2016年,危蓉萍等[14]克隆了蜜蜂螺原体几丁质脱乙酰酶基因,并得到具有活性的外源目的蛋白,测得外源表达的该酶活力最高可达10.14 U·mL-1,最适温度为50℃左右,最适pH为7.0—7.5,为后续研究螺原体与宿主蜜蜂的相互作用及其致病机制提供了重要信息。【本研究切入点】目前,多数文献集中于对基因分子特性的研究,而几丁质脱乙酰酶作为具有催化功能的蛋白质,不仅要明确其生理功能,还要深入研究其酶学性质。酶学性质的研究有助于对酶催化机理的了解,进而明确该酶对昆虫发育的影响。【拟解决的关键性问题】对美国白蛾几丁质脱乙酰酶2基因()的cDNA序列进行克隆,获取该基因全长并进行克隆表达,同时对前期获得的进行昆虫细胞表达,采用对硝基乙酰苯胺法对HcCDAs蛋白活性进行检测,为明确该基因的功能提供理论依据。
1 材料与方法
试验于2015—2016年在河北农业大学植物保护学院完成。
1.1 供试昆虫和昆虫细胞培养
美国白蛾卵于2015年购自中国林业科学研究院,将其置于(26.0±1.0)℃,RH 75%±10%,光周期16L﹕8D的培养箱中孵化,待其孵化为1龄幼虫后饲喂人工饲料,直至其蜕皮为5龄幼虫时开展试验。HighFive(Hi5)细胞系由青岛农业大学李国勋教授惠赠,于(26.5±0.5)℃,25 cm2细胞培养瓶中培养,TNMFH昆虫细胞培养基由Grace培养基改进,并辅以10%胎牛血清(四季青公司)。
1.2 主要菌株及试剂
大肠杆菌JM109、BL21,载体pET30a,为笔者实验室保存;cDNA序列及蛋白特异抗体为笔者实验室前期所得。pFastBacTM、DH10Bac和Cellfectin Ⅱ Reagent来自Bac- to-Bac Expression System Kit(购自Invitrogen公司)。RNA提取试剂盒购自QIAGEN公司,反转录试剂盒购自Promega公司,限制性内切酶均购自Promega公司,快速连接酶、预染Protein Marker购自Thermo公司。
1.3 总RNA的提取及第一链cDNA的合成
解剖昆虫5龄幼虫表皮,于DEPC处理过的灭菌水中反复漂洗,在干净的平皿上尽量除去多余的DEPC水后,将其装入1.5 ml无菌离心管中,立即投入液氮冷冻后,-80℃保存。提取总RNA,具体步骤参见QIAGEN试剂盒使用说明,按照Promega反转录试剂盒说明书,取1.2 μg RNA用于反转录合成第一链cDNA,反应体系为42℃ 60 min,95℃ 5 min,4℃ 5 min,立即取出。
1.4基因全长cDNA序列的获得
利用DNAMAN软件对家蚕(GenBank:HM450150.1)、棉铃虫()(GenBank:KM598637.1)、云杉卷夜蛾()(GenBank:KC285591.1)3种昆虫几丁质脱乙酰酶基因的cDNA序列进行比对,设计适用于克隆的特异引物(表1,F1/R1),以合成的cDNA为模板扩增几丁质脱乙酰酶序列的特异片段,送至上海生工生物工程公司测序。根据已知序列设计RACE-PCR引物以期获得全长序列(未成功),同时对已知序列进行NCBI-BLAST分析,根据同源序列设计简并引物(表1,F2/R2),PCR扩增获得基因全长cDNA序列。
1.5在大肠杆菌中的表达
根据原核表达载体pET30a设计包含酶切位点的特异引物(表1,F3/R3,I &I),以cDNA为模板,通过PCR扩增获得全长基因(),将载体和目的基因分别双酶切后进行连接、转化、筛选以及鉴定,并将鉴定正确的重组子(pET30a-)在37℃条件下以0.8 mmol·L-1IPTG诱导表达,离心收集菌体,超声破碎后12 000 r/min离心5 min,将沉淀溶于10 mmol·L-1Tris-HCl(pH 8.0),加入等体积的2×蛋白上样缓冲液,煮沸5 min,取20 μL样品进行检测,以未诱导的(pET30a-)作为阴性对照,SDS-PAGE电泳,考染检测。
1.6和在昆虫细胞中表达
根据真核表达载体pFastBac设计包含酶切位点的特异引物(表1,F4/R4,I &I;F5/R5,H I&R I),以cDNA为模板,通过PCR扩增分别获得和全长基因序列,分别酶切、连接、转化大肠杆菌JM109感受态细胞,筛选并鉴定阳性重组子后将得到的阳性重组子送至上海生工生物工程公司测序。然后将重组杆状病毒表达载体 pFastBac-和pFastBac-分别转化DH10BacTM感受态细胞,PCR鉴定重组Bacmid-和Bacmid-,选取鉴定正确的重组Bacmid,利用Cellfectin Ⅱ reagent转染昆虫细胞Hi5,获得重组病毒P1,继续侵染Hi5细胞分别得到P2和P3病毒,收集P3病毒上清得到重组蛋白。以转染空载体的Hi5细胞培养液上清为对照,加入等体积的2×蛋白上样缓冲液,煮沸5 min,取20 μL样品进行SDS-PAGE电泳,分别以HcCDA1和HcCDA2蛋白特异抗体为一抗,Western blot分析重组蛋白HcCDA1和HcCDA2的表达。

表1 美国白蛾PCR扩增和表达引物
方框标示的为酶切位点The boxes marked the restriction sites
1.7 美国白蛾几丁质脱乙酰酶HcCDA酶学性质分析
对硝基乙酰苯胺本身为无色固体,苯环上的乙酰氨基能够被水解生成具有游离氨基的对硝基苯胺,在400 nm条件下有特异性吸光值。重组蛋白HcCDA1和HcCDA2经硫酸铵粗纯化后以对硝基乙酰苯胺作为反应底物,根据钟晓武[15]的方法进行脱乙酰基酶活力测定。
1.7.1 重组HcCDA最适反应温度 在pH 8.0的Tris-HCl缓冲液中,反应温度分别为30、40、50、60、70、80℃,反应时间为15 min,测定不同温度条件下的酶活力。酶活力最高为100%,其余为相对酶活,分别确定HcCDA1和HcCDA2蛋白的最适反应温度。每组设置3个重复试验。
1.7.2 重组HcCDA最适反应pH 测定不同pH反应液(pH 3.0—9.0 Tris-HCl)条件下的酶活力,50℃水浴反应15 min。酶活力最高为100%,其余为相对酶活,分别确定HcCDA1和HcCDA2蛋白的最适反应pH。每组设置3个重复试验。
1.7.3 金属离子对酶活力影响 不同金属离子对酶活力的影响有较大差别,采用上述试验中确定的最适温度和最适pH,在酶液中添加Ca2+、Mg2+、Zn2+、Fe2+、Co2+、Mn2+,调整离子浓度分别为0、1.0、2.0、3.0、4.0、5.0 mmol·L-1,分别测定其酶活力。以不加金属离子的酶活力为参照,其余为相对酶活,确定金属离子对HcCDA1和HcCDA2蛋白的酶活力的影响。每组设置3个重复试验。
2 结果
2.1全长基因的扩增
利用设计的引物以cDNA为模板扩增得到基因片段,扩增产物大小为960 bp(图1-A),根据测序结果经同源序列比对设计简并引物,PCR扩增获得全长cDNA序列,大小为1.6 kb(图1-B)。
2.2 pET30a-重组表达载体的验证及原核表达
将载体和目的片段分别双酶切后进行连接、转化、筛选以及鉴定,在37℃,IPTG浓度为0.8 mmol·L-1进行诱导,离心收集菌体,经超声破碎后,在沉淀中检测到重组蛋白表达,成功表达61 kD的目的蛋白(图2),将重组蛋白HcCDA2经考马斯亮蓝染色后切胶送至河北省科学院生物研究所制备多克隆抗体。
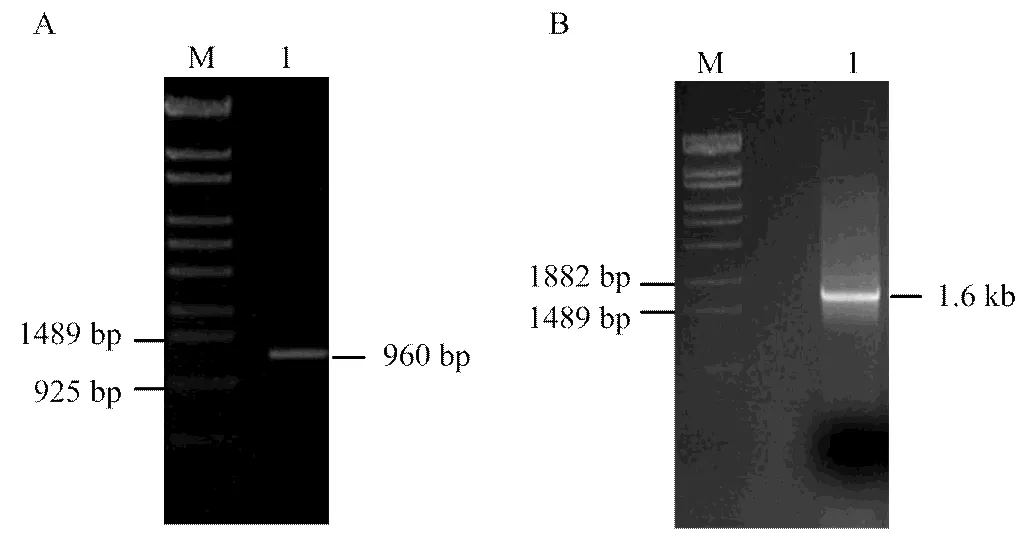
M:DNA Marker λ-EcoT14;A:1:美国白蛾CDA2基因片段

A:M:DNA Marker λ-EcoT14;1:pET30a-HcCDA2/Kpn I;2:pET30a-HcCDA2/KpnI & SacI;B:M:预染Marker Pre dye Marker;1:pET30a-HcCDA2未诱导Not induced;2:IPTG诱导8 h后pET30a-HcCDA2的表达expression of pET30a-HcCDA2after IPTG induced 8 h
2.3和重组转座载体和重组杆状病毒的验证及其在昆虫细胞中表达
首先将载体和目的片段分别双酶切后进行连接、转化克隆菌进行重组杆状病毒表达载体的构建(图3-A、3-D),分别将重组杆状病毒表达载体pFastBac-和pFastBac-转化DH10BacTM感受态细胞,PCR鉴定出正确的重组杆状病毒(图3-B、3-E),然后将鉴定正确的Bacmid-和Bacmid-纯化,在 CellfectionⅡ reagent作用下,分别转染Hi5细胞。转染后72 h,在倒置显微镜下观察发现,与转染空载体的Hi5细胞相比(图3-G),经重组杆状病毒侵染后的细胞由正常的梭形变为圆形,细胞直径增大,细胞核变大,大量细胞悬浮在培养基中,表明细胞转染成功(图3-H、3-I箭头所示)。取转染后72 h细胞上清,离心取上清进行Western blot检测。结果表明重组病毒成功转染昆虫细胞Hi5,并分泌表达分子量约为80 kD的HcCDA1蛋白和HcCDA2蛋白(图3-C、3-F)。
2.4 HcCDA1和HcCDA2酶学性质
2.4.1 最适反应温度 在pH 8.0的Tris-HCl缓冲液中测定不同温度下酶活力,结果表明温度为50℃时,酶活力最大,HcCDA1活力值为2.21 U·mL-1,HcCDA2活力为3.48 U·mL-1,温度达到80℃时,HcCDA2几乎失去活力(图4)。
2.4.2 最适反应pH 由于pH可以改变酶的构象,引起酶分子中活性部位的结构发生变化,所以在过酸或过碱的条件下,酶活力会快速丧失。在50℃水浴条件下测定酶活力,结果表明HcCDA1反应适宜的pH范围为7.0—9.0,当pH为8.0时,酶活力最高,为2.77 U·mL-1;当pH为8.0时,HcCDA2酶活力最高,为4.24 U·mL-1(图5)。
2.4.3 金属离子的影响 在50℃水浴,pH 8.0的条件下,酶液中添加不同浓度的金属离子,结果表明Mg2+、Zn2+、Mn2+和Ca2+对HcCDA1酶促反应整体呈抑制趋势;而且随着浓度增大,Zn2+抑制作用逐渐增强,而Mg2+抑制作用呈现先升高后降低的趋势;Ca2+在低浓度下对HcCDA1酶促反应有激活作用,但随着浓度增大,呈现出较强的抑制作用;Co2+对酶促反应有激活作用,但是随着浓度增大,激活作用呈现先升高后降低的趋势;Fe2+对HcCDA1酶促反应有激活作用,随着浓度增大,激活作用越强;Mg2+、Ca2+、Zn2+、Mn2+对HcCDA2酶促反应有抑制作用,随着浓度增大,Mg2+、Ca2+抑制作用呈现先升高后降低的趋势;Co2+对HcCDA2酶促反应有激活作用,但随着浓度增大,激活作用呈现先升高后降低的趋势;Fe2+对HcCDA2酶促反应有激活作用,随着浓度增大,激活作用越强(表2)。
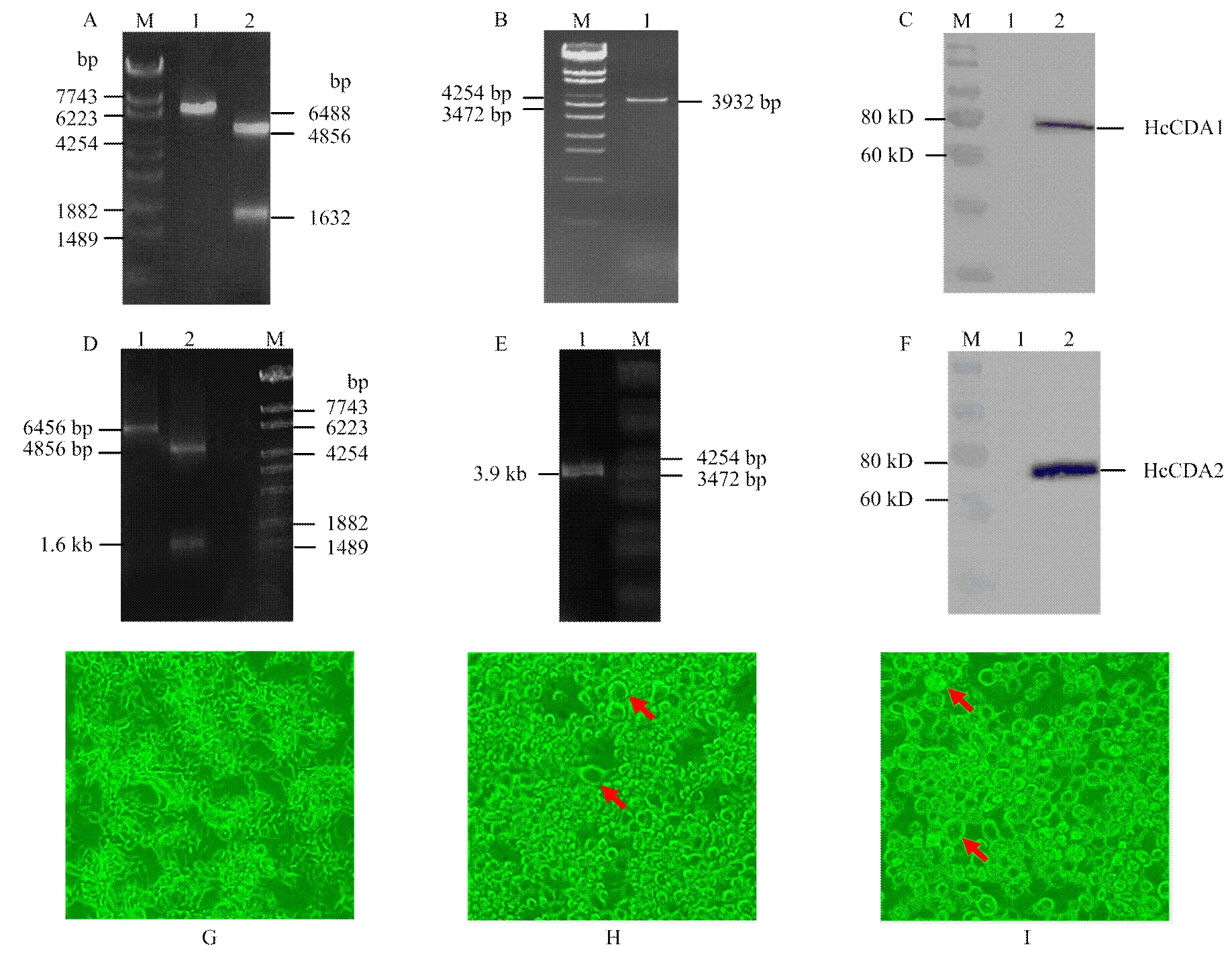
A:pFastBac-HcCDA1重组载体鉴定 Verification of the recombinant vectorpFastBac-HcCDA1。M:DNA Marker λ-EcoT14;1:pFastBac- HcCDA1/BamH I;2:pFastBac-HcCDA1/BamH I&EcoR I;B:重组bacmid-HcCDA1 PCR鉴定 PCR verification of the recombinant bacmid-HcCDA1. M:DNA Marker λ-EcoT14;1:重组Bacmid-HcCDA1通用引物M13F/R PCR产物 PCR product of recombinant Bacmid-HcCDA1 with universal primers M13F/R;C:Western blot检测HcCDA1在昆虫细胞中表达 Western blot analysis of the HcCDA1 expression in insect cells。M:预染Marker Pre dye Marker;1:对照昆虫细胞上清 Contrast;2:感染重组病毒Bacmid-HcCDA172 h后的昆虫细胞上清 Supernant of insect cells infected by recombinant virus Bacmid-HcCDA1 at 72 h;D:pFastBac-HcCDA2重组载体鉴定 Verification of the recombinant vectorpFastBac-HcCDA2。M:DNA Markerλ-EcoT14;1:pFastBac-HcCDA2/Sal I;2:pFastBac-HcCDA2/Sal I & Not I;E:重组bacmid-HcCDA2 PCR鉴定 PCR verification of the recombinant bacmid-HcCDA2。M:DNA Marker λ-EcoT14;1:重组Bacmid-HcCDA2通用引物M13F/R PCR产物 PCR product of recombinant Bacmid-HcCDA2 with universal primers M13F/R;F:Western blot检测HcCDA2在昆虫细胞中表达 Western blot analysis of the HcCDA2 expression in insect cells。M:预染Marker Pre dye Marker;1:对照昆虫细胞上清 Contrast; 2:感染重组病毒Bacmid-HcCDA2 72 h后的昆虫细胞上清 Supernant of insect cells infected by recombinant virus Bacmid-HcCDA2 at 72 h;G:对照昆虫细胞 Contrast;H:感染重组病毒Bacmid-HcCDA1 72 h后的昆虫细胞 Insect cells infected by recombinant virus Bacmid-HcCDA1 at 72 h;I:感染重组病毒Bacmid-HcCDA272 h后的昆虫细胞 Insect cells infected by recombinant virus Bacmid-HcCDA2 at 72 h
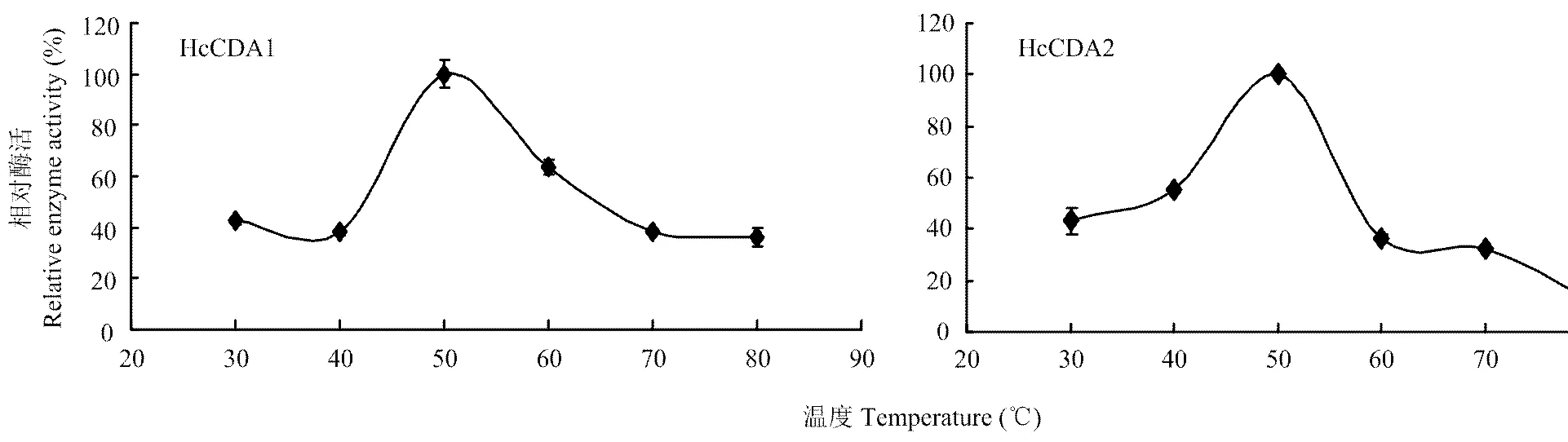
图4 温度对酶活力的影响
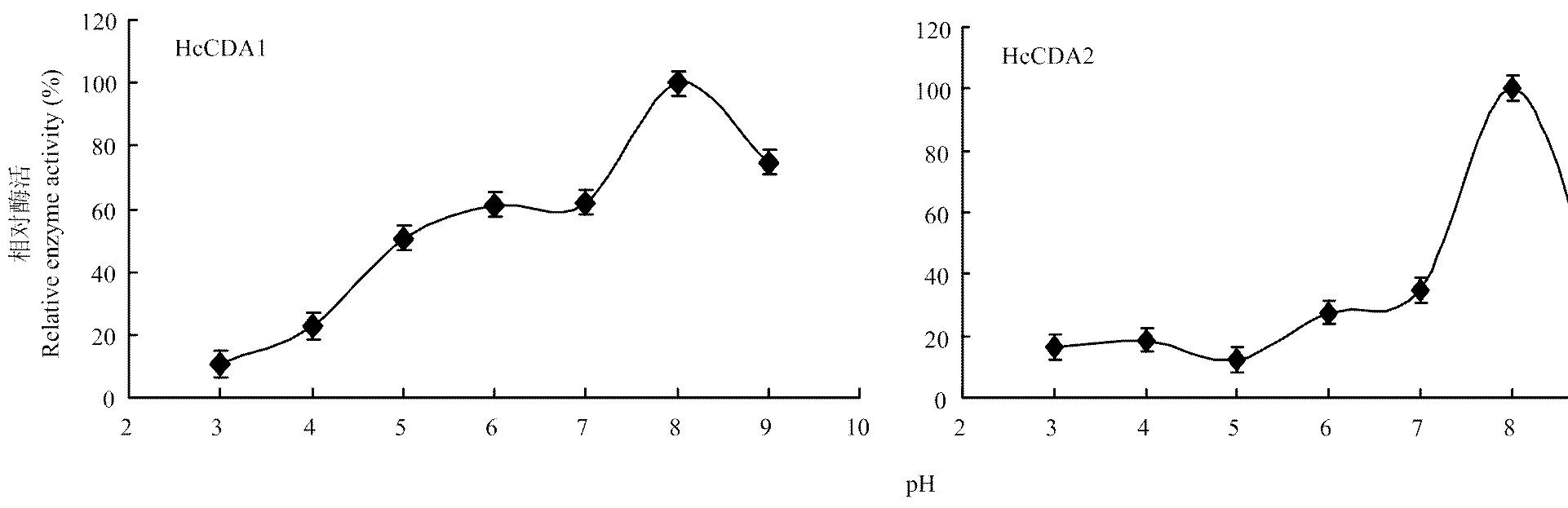
图5 pH对酶活力的影响
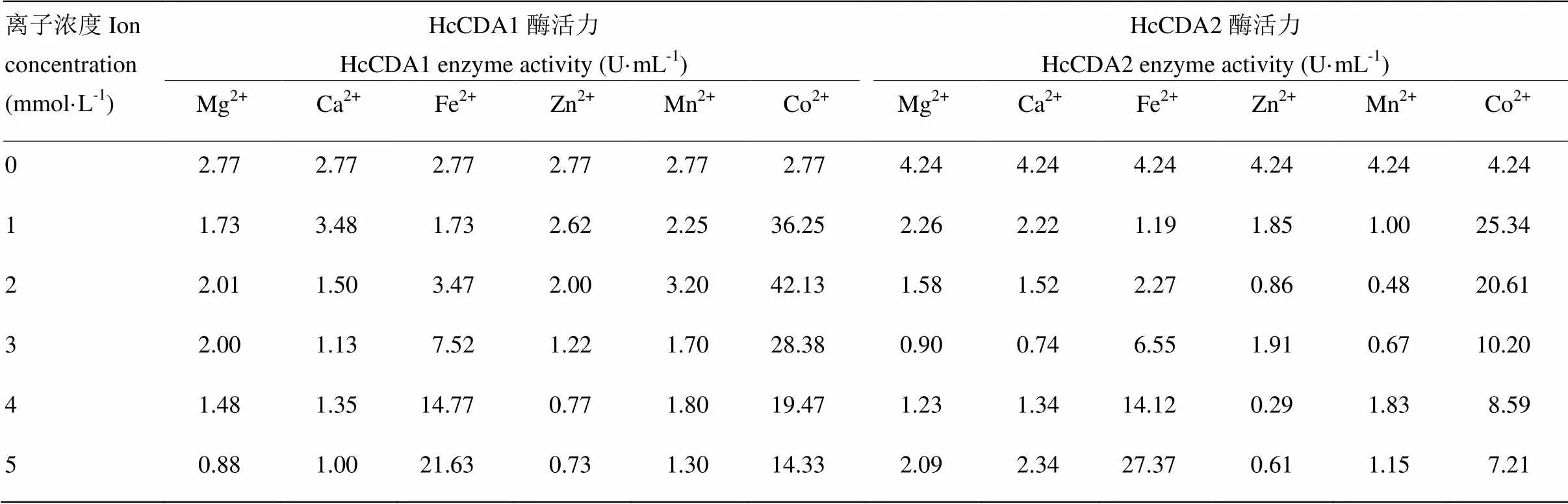
表2 金属离子对酶促反应的影响
3 讨论
几丁质脱乙酰酶(简称CDA)广泛存在于细菌、真菌和昆虫中,在几丁质代谢过程中发挥着重要作用[1],它可以将几丁质或者壳聚糖侧链上的酰基基团水解下来产生乙酸[4]。1995年,Alfonso等[16]研究发现构巢曲霉()的菌株自溶培养基中纯化得到的CDA参与菌体的自溶,能将细胞壁内切几丁质酶作用后产生的几丁类低聚物进行脱乙酰。此外,CDA在植物与病原体的相互作用中也发挥着重要作用,病原体通过分泌CDA保护自己不受植物宿主几丁质酶的降解,并且保证菌丝顺利穿透植物组织[17];昆虫CDA最早是由Guo等[18]从粉纹夜蛾()中肠的cDNA表达文库中得到的,该CDA属第V类CDA蛋白,只有一个多聚糖脱乙酰基酶催化区,该蛋白与中肠围食膜结合紧密,虽然没有几丁质结合结构域,却有很强的几丁质结合活性,但未测到脱乙酰基酶催化活性。2012年,ZHONG等[12]采用对硝基乙酰苯胺法测得毕赤酵母中表达的BmCDA7酶活力仅为1.85 U·mL-1;2015年,孙琳琳[19]采用荧光胺法、3-甲基-2-苯并噻唑酮腙法以及对硝基乙酰苯胺法均未检测到毕赤酵母表达的BmCDA1催化活性;孙晓彤[20]测得毕赤酵母表达的SeCDA1酶活力仅为1.35 U·mL-1,而昆虫细胞中表达的SeCDA1酶活力为1.88 U·mL-1,明显高于毕赤酵母中表达的酶活力;笔者前期研究结果显示酵母细胞中表达的HcCDA1酶活力仅为1.68 U·mL-1[21]。本研究表明昆虫细胞中表达的重组蛋白HcCDA1和HcCDA2均具有催化活性,酶的最适反应温度为50℃,HcCDA1和HcCDA2活力值分别为2.21和3.48 U·mL-1;最适pH为8.0,略偏碱性,当pH为8.0时,HcCDA1和HcCDA2酶活力为2.77和4.24 U·mL-1,明显高于毕赤酵母中表达的酶活力,进一步体现了昆虫细胞表达系统的优越性。CDA蛋白分为5组(Groups),其中Group I 包括CDA1和CDA2,含有3个功能结构域:几丁质结合结构域(ChBD)、低密度脂蛋白受体结合区(LDLa)和一个脱乙酰基酶催化区(CDA)。Group I类CDA基因在昆虫气管及表皮细胞中可检测到,其中CDA2 mRNA前体经可变剪接和外显子切除后产生2—4个亚类[22-23]。2013年,Quan等[24]发现云杉卷夜蛾几丁质脱乙酰酶2基因存在2个不同的剪切子(和);2014年,于荣荣等[25]发现中华稻蝗()几丁质脱乙酰酶2基因具有2个剪切子(和);2016年,Yu等[26]发现飞蝗()几丁质脱乙酰酶2基因也存在2个不同的剪切子(和)。本研究发现,在昆虫细胞中表达的HcCDA2酶活力均高于HcCDA1酶活力,推测是由于HcCDA2也存在着不同的剪切子,在催化过程中协同作用,共同发挥催化活性。
CDA是一种金属酶,属于糖酯酶4家族(Carbohydrate Esterase Family 4,CE4,http://www. cazy.org/fam/CE4. html)[27]。大多数CDA活性中心和其他糖酯酶4家族成员一样含有一个金属离子[28-29],这一金属离子在催化过程中发挥着关键作用。前人的研究发现在Zn2+(1 mmol·L-1)、Ca2+(1 mmol·L-1)和Co2+(1 mmol·L-1)存在条件下,CDA的活性会增强。将酿酒酵母的一种CDA去糖基化会导致酶几乎全部活性丧失,通过补加1 mmol·L-1Co2+能够恢复酶的活性,但其他金属离子则不具备这一作用[30]。类似地,EDTA能使担子菌类金针菇的CDA活性丧失,补加1 mmol·L-1的Co2+能使酶的活力恢复[31]。本研究表明Mg2+、Zn2+、Mn2+和Ca2+对HcCDA1和HcCDA2酶促反应整体呈抑制趋势;随着浓度增大,Zn2+对HcCDA1抑制作用逐渐增强,而Mg2+对HcCDA1的抑制作用则呈现先升高后降低的趋势,而且Mg2+、Ca2+对HcCDA2的抑制作用也是呈现先升高后降低的趋势。Co2+和Fe2+对HcCDA1和HcCDA2酶促反应有激活作用,随着浓度增大,Fe2+激活作用越强,而Co2+激活作用则呈现先升高后降低的趋势。Tokuyasu等[32]研究发现在菜豆炭疽病菌()中加入Cu2+能抑制CDA的活性,可以将含铜的杀菌剂应用于这种病原菌的防治。由此推测,上述某种金属离子可能作为设计环境友好型杀虫剂的添加剂,用于害虫的生物防治。
当前对I类CDA的研究主要集中在基因水平,对该类基因进行重组表达以及对其蛋白性质进行研究的报道较少。而I类CDA如何通过酶催化反应实现几丁质的脱乙酰基是其参与昆虫蜕皮过程几丁质装配的关键,本研究对上述问题进行了基本的阐释,有助于进一步研究几丁质脱乙酰酶基因在美国白蛾生长发育过程中的作用。
4 结论
获得了美国白蛾几丁质脱乙酰酶2基因()全长cDNA序列,能够在原核细胞中表达61 kD目的蛋白,免疫家兔获得HcCDA2蛋白的 特异性抗体。和在昆虫细胞中 均成功表达约80 kD蛋白,且均检测到催化活性,两种酶的最适反应温度均为50℃,最适pH均为8.0。
References
[1] Merzendorfer H, Zimoch L. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases., 2003, 206(24): 4393- 4412.
[2] Moussian B, Schwarz H, Bartoszewski S, Nüsslein- Volhard C. Involvement of chitin in exoskeleton morphogenesis in., 2005, 264(1): 117-130.
[3] Arakane Y, Muthuknshnan S, Kramer K J, Specht C A, Tomoyasu Y, Lorenzen M D, Kanost M, Beeman R W. Thegenesandare specialized for synthesis of cuticle and midgut peritrophic matrix., 2005, 14(5): 453-463.
[4] Kaur K, Dattajirao V, Shrivastava V, Bhardwaj U. Isolation and characterization of chitosan-producing bacteria from beaches of chennai, India., 2012, 2012: Article ID 421683.
[5] Araki Y, Ito E. A pathway of chitosan formation in: enzymatic deacetylation of chitin., 1974, 56(3): 669-675.
[6] Araki Y, Ito E. A pathway of chitosan formation in. Enzymatic deacetylation of chitin., 1975, 55: 71-78.
[7] Kauss H, Jeblick W, Young D H. Chitin deacetylase from the plant pathogen., 1982/1983, 28: 231-236.
[8] 蔡俊, 杜予民, 杨建红, 邱雁临. 甲壳素脱乙酰酶产生菌的筛选及产酶条件. 武汉大学学报(理学版), 2005, 51(4): 485-488.
Cai J, Du Y M, Yang J H, Qiu Y L. Selective strains and producing conditions of chitin deacetylase., 2005, 51(4): 485-488. (in Chinese)
[9] 蒋霞云, 周培根, 李燕, 王晓辉, 党培育. 几种霉菌产甲壳素脱乙酰酶活力比较及部分酶学性质. 上海水产大学学报, 2006, 15(2): 211-215.
Jiang X Y, Zhou P G, Li Y, Wang X H, Dang P Y. Comparisons of activities of chitin deacetylase from mold strains and study of its properties., 2006, 15(2): 211-215. (in Chinese)
[10] Toprak U, Baldwin D, Eelandson M, Gillott C, Hou H, Coutu C, Hegedus D D. A chitin deacetylase and putative insect intestinal lipases are components of the(Lepidoptera: Noctuidae) peritrophic matrix., 2008, 17(5): 573-585.
[11] Dixit R, Arakane Y, Specht C A, Richard C, Kramer K J, Beeman R W, Muthukrishnan S. Domain organization and phylogenetic analysis of proteins from the chitin deacetylase gene family ofand three other species of insects., 2008, 38(4): 440-451.
[12] Zhong X W, Wang X H, Tian X, Q Y Xia, Xiang Z H, Zhao P. Identification and molecular characterization of a chitin deacetylase fromperitrophic membrane., 2014, 15: 1946-1961.
[13] 孙晓彤, 赵丹, 闫晓平, 郭巍, 徐大庆, 李少雅, 李景. 甜菜夜蛾几丁质脱乙酰酶1 (SeCDA1) 在毕赤酵母中的表达与活性测定. 中国生物防治学报, 2015, 31(4): 586-591.
Sun X T, Zhao D, Yan X P, Guo W, Xu D Q, Li S Y, Li J. Expression and enzyme activity of chitin deacetylase 1 fromin, 2015, 31(4): 586-591. (in Chinese)
[14] 危蓉萍, 杨东航, 卜莹莹, 纪燕玲, 于汉寿. 蜜蜂螺原体几丁质脱乙酰酶基因的克隆、表达及酶学性质. 南京农业大学学报, 2016, 39(3): 417-424.
Wei R P, Yang D H, Bu Y y, Ji Y L, Yu H S. Cloning, expression and enzymatic characterization of a chitin deacetylase gene from., 2016, 39(3): 417- 424. (in Chinese)
[15] 钟晓武. 家蚕围食膜蛋白质组及几丁质去乙酰化酶的功能研究[D]. 重庆: 西南大学, 2012.
Zhong X W. Proteomic analysis on peritrophic membrane and functional characterization of chitin deacetylase in silkworm,[D]Chongqing: southwest university, 2012. (in Chinese)
[16] Alfonso C, Nuero O M, Santamaria F,Reyes F. Purification of a heat-stable chitin deacetylase fromand its role in cell wall degradation., 1995, 30(1): 49-54.
[17] Tsigos I, Martinou A, Kafetzopoulos D, Bouriotis V. Chitin deacetylases: new, versatile tools in biotechnology., 2000, 18(7): 305-312.
[18] Guo W, Li G, Pang Y, Wang P. A novel chitin-binding protein identified from the peritrophic membrane of the cabbage looper,., 2005, 35(11): 1224-1234.
[19] 孙琳琳. 昆虫几丁质脱乙酰基酶BmCDA1和OfCDA1的性质研究[D]. 大连: 大连理工大学, 2015.
Sun L L. Biochemical characterization of the insect chitin deacetylases BmCDA1 and OfCDA1[D]. Dalian: Dalian University of Technology, 2015. (in Chinese)
[20] 孙晓彤. 甜菜夜蛾几丁质脱乙酰酶1 (CDA1) 的鉴定与分析[D]. 河北: 河北农业大学, 2015.
Sun X T. Characterization of chitin deacetylasel (CDA1) identified from(Hubner) (LePidoPtera: Noctuidae)[D]. Hebei: Agricultural University of Hebei, 2015. (in Chinese)
[21] 闫晓平, 赵丹, 孙晓彤, 郭巍, 李少雅, 李景. 美国白蛾几丁质脱乙酰酶 1 (HcCDA1)的克隆表达与酶活测定. 中国生物防治学报, 2015, 31(3): 423-427.
Yan X P, Zhao D, Sun X T, Guo W, Li S Y, Li J. Clone, expression and CDA activity of chitin deacetylase 1 from(Drury), 2015, 31(3): 423-427. (in Chinese)
[22] 赵丹. 暗黑鳃金龟幼虫中肠蛋白基因的分离及表达分析[D]. 河北: 河北农业大学, 2014.
Zhao D. Isolation and expression analysis of midgut protein cDNAs fromMotschulsky larvae[D]. Hebei: Agricultural University of Hebei, 2014. (in Chinese)
[23] Wang P, Li G, Granados R R. Identification of two new peritrophic membrane proteins from larval: structural characteristics and their functions in the protease rich insect gut., 2004, 34(3): 215-227.
[24] Quan X G, Ladd T, Jun D, Wen F Y, Dourcet D, Cusson M, Krell P J. Characterization of a spruce budworm chitin deacetylase gene: stage-and tissue-specific expression, and inhibition using RNA interference., 2013, 43(8): 683-691.
[25] 于荣荣, 丁国伟, 郭亚平, 马恩波, 张建珍. 中华稻蝗几丁质脱乙酰基酶2基因的分子特性和生物学功能. 中国农业科学, 2014, 47(7): 1321-1329.
Yu R R, Ding G W, Guo Y P, Ma E B, Zhang J Z. Molecular characterization and functional analysis of chitin deacetylase 2 gene in., 2014, 47(7): 1321-1329. (in Chinese)
[26] Yu R, Liu W, Li D, Zhao X, Ding G,Zhang M, Ma E,Zhu K Y, Li S, Moussian B, Zhang J. Helicoidal organization of chitin in the cuticle of the migratory locust requires the function of the chitin deacetylase 2 enzyme (LmCDA2).,2016, 291: 24352-24363.
[27] Cantarel B L, Coutinho P M, Rancurel C, Bernard T, Lombard V, Henrissat B. The carbohydrate-active enzymes database (CAZy): an expert resource for glycogenomics., 2009, 37(1): 233-238.
[28] Nishiyama T, Noguchi H, Yoshida H, Park S Y, Tame J R H. The structure of the deacetylase domain ofPgaB, an enzyme required for biofilm formation: a circularly permuted member of the carbohydrate esterase 4 family.:, 2013, 69(1): 44-51.
[29] Shaik M M, Bhattacharjee N, Bhattacharjee A, Field M J, Zanotti G. Characterization of the divalent metal binding site of bacterial polysaccharide deacetylase using crystallography and quantum chemical calculations., 2014, 82(7): 1311-1318.
[30] Martinou A, Koutsioulis D, Bouriotis V. Expression, purification, and characterization of a cobalt-activated chitin deacetylase (Cda2p) from., 2002, 24(1): 111-116.
[31] Yamada M, Kurano M, Inatomi S, Taguchi G, Okazaki M, Shimosaka M. Isolation and characterization of a gene coding for chitin deacetylase specifically expressed during fruiting body development in the basidiomyceteand its expression in the yeast., 2008, 289(2): 130-137.
[32] Tokuyasu K, Ohnishi-Kameyama M, Hayashi K. Purification and characterization of extracellular chitin deacetylase from., 1996, 60(10): 1598-1603.
(责任编辑 岳梅)
Cloning, expression and enzymatic characterization of chitin deacetylases from
YAN Xiaoping1, ZHAO Dan1, GUO Wei1,2, WANG Wei1, ZHANG YaKun1, GAO YuJie1, ZHAO KunLi1
(1College of Plant Protection, Agricultural University of Hebei, Baoding 071000, Hebei;2Plant Science and Technology College, Beijing University of Agriculture, Beijing 102206)
【Objective】 The objective of this paper is to study the function of the enzyme in the process of insect life, enzymatic characterization of chitin deacetylases fromand to provide a basis for understanding of its function in the insect life, and to provide new targets for the biological control strategy of. 【Method】 The conserved domain of chitin deacetylase 2 sequences from three kinds of lepidoptera insects,andwere analyzed and chitin deacetylase gene-specific primers were designed by homologous alignment. A cDNA clone was identified to contain cDNA sequence coding for chitin deacetylase by PCR amplification. The prokaryotic recombinant expression vector pET30a-was constructed and cloned in, the protein expression was induced by IPTG and detected by SDS-PAGE electorphoresis. The recombinant baculovirus expression vector pFastBac-and pFastBac-were constructed, and liposome transfection method was used to transfect insect cells Hi5, then the P1, P2 and P3 viruswere obtained, respectively. The P3 cells supernatant were collected and western blot analysis was applied to detect the chitin deacetylase 1 (from the previous study) and 2 protein expression. The recombinant proteins were crude purified with ammonium sulfate and then the enzymatic characterizations were studied with the 4’-nitroacetanilide (including the optimum temperature, the optimum pH and the effects of different metal ions on enzyme activity).【Result】 The full-length cDNA clone encoded chitin deacetylase 2 inwas identified (GenBank accession number: KT781841). The cDNA is 1.6 kb in length. The protein encoded by this cDNA is named HcCDA2 and the protein was shown a band on the SDS-PAGE gel with an apparent molecular weight of 61 kD. The specific antibodies reacting to HcCDA2 were obtained by immunizing rabbits. Theandwere shown as 80 kD proteins in Hi5 cell line detected by Western blot analysis. The study of enzymatic properties showed that the two enzymes which were secreting expression in insect cells possessed catalytic activity, and the optimum temperature were both 50℃, when the temperature reached 80℃, the HcCDA2 almost lost its activity; HcCDA1 enzymatic reaction appropriate pH ranged from 7.0-9.0, and the optimum pH of HcCDA1 and HcCDA2 were both 8.0. Under the optimum reaction conditions, the enzyme activities of HcCDA2 protein were higher than HcCDA1 protein. Mg2+, Zn2+, Mn2+and Ca2+showed an inhibition on HcCDA1 and HcCDA2, an increasing Zn2+concentration would lead to the enhancement of inhibitory effects on HcCDA1, but Mg2+showed a trend of increasing first and then decreasing on HcCDA1, as well as an increasing Mg2+or Ca2+concentration showed an inhibition on HcCDA2. Co2+and Fe2+showed activation on HcCDA1 and HcCDA2, Fe2+showed activation stably with increasing concentration, while Co2+showed a trend of increasing first and then decreasing. 【Conclusion】 The genewas cloned from, expressed inshown as a 61 kD protein, and the HcCDA2 protein-specific polyclonal antibodies were obtained by immunizing rabbits. The active HcCDA1 and HcCDA2 proteins were obtained, and both of them showed a catalytic activity, the optimum temperature and pH were both 50℃ and 8.0, respectively.
; chitin deacetylase; cloning and expression; enzymatic characterization
2016-10-12;接受日期:2016-12-05
国家自然科学基金(31471775)、国家现代农业(花生)产业技术体系(30971910)、北京市百千万人才工程项目
闫晓平,E-mail:1013479394@qq.com。通信作者郭巍,E-mail:1787421502@qq.com

