提取时间对鸡骨蛋白凝胶特性和蛋白二级结构的影响
岳鉴颖,王金枝,张春晖,杜桂红,许雄
提取时间对鸡骨蛋白凝胶特性和蛋白二级结构的影响
岳鉴颖1,王金枝1,张春晖1,杜桂红2,许雄2
(1中国农业科学院农产品加工研究所/农业部农产品加工重点实验室,北京 100193;2鹤壁普乐泰生物科技有限公司,河南鹤壁 456750)
【目的】研究提取时间对鸡骨蛋白(chicken bone protein,CBP)凝胶特性的影响,为利用鸡骨副产物制备食用凝胶提供参考。【方法】采用热压抽提法提取CBP,于4℃孵育制备CBP凝胶,测定不同抽提时间的抽提液中总固形物、粗蛋白、羟脯氨酸含量、蛋白质二级结构、分子量分布的变化,探讨抽提时间对CBP凝胶色差、凝胶强度的影响,并分析各指标之间的相关性。【结果】抽提时间显著影响鸡骨蛋白的提取率(<0.05),导致蛋白结构发生显著变化进而影响其凝胶特性。抽提时间从0—120 min,抽提液中总固形物、粗蛋白和羟脯氨酸含量均显著增加(<0.05);随着提取时间延长(40—120 min),蛋白发生显著降解,分子量10—30 kDa的肽段从40 min的59.82%降低到120 min的13.99%,分子量<10 kDa的肽段从40 min的35.46% 升高到120 min的86.01%;提取时间延长引起蛋白发生部分程度变性,导致其二级结构改变,0—40 min时的CBP酰胺Ⅰ带由100%的α-螺旋组成,60—90 min时出现9.9%—17.6%的β-折叠结构,120 min时β-折叠全部降解;对CBP凝胶特性的分析表明,抽提时间为0 min时,鸡骨蛋白不形成凝胶,而抽提20、40和60 min时的凝胶强度无显著性差异,均优于90、120 min组;随着提取时间延长(20—120 min),提取液的透明度显著增加(<0.05),但40和60 min组的CBP制备的凝胶色泽最佳(<0.05);抽提时间(20—120 min)对凝胶持水性无显著影响(>0.05)。相关性分析表明,CBP中羟脯氨酸含量、CBP降解程度与凝胶特性显著相关(<0.05)。【结论】热压抽提时间对CBP凝胶特性有显著影响,综合考虑蛋白得率、凝胶色泽、强度等因素,40和60 min提取的鸡骨蛋白较适合制备凝胶。
鸡骨蛋白;热压抽提法;提取时间;凝胶特性;二级结构
0 引言
【研究意义】2015年中国肉鸡产量约为1.3×107t[1],肉鸡屠宰分割产生的鸡骨架约占鸡肉的25%— 30%,达到3.25×106—3.9×106t[2]。研究表明,鸡骨是一种优质蛋白资源,其蛋白质含量约为19%,其中胶原蛋白占总蛋白的35%—40%[2]。但目前鸡骨利用方式单一,主要用于加工骨糊、骨粉等低附加值产品[3],而骨蛋白类高附加值产品较少,因此,开发鸡骨原料的高值化利用技术,对于培育鸡肉加工行业新的效益增长点具有重要意义。【前人研究进展】动物的皮、骨中富含胶原蛋白,后者的部分水解产物可以形成食用凝胶[4]。由于胶原蛋白凝胶具有良好的生物相容性和功能特性,广泛应用于灌汤包子、饺子、肉糜型肉品以及甜点、乳品等食品加工,用于提高营养品质、改善组织结构和口感,且需求量逐年增加,造成市场供不应求[5]。目前,制备凝胶的胶原蛋白主要来源于猪皮、牛皮、鱼皮等[4-6],由于骨源食品加工技术匮乏,以可食性动物骨作为凝胶蛋白来源的研究较少。胶原蛋白制备传统方法多采用酸碱工艺,包括原料粉碎、去除非胶原蛋白、脱脂、酸/碱提取、透析、冻干等步骤,工艺复杂、耗时长,加工过程中大量使用酸、碱,且耗水耗能,易造成环境污染和资源浪费[7]。目前已有很多关于胶原蛋白提取和凝胶制备工艺优化的报道。CHEN等[5]采用超高压辅助HCl提取胶原蛋白并制备凝胶,凝胶强度显著提高。WANG等[6]采用胃蛋白酶辅助HCl提取胶原蛋白,提取率显著提高。经过工艺优化,胶原蛋白的提取率和凝胶强度等有所提高,但是传统制备工艺耗时长,大量使用酸、碱等问题仍未得到解决。【本研究切入点】近年来,笔者实验室以可食性骨为原料,创新性地开发出骨蛋白热压抽提方法,即利用热压抽提罐在高温高压条件下使鸡骨蛋白快速溶出,优化了骨蛋白制备工艺,克服传统方法的不足。前期对鸡骨蛋白高效提取研究发现,热压抽提可以有效地促进骨蛋白的迁移与溶出,总蛋白提取率达83.51%,胶原蛋白的提取率达96.81%[8]。热压抽提导致骨蛋白不同程度的降解,诱导胶原蛋白三股螺旋解离,优化并生产验证了130℃提取90 min可以兼顾鸡骨蛋白提取率和产品品质[9-10],但是热提取时间越长,蛋白水解程度越高,凝胶强度越差[11]。【拟解决的关键问题】以鸡骨为研究对象,采用热压抽提的方法在最佳提取温度(130℃)下制备鸡骨蛋白,动态分析不同抽提时间下鸡骨蛋白的二级结构、分子量分布、凝胶强度、色泽等指标的变化,阐明抽提时间对鸡骨蛋白理化特性和凝胶特性的作用效应,优化抽提时间,为骨蛋白用于食用凝胶生产提供工艺参考。
1 材料与方法
试验于2015年7—12月在中国农业科学院农产品加工研究所肉品实验室进行。
1.1 试验材料
鸡骨架,购于河南鹤壁普勒泰生物科技有限公司,保存于-18℃冰箱中。
1.2 主要试剂及仪器
1.2.1 主要试剂 羟脯氨酸标品、一水柠檬酸、氢氧化钠、无水乙酸钠、浓盐酸、对二甲氨基苯甲醛、氯胺T、浓硫酸等试剂,国药集团化学试剂有限公司;细胞色素C(12.5 kDa)、抑肽酶(6.5 kDa)、杆菌肽(1.45 kDa)、乙氨酰氨-乙氨酰氨-精氨酸(451 Da)和乙氨酰氨-乙氨酰氨-乙氨酸(189 Da)标准品,美国Sigma化学试剂公司。
1.2.2 主要仪器设备 PG-150破骨机,廊坊市顶天轻工机械有限公司;高温高压提取罐,浙江天联机械有限公司;MASTER-53M手持式折射仪,日本爱宕有限公司;T6-新世纪紫外分光光度计,北京普希通用仪器有限公司;KJELTEC2300型全自动凯氏定氮仪,瑞典Foss集团;CR22 GII高速冷冻离心机,日本Hitachi公司;TA.XT2i Plus质构仪,英国Stable Micro System公司;CR-400型便携式色差仪,日本柯尼卡美能达公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司。
1.3 试验方法
1.3.1 鸡骨蛋白提取 鸡骨架经破碎、清洗,去除血水和杂质后放入提取罐,按骨渣质量比1﹕1.5加水。升温至(130±0.5)℃,0.175 MPa时恒温,分别在恒温0、20、40、60、90和120 min时取样,并过200目筛以除去鸡骨残渣,采用离心法(16 000×)去油,所得鸡骨蛋白样品置于-80℃冰箱保存,用于后续分析、检测。
1.3.2 总固形物和粗蛋白含量测定 总固形物(total soluble substance,TSS)含量采用MASTER-53M 手持式折射仪直接测定。粗蛋白含量采用半微量凯氏定氮法测定[10]。每组样品平行测定3次。
1.3.3 羟脯氨酸含量测定 羟脯氨酸(Hyroxyproline,Hyp)含量测定参考Bertram等[12]的方法并略作修改。取100 mg样品加入5 mL 6 mol·L-1HCl于110℃下水解24 h。水解液用活性炭吸附后,单层滤纸过滤,用10 mol·L-1和1mol·L-1NaOH调滤液pH至6.0,然后用蒸馏水定容至50 mL。取出4 mL定容后溶液加入2 mL氯氨T,混匀,室温放置20 min。然后加入2 mL显色剂,摇匀,60℃水浴20 min。样品用流水冷却5 min,在558 nm下测吸光度。每组样品平行测定3次。
1.3.4 分子量分布测定 参考IRVINE等[13]的方法,采用体积排阻色谱法(SEC)测定鸡骨蛋白的分子量分布,每组样品平行测定3次。色谱条件为:色谱柱,TSK G2000SWXL(30 cm×7.8 mm,5 μm);洗脱液,乙腈/超纯水/三氟乙酸(45/55/0.1,v/v/v);流速,0.6 mL·min-1;柱温,30℃;检测波长,220 nm;上样量,10 μL。以细胞色素C(12.5 kDa)、抑肽酶(6.5 kDa)、杆菌肽(1.45 kDa)、乙氨酰氨-乙氨酰氨-精氨酸(451 Da)和乙氨酰氨-乙氨酰氨-乙氨酸(189 Da)标准品与保留时间拟合直线方程为:=-0.26+6.78,2=1.00,其中为保留时间(单位:min),为标准品分子量的对数。
1.3.5 傅里叶红外分析 采用傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FTIR)分析不同抽提时间蛋白质的结构变化。参照李侠等[14]的方法并略作修改,采用多次衰减全反射技术(attenuated total reflection,ATR)进行测量。取相同体积样品置于ATR附件上扫描,采用OMNIC软件记录谱图,并利用仪器的差减软件进行差减去除水的干扰。测定范围4 000—400 cm-1,分辨率4 cm-1,扫描次数100次。利用PeakFit 4.12(SPSS Inc.,Chicago,IL,USA)软件对红外光谱酰胺Ⅰ带(1 700—1 600 cm-1)谱峰进行处理。
1.3.6 凝胶强度测定 凝胶强度测定参考PANG等[15]的方法并略作修改。将鸡骨蛋白溶液冻干后复溶至同一浓度(6.67%,以粗蛋白计),4℃孵育(17±1)h后进行凝胶强度测定,每组样品平行测定3次。仪器采用TA.XT2i Plus质构仪,探头型号P/0.5,测前速度2.0 mm·s-1,测试速度1.0 mm·s-1,测后速度2.0 mm·s-1,压缩比例30%,负荷5 g,测定温度25℃。
1.3.7 凝胶持水性测定 凝胶持水性(water holding capacity,WHC)测定参考ZHOU等[16]的方法并略作修改。量取等体积样品于离心管中,4℃孵育(17±1)h制备凝胶,6 000×离心15 min(4℃)后去除离出水分,记录空离心管质量及离心前后离心管与凝胶的总质量,每组样品平行测定3次。凝胶持水性按式(1)计算:
WHC(%)=(W2−W)/(W1−W)×100% (1)
式中,W为离心管重量,W1为离心前离心管和蛋白凝胶总重量,W2为离心后离心管和蛋白凝胶总重量。
1.3.8 鸡骨蛋白溶液透明度测定 CBP溶液透明度测定参考刘小玲[17]的方法并略作修改。测定同浓度的鸡骨蛋白溶液在660 nm处的吸光值A,每组样品平行测定3次。根据公式(2)换算为透过率transmittance(T),T越大,溶液的透明度越高。
公式如下:
A= −lgT (2)
1.3.9 凝胶色泽测定 凝胶色泽测定参考王春青等[18]的方法并略作修改。使用便携式色差仪直接测定凝胶表面的亮度值L*、红度值a*和黄度值b*,+a*表示样品偏红,−a*表示偏绿,+b*表示样品偏黄,−b*表示样品偏蓝。每组样品平行测定3次。色差计使用前用白板校准。白度值W计算公式如下:
W=100−[(100−L*)2+a*2+b*2]1/2(3)
1.4 统计分析
采用SAS 9.2软件进行统计分析,用ANOVA 进行方差分析,Duncan进行显著性检验(<0.05)。使用Microsoft Excel 2013软件绘图,同一图或表中不同的小写字母表示差异显著(<0.05)。
2 结果
2.1 抽提时间对TSS、粗蛋白含量和粗蛋白提取率的影响
TSS、粗蛋白含量和提取率变化规律如表1所示。随着抽提时间的延长,TSS和粗蛋白含量均显著增加,TSS从开始时的0.97%增加到120 min的5.43%;粗蛋白含量从开始时的0.92%增加到120 min的5.01%(<0.05)。0—90 min粗蛋白含量增幅较大,90—120 min增幅趋于平缓,与粗蛋白提取率结果一致。说明热压抽提破坏了鸡骨坚硬的结构,蛋白质和少量的可溶性有机化合物不断溶出,并且大部分蛋白在前90 min已经被提取溶出[9]。
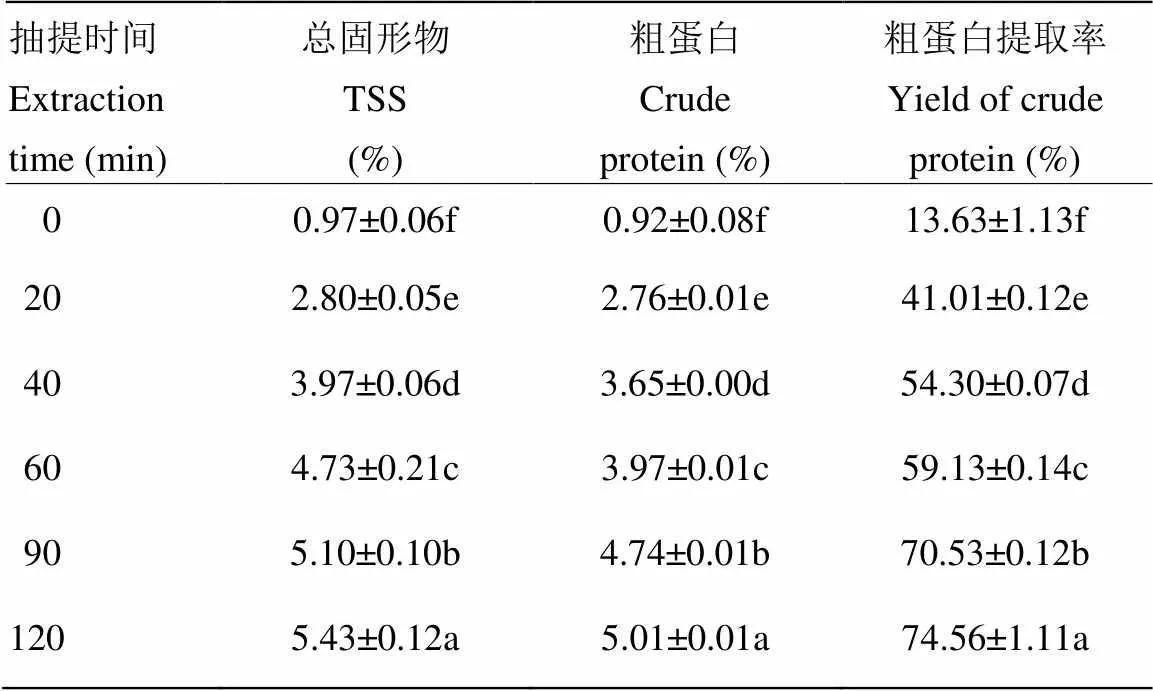
表1 热压抽提时间对TSS、粗蛋白含量和粗蛋白提取率的影响
同一列不同字母表示差异显著(<0.05)。下同
Different letters in the same column are significantly differences (<0.05). The same as below
对相同时间点的TSS和粗蛋白含量进行回归分析得到线性方程=0.78+0.61(其中:为TSS,为粗蛋白含量),方程回归性显著(<0.05),决定系数2=0.93,说明该方程拟合性良好。利用此方程可以对热压抽提过程中粗蛋白含量进行预测,实现了鸡骨蛋白生产过程中粗蛋白含量的在线预测,大大节省检测时间和成本。
2.2 抽提时间对羟脯氨酸(Hyp)含量的影响
鸡骨富含胶原蛋白,热压抽提过程中,胶原蛋白变成可溶性水解物溶出,其变化规律与Hyp一致[19]。Hyp含量的变化会影响凝胶强度等凝胶性质[20]。鸡骨蛋白中Hyp变化规律如图1所示。随着抽提时间延长,Hyp含量从0 min的0.08 mg·g-1显著增加到90 min的3.77 mg·g-1(<0.05),90和120 min的Hyp含量无显著性差异(>0.05)。结果表明抽提时间会显著影响Hyp含量(>0.05),抽提时间越长,鸡骨中的胶原蛋白溶出越多,但是随着提取的进行,胶原蛋白溶出速度减缓,表明大部分胶原蛋白已经被提取溶出。
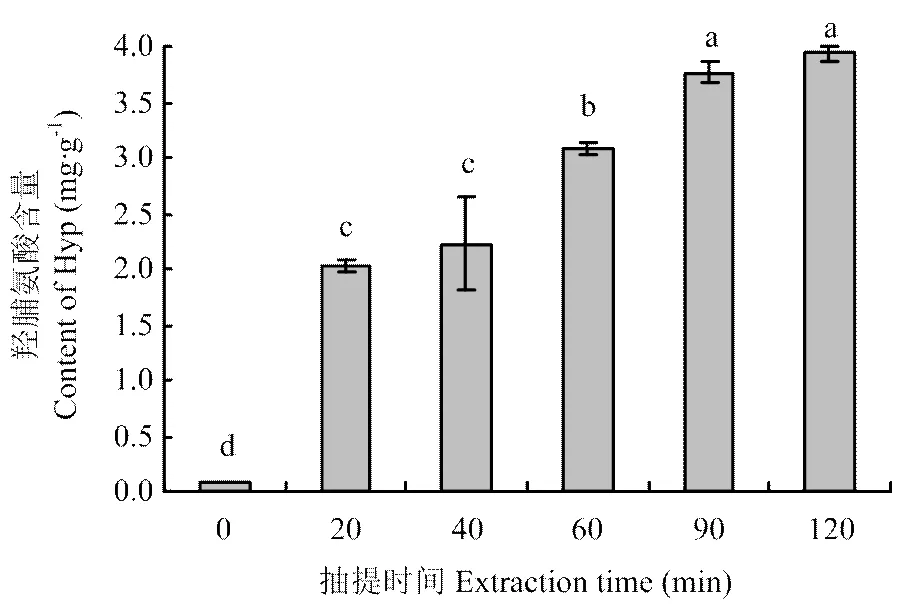
柱形图上方的不同字母表示不同时间差异显著(P<0.05)。下同
2.3 抽提时间对分子量分布(MW)的影响
分子量的变化会显著影响凝胶强度、透明度等凝胶性质[20]。表2为不同抽提时间的CBP分子量分布,可以反映蛋白的降解情况。由表2可知,随着提取时间延长(40—120 min),蛋白降解显著,分子量>30 kDa的肽段40 min 时占总蛋白的4.72%,而90 min时被全部降解;分子量在10—30 kDa的组分从40 min的59.82%降低到120 min的13.99%;而分子量<10 kDa的肽段从40 min的35.46%升高到120 min的86.01%。原因在于,随着抽提时间延长,高分子量的蛋白不断溶出,并降解为低分子量多肽和氨基酸。这与YANG等[21]的研究结果一致,YANG等[21]研究发现高温会导致蛋白质降解为小分子蛋白。KIJOWSKI等[2]也指出,鸡骨富含胶原蛋白,加热到胶原蛋白变性温度以上会导致氢键断裂、三股螺旋结构展开,蛋白降解为不同分子量的多肽段。
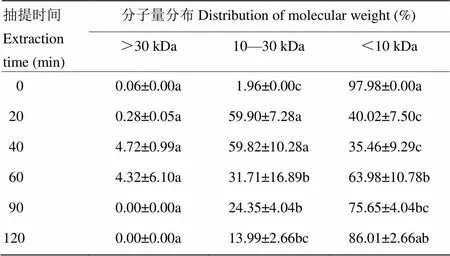
表2 凝胶分子量分布变化
2.4 抽提时间对蛋白质结构的影响
图2为不同时间提取的CBP的红外光谱图。由图2可知,不同抽提时间的谱图趋势相似,但是随着抽提时间延长而有所改变。红外光谱的改变表明蛋白结构发生转变,包括酰胺A带(2 300—3 600 cm-1)[22],酰胺Ⅰ带(1 636—1 661 cm-1),酰胺Ⅱ带(1 549— 1 558 cm-1)和酰胺Ⅲ带(1 200—1 300 cm-1)的变化[23]。MUYONGA 等[24]将1 600—1 700 cm-1归属为酰胺Ⅰ带。HASHIM等[22]将1 550—1 520 cm-1归属为酰胺Ⅱ带,并指出此频率变化与N-H键变形有关。而SUREWICZ等[25]认为酰胺Ⅱ带与存在于脂肪、蛋白质、多糖及磷酸衍生物中的基团振动有关。
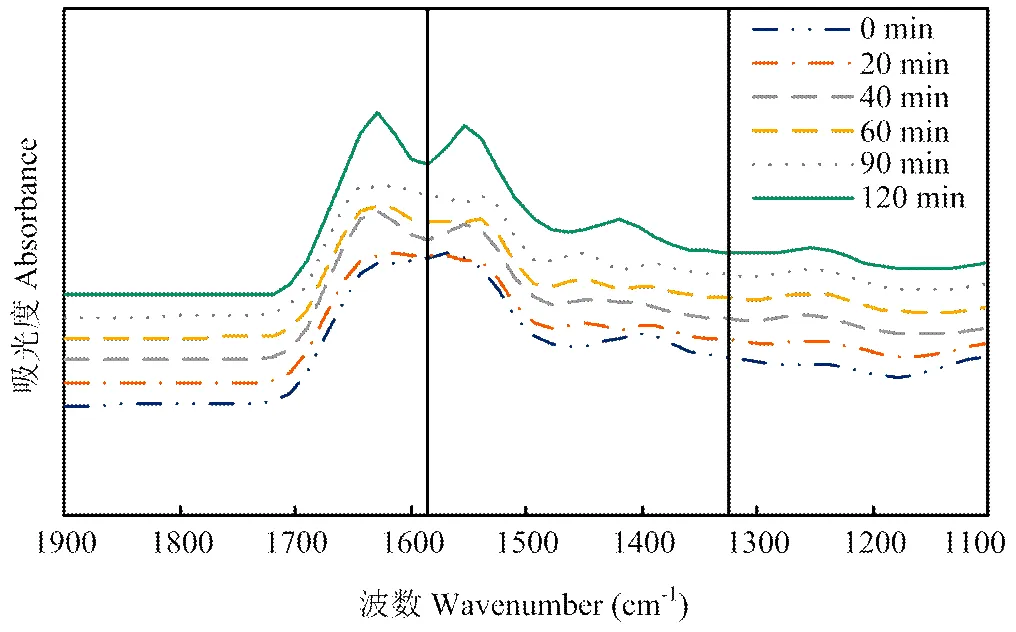
图2 热压抽提时间对蛋白质结构的影响
基于以上归属,CBP的FTIR光谱确认1 600— 1 700 cm-1为酰胺Ⅰ带,1 330—1 600 cm-1为酰胺Ⅱ带,1 200—1 300 cm-1为酰胺Ⅲ带(图2)。由图可知,与酰胺Ⅰ带和酰胺Ⅱ带相比,酰胺Ⅲ带强度较弱,这与热压提取鸡骨蛋白导致其结构破坏有关[24]。酰胺Ⅱ带变化可能是因为热处理导致N-H键变形,并且可能与构成骨架的脂肪、蛋白质、多糖和磷酸衍生物中的基团振动相关。
酰胺Ⅰ带(1 600—1 700 cm-1)主要是由C=O的伸缩振动引起,对研究蛋白质二级结构最有价值[14]。通常情况下,将1 615—1 637 cm-1和1 682—1 700 cm-1归属为β-折叠和反平行β-折叠,1 646—1 664 cm-1归属为α-螺旋,1 637—1 645 cm-1归属为无规则卷曲,1 664—1 681 cm-1归属为β-转角[14]。基于以上归属,热压抽提得到的CBP的二级结构主要由α-螺旋 (1 646、1 650和1 651 cm-1)和β-折叠(1 620、1 623 cm-1)组成,β-转角和反平行β-折叠并未观测到(表3)。0—40 min的CBP酰胺Ⅰ带由100%的α-螺旋组成,60—90 min时出现9.9%—17.6%的β-折叠结构,120 min时β-折叠全部降解。该结果与相关报道一致,MUYONGA等[24]研究表明维持鸡骨蛋白二级结构的主要作用力为氢键,热处理导致氢键破坏和蛋白降解,其中胶原蛋白三股螺旋主要分解为完整的α链。此外,ZHANG等[26]研究发现蛋白质的热变性会导致蛋白质的不可逆沉淀及β-折叠结构展开为无序结构。CBP二级结构的以上变化会影响凝胶网络结构形成而影响凝胶特性[27]。
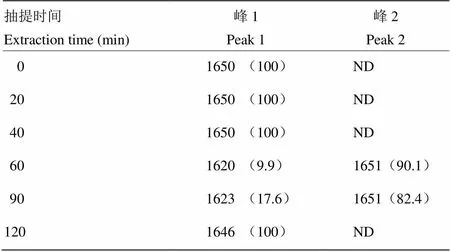
表3 峰位置和相对百分面积分布
ND表示未检出 ND means not detected
2.5 抽提时间对凝胶强度、持水性(WHC)和CBP溶液透明度的影响
通常认为凝胶强度越大,凝胶质量越好[28]。不同抽提时间的CBP凝胶强度的变化规律如图3-a所示。抽提开始时的鸡骨蛋白并未形成凝胶,20、40和60 min组的凝胶强度无显著性差异(>0.05),均显著高于90和120 min组。原因可能在于,20—60 min的CBP中高分子量组分比例高于90和120 min组,形成的凝胶网络结构更好[4],故凝胶强度较大,这与EYSTURSKARÐ等[29]的研究结果相似。此外,蛋白质二级结构的变化也会影响凝胶强度[30-31]。
WHC指离心过程中凝胶对水的保持能力,WHC越高,表明凝胶对水的保持能力越强,凝胶质量越好。由图3-b可知,不同时间提取的CBP凝胶持水性均大于90%,且无显著性差异(>0.05),表明不同抽提时间的CBP凝胶都对水有较好的保持能力。这与DE MORAES等[4]的研究结果相似,DE MORAES等[4]研究表明酸性条件下加热温度和时间对凝胶的持水性均没有影响。
制备凝胶的溶液透明度越高,凝胶可接受度越高。不同抽提时间的CBP的透明度变化规律如图3-c所示。随着抽提时间延长(20—120 min),溶液透明度显著升高(<0.05)。原因可能在于,20 min的CBP中高分子量物质比例较高,溶解性差,降低了CBP透明度,但随着抽提时间延长,大分子物质不断被降解,溶解性变好,故CBP的透明度升高,这和刘小玲[17]的研究结果一致。
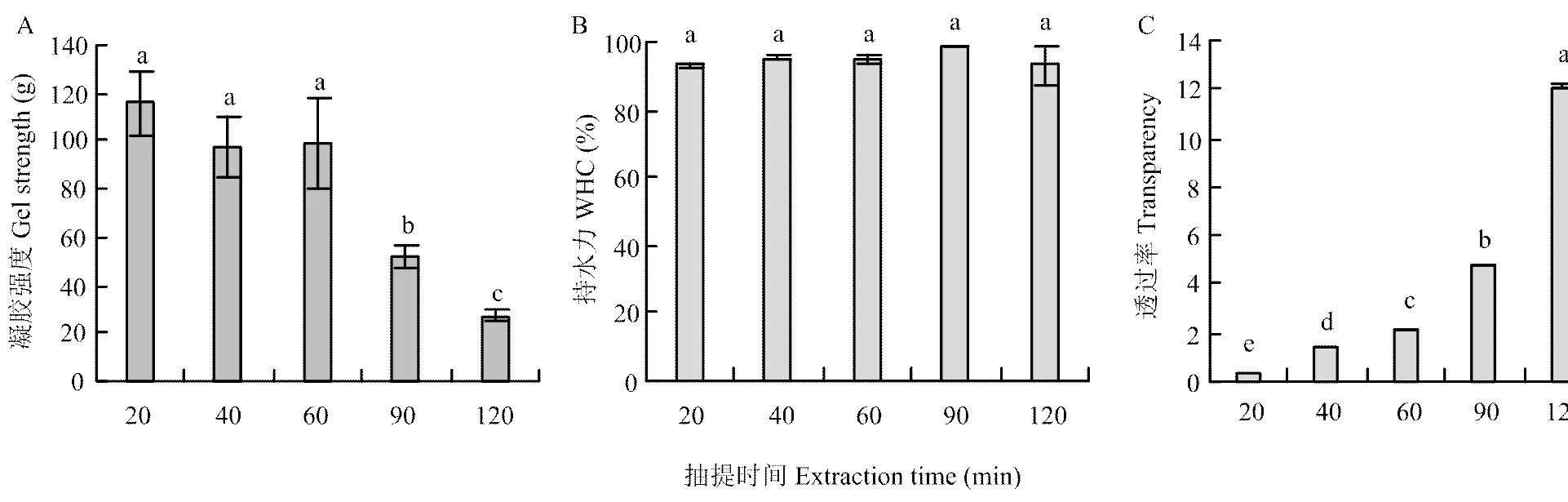
图3 热压抽提时间对凝胶强度、持水性和CBP溶液透明度的影响
2.6 抽提时间对凝胶色泽的影响
由表4可知,抽提时间会显著影响CBP凝胶的色泽(<0.05)。不同抽提时间的CBP凝胶的L*和W值差异显著(<0.05);40、60和90 min组的a*值无显著性差异(>0.05),均低于20和120 min组;20 min组的b*值最大,其他各组差异不显著(>0.05)。造成凝胶色泽差异的原因主要有两点,一是鸡骨在抽提过程中发生美拉德反应,产生褐色素使CBP颜色加深,且加热时间越长,褐变越严重,CBP颜色越深[10,31];二是将样品调至同一浓度时,浓缩倍数不同,因而颜色不同,二者共同导致凝胶色泽差异显著(<0.05)。根据优质凝胶的标准,即高亮度、低黄度、高白度[30],综合考虑CBP凝胶的L*、b*和W,40和60 min组的凝胶色泽最佳。
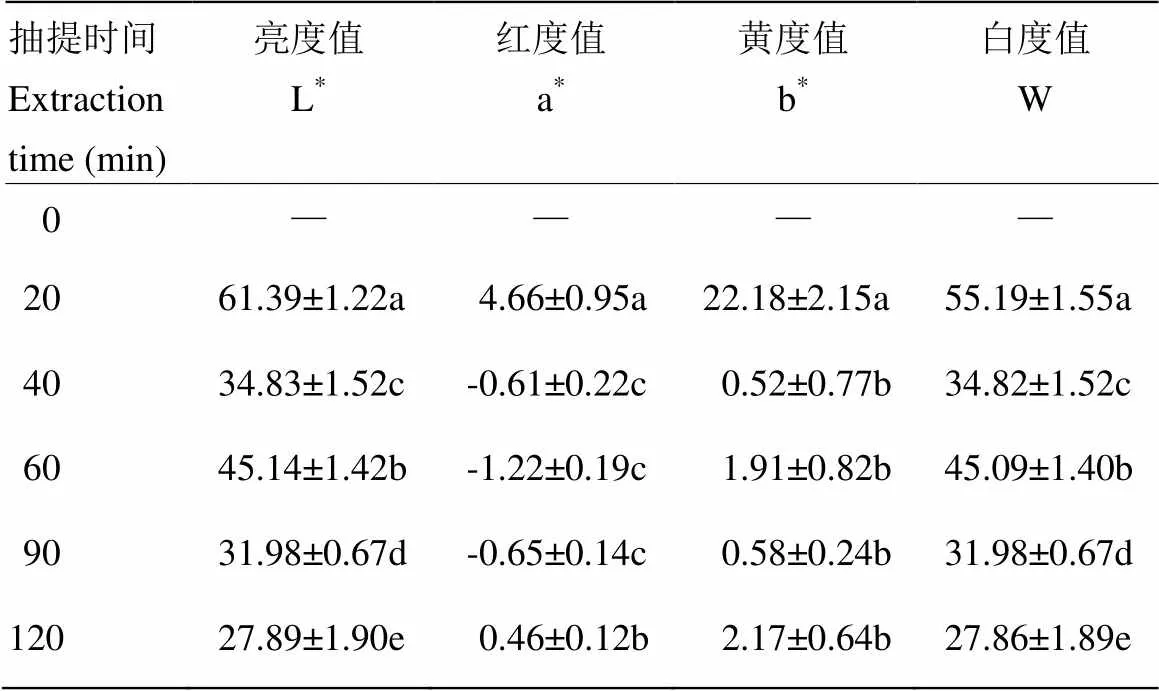
表4 凝胶色泽比较
2.7 相关性分析
表5为不同抽提时间CBP的Hyp含量、CBP降解程度与凝胶特性的相关性关系。由表5可知,凝胶强度与10—30 kDa的CBP比例极显著正相关,而与<10 kDa的CBP比例极显著负相关(<0.01),相关系数分别为0.78和-0.82,原因在于10—30 kDa蛋白比例越高,<10 kDa蛋白比例越低,形成的凝胶网络结构越好,凝胶强度越大。透过率与10—30 kDa的CBP的比例显著负相关,而与<10 kDa的CBP的比例极显著正相关(<0.01),相关系数分别为-0.70和0.75,原因在于<10 kDa的CBP溶解性优于10—30 kDa的CBP,所以<10 kDa的CBP比例越高,蛋白溶解性越好,溶液透过率较高。WHC与Hyp的含量极显著正相关(<0.01),相关系数为0.94,原因在于Hyp含量反映了鸡骨蛋白中胶原蛋白的含量,其含量越高,形成氢键数量越多,从而形成致密的凝胶网络束缚水分子的运动。L*与透过率极显著负相关(<0.01),相关系数为-0.70,因为鸡骨在抽提过程中发生美拉德反应,产生褐色素使CBP颜色加深,且加热时间越长,CBP颜色越深,同时蛋白发生降解,蛋白溶解性越好,溶液透过率较高。
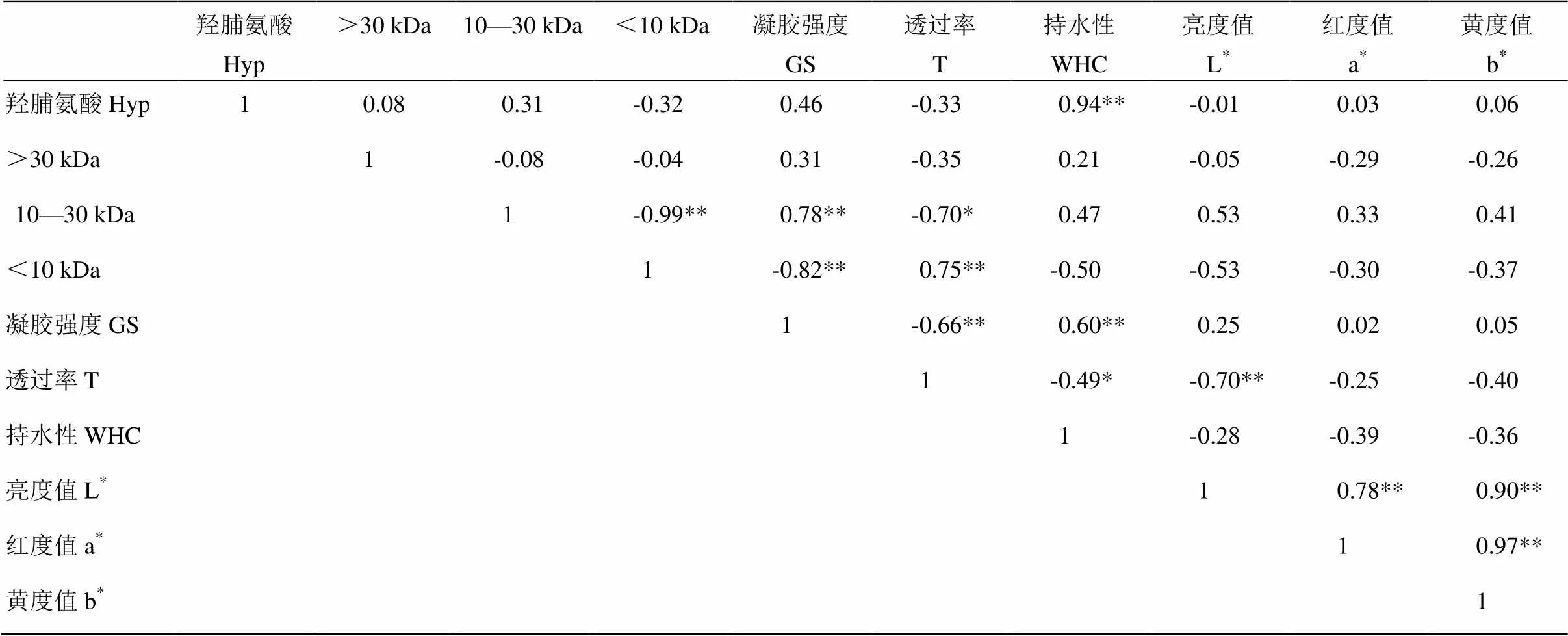
表5 不同抽提时间凝胶各指标间相关性分析
**代表在0.01水平有显著性差异,*代表在0.05水平有显著性差异
** means correlation is significant at the 0.01 level, * means correlation is significant at the 0.05 level
3 讨论
3.1 抽提时间对TSS、粗蛋白和羟脯氨酸含量的影响
鸡骨中蛋白含量约为19%,其中35%—40%为胶原蛋白。胶原蛋白由三条亚基链构成三股螺旋结构,在常温下结构稳定,溶解性较差。高温高压抽提能够使蛋白结构破坏,胶原蛋白三股螺旋结构解旋为单链而溶于水。WANG等[8]研究表明加热温度越高、时间越长,鸡骨中可溶性物质越多,粗蛋白和羟脯氨酸含量越高。本研究中,随着加热时间延长,TSS、粗蛋白和羟脯氨酸含量均显著增加(<0.05),与WANG等[8]的研究结果一致。
3.2 抽提时间对分子量分布(MW)的影响
鸡骨在抽提过程中,高分子量的蛋白降解为低分子量的蛋白,再降解为多肽、小分子肽和游离氨基酸。有研究表明高温更能促使蛋白质的降解,且加热时间越长,蛋白降解程度越高[8]。YANG等[21]指出长时间加热会导致蛋白质过度降解,高分子量组分比例降低,低分子量组分比例升高。本研究(表2)也发现,随着提取时间延长(40—120 min),蛋白发生显著降解,分子量在10—30 kDa的组分比例降低了45.83%;而分子量<10 kDa的肽段比例升高了50.55%,与上述研究结果相似。
3.3 抽提时间对蛋白质二级结构的影响
目前,FTIR广泛用于蛋白质分子结构研究,其酰胺I带(1 600—1 700 cm-1)对羰基的几何振动和氢键结构非常敏感。随着加热温度和时间的改变,蛋白二级结构发生相应变化,反映为谱图形状和强度的变化。卢雁等[32]研究表明随着加热温度的升高,蛋白质α-螺旋含量逐渐减少,β-折叠含量增加。α-螺旋是蛋白质分子内的有序排列,通过分子内氢键维持。在加热条件下其含量降低表明加热导致维持 α-螺旋的氢键作用减弱,蛋白质分子展开程度增加;β-折叠是蛋白质分子间的有序排列,通过分子间氢键维持,加热后其含量增加表明蛋白质分子间氢键作用增强,导致蛋白质分子间聚集程度增加[33]。钟朝辉等[34]研究了加热对鱼鳞胶原蛋白二级结构的影响,结果表明高温使维系胶原蛋白三螺旋结构的氢键破坏,逐渐解螺旋并转变为无规则、转角和折叠结构。本研究中,随着加热时间延长(60—90 min),α-螺旋含量降低,β-折叠含量升高,可能是加热导致α-螺旋解旋并重排为β-折叠;而120 min的β-折叠含量为零,可能是α-螺旋解旋速率越来越快,导致展开后的蛋白质来不及重排成β-折叠结构,同时已经存在的β-折叠被降解。
3.4 抽提时间对凝胶特性和溶液透明度的影响
凝胶强度是衡量凝胶质量的重要指标之一,商业凝胶的凝胶强度为100—300 g[35],主要与凝胶来源和凝胶提取方法等因素有关[19,26]。不同物种来源的胶原蛋白分子的结构组成不同、复杂程度不一,其三股螺旋分子间交联度的差异造成热稳定性不同,直接影响凝胶强度等功能特性[36]。通常,来源于猪、牛的凝胶强度为200—240 g,而鱼的凝胶强度差异较大,为0—270 g。此外,凝胶提取的热处理程度也会影响其凝胶强度。CHEN等[5]研究表明过度加热会导致低分子量组分比例升高,凝胶强度减小。DE MORAES等[4]也发现加热时间会影响蛋白质水解程度进而影响蛋白质的凝胶强度。本研究中(图3-a),20、40和60 min组的凝胶强度均高于100 g,优于90和120 min组,与CHEN等[5]研究结果一致。但是,CBP凝胶强度低于猪、牛的凝胶强度,可能是因为CBP是混合蛋白,而文献研究的是高纯度胶原蛋白的凝胶强度;此外,原料种类对其凝胶强度也有影响。
董宪兵[10]研究发现,随着抽提时间延长,CBP中高分子量组分溶解性变好,溶液透明度升高,但是会发生轻微的美拉德反应,产生褐色素使CBP颜色变深。DE MORAES等[4]也指出,高温导致蛋白质等富含羰基和氨基的物质发生美拉德反应,从而影响蛋白凝胶的色泽。本研究中不同时间的CBP凝胶色泽差异显著,即与高温下蛋白质的美拉德反应有关。
4 结论
抽提时间对总固形物、粗蛋白含量、羟脯胺酸含量和鸡骨蛋白的降解程度均有显著影响。随着抽提时间延长,总固形物、粗蛋白和羟脯胺酸含量均显著增加,粗蛋白提取率显著升高。高分子量的蛋白随着抽提时间延长不断溶出,并降解为低分子量多肽和氨基酸,提取液透明度显著升高。抽提时间对鸡骨蛋白凝胶特性有显著影响,20、40和60 min组的凝胶强度优于90和120 min组,色泽分析表明40和60 min组的鸡骨蛋白制备的凝胶色泽最佳。综上所述,提取时间为40和60 min的粗蛋白综合品质优于其他各组,因此更适合制备凝胶。
References
[1] USDA. Chickens and eggs [EB/OL]. [2015-04-21] http://usda. mannlib. cornell.edu/MannUsda/viewDocumentInfo.do?documentID=1028.
[2] Kijowski J, Niewiarowicz A. A method of protein extraction from chicken bone residue and the chemical and electrophoretic characteristics of the extract., 1985, 20(1): 43-49.
[3] 赵电波, 陈茜, 白艳红, 张小燕. 动物屠宰副产物—骨的开发利用现状. 肉类研究, 2010(1): 37-40.
Zhao D B, Chen X, Bai Y H, Zhang X Y. Development and utilization of bones from by-products of slaughtered animals., 2010(1): 37-40. (in Chinese)
[4] DE MORAES M C, CUNHA R L. Gelation property and water holding capacity of heat-treated collagen at different temperature and pH values., 2013, 50(1): 213-223.
[5] CHEN L, LIANG M, ZHOU M, LIU Y, ZHANG Y. Effects of pressure on gelatinization of collagen and properties of extracted gelatins., 2014, 36: 316-322.
[6] WANG L, LIANG Q, CHEN T, WANG Z, XU J, MA H. Characterization of collagen from the skin of Amur sturgeon ()., 2014, 38(38):104-109.
[7] 戴丹琴. 酶法提取牛皮胶原多肽及其口服液的研制[D]. 宁波: 宁波大学, 2013.
DAI D Q. Extraction of cow leather collagen peptide by enzymatic hydrolysis and preparation of its oral liquid [D]. Ningbo: Ningbo University, 2013.
[8] WANG J Z, DONG X B, YUE J Y, ZHANG C H, JIA W, LI X. Preparation of substrate for flavorant from chicken bone residue with hot-pressure process., 2016, 81(3): C578-C586.
[9] DONG X B, LI X, ZHANG C H, WANG J Z, TANG C H, SUN H M, JIA W, LI Y, CHEN L L. Development of a novel method for hot-pressure extraction of protein from chicken bone and the effect of enzymatic hydrolysis on the extracts., 2014, 157: 339-346.
[10] 董宪兵. 鸡骨副产物资源化利用与骨素(肽)风味基料开发的研究[D]. 重庆: 重庆工商大学, 2013.
Dong X B. High-value utilization of chicken bone by-products and development of ossein(peptide) flavoring [D]. Chongqing: Chongqing Technology and Business University, 2013. (in Chinese)
[11] OLIJVE J, MORI F, TODA Y. Influence of the molecular-weight distribution of gelatin on emulsion stability., 2001, 243(2): 476-482.
[12] BERTRAM H C, ENGELSEN S B, BUSK H, KARLSSON A H, ANDERSEN H J. Water properties during cooking of pork studied by low-field NMR relaxation: effects of curing and the RN−-gene., 2004, 66(2): 437-446.
[13] IRVINE G B, SHAW C. High-performance gel permeation chromatography of proteins and peptides on columns of TSK- G2000-SW and TSK-G3000-SW: a volatile solvent giving separation based on charge and size of polypeptides., 1986, 155(1): 141-148.
[14] 李侠, 孙圳, 杨方威, 张春晖, 谢小雷. 适宜冻结温度保持牛肉蛋白稳定性抑制水分态变. 农业工程学报, 2015, 31(23): 238-245.
LI X, SUN Z, YANG F W, ZHANG C H, XIE X L. Appropriate freezing temperature to maintain beef protein stability and inhibit myowater state changes., 2015, 31(23): 238-245. (in Chinese)
[15] PANG Z, DEETH H, SOPADE P, SHARMA R, BANSAL N. Rheology, texture and microstructure of gelatin gels with and without milk proteins., 2014, 35: 484-493.
[16] ZHOU F, ZHAO M, ZHAO H, SUN W, CUI C. Effects of oxidative modification on gel properties of isolated porcine myofibrillar protein by peroxyl radicals.e, 2014, 96(4): 1432-1439.
[17] 刘小玲. 鸡骨明胶的制备, 结构及功能性质研究[D]. 无锡: 江南大学, 2005.
LIU, X L. Study on preparation of chicken bone gelatin and its structure and functional properties [D]. Wuxi: Jiangnan University, 2005. (in Chinese)
[18] 王春青, 李侠, 张春晖, 陈旭华, 孙红梅, 李银, 李海, 何雷堂. 肌原纤维特性与鸡肉原料肉品质的关系. 中国农业科学, 2014, 47(10): 2003-2012.
WANG C Q, LI X, ZHANG C H, CHEN X H, SUN H M, LI Y, LI H, HE L T. Study on relationship between myofibril characteristics and meat quality of chicken raw meat., 2014, 47(10): 2003-2012. (in Chinese)
[19] 董宪兵, 李侠, 张春晖, 孙红梅, 李银. 分光光度法测定畜禽骨素中胶原蛋白含量. 现代食品科技, 2013, 29(10): 2538-2541.
DONG X B, LI X, ZHANG C H, SUN H M, LI Y. Determination of collagen content in livestock and poultry ossein by spectrophotometry., 2013, 29(10): 2538-2541. (in Chinese)
[20] DUAN R, ZHANG J J, XING F F, KONNO K, XU B. Study on the properties of gelatins from skin of carp () caught in winter and summer season., 2011, 25(3): 368-373.
[21] YANG H, WANG Y, JIANG M, OH J H, HERRING J, ZHOU P. 2-step optimization of the extraction and subsequent physical properties of channel catfish () skin gelatin., 2007, 72(4): C188-C195.
[22] HASHIM D M, MAN Y B C, NORAKASHA R, SHUHAIMI M, SALMAH Y, SYAHARIZA Z A. Potential use of Fourier transform infrared spectroscopy for differentiation of bovine and porcine gelatins.ry, 2010, 118(3): 856-860.
[23] FRIESS W, LEE G. Basic thermoanalytical studies of insoluble collagen matrices., 1996, 17(23): 2289-2294.
[24] MUYONGA J H, COLE C G B, DUODU K G. Fourier transform infrared (FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch ()., 2004, 86(3): 325-332.
[25] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra., 1988, 952: 115-130.
[26] ZHANG H, ISHIKAWA Y, YAMAMOTO Y, CARPENTIER R. Secondary structure and thermal stability of the extrinsic 23 kDa protein of photosystem II studied by Fourier transform infrared spectroscopy., 1998, 426(3): 347-351.
[27] 曹莹莹, 张亮, 王鹏, 周光宏, 徐幸莲. 超高压结合热处理对肌球蛋白凝胶特性及蛋白二级结构的影响. 肉类研究, 2013, 27(1): 1-7.
CAO Y Y, ZHANG L, WANG P, ZHOU G H, XU X L. Combined effect of ultra-high pressure and heating on gel properties and secondary structure of myosin., 2013, 27(1): 1-7. (in Chinese)
[28] YANG H, WANG Y, PENG Z, JOEM R. Effects of alkaline and acid pretreatment on the physical properties and nanostructures of the gelatin from channel catfish skins., 2009, 22(8): 1541-1550.
[29] EYSTURSKARÐ J, HAUG I J, ULSET A S, JOENSEN H, DRAGET K I. Mechanical properties of mammalian and fish gelatins as a function of the contents of α-chain, β-chain, and low and high molecular weight fractions., 2010, 5(1): 9-16.
[30] 秦影, 汤海青, 欧昌荣, 曹锦轩. 超高压处理对大黄鱼鱼糜水分状态和蛋白质结构的影响. 农业工程学报, 2015, 31(23): 246-252.
QIN Y, TANG H Q, OU C R, CAO J X. Effect of ultra-high pressure on moisture status and protein structure of large yellow croaker surimi gel., 2015, 31(23): 246-252. (in Chinese)
[31] AHMAD M, BENJAKUL S. Characteristics of gelatin from the skin of unicorn leatherjacket () as influenced by acid pretreatment and extraction time., 2011, 25(3): 381-388.
[32] 卢雁, 张玮玮, 王公轲. FTIR用于变性蛋白质二级结构的研究进展.光谱学与光谱分析, 2008, 28(1): 88-93.
LU Y, ZHANG W W, WANG G K. Progress in study of secondary structure of denaturized protein by FTIR., 2008, 28(1): 88-93. (in Chinese)
[33] 杨玉玲, 游远, 彭晓蓓, 陈银基. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响. 中国农业科学, 2014, 47(10): 2013-2020.
YANG Y L, YOU Y, PENG X B, CHEN Y J. Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle., 2014, 47(10): 2013-2020. (in Chinese)
[34] 钟朝辉, 李春美, 顾海峰, 窦宏亮, 周丽明. 温度对鱼鳞胶原蛋白二级结构的影响. 光谱学与光谱分析, 2007, 27(10): 1970-1976.
ZHONG C H, LI C M, GU H F, DOU H L, ZHOU L M. Effect of temperature on the secondary structure of fish scale collagen., 2007, 27(10): 1970-1976. (in Chinese)
[35] KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins., 2009, 23(3): 563-576.
[36] SHOULDERS M D, RAINES R T. Collagen structure and stability., 2009, 78(78): 929-958.
(责任编辑 赵伶俐)
Effect of Extraction Time on Characteristics of Gelatin and Secondary Structure of Chicken Bone Protein
YUE JianYing1, WANG JinZhi1, ZhANG ChunHui1, DU GuiHong2, XU Xiong2
(1Institute of Agro-Products Processing Science and Technology, Chinese Academy of Agricultural Sciences/Comprehensive Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Beijing 100193;2Hebi Protil Biotechnology Co., Ltd, Hebi 456750, Henan)
【Objective】Hot-pressure extraction was utilized to prepare chicken bone protein (CBP) to study the effect of extraction time on gelatin properties. The study was expected to provide a reference for the preparation technology of edible gelatin by using chicken bone by-products. 【Method】After being adjusted to the same concentration of protein, CBP at different extraction times were incubated at 4℃ to form gelatin. The content of total soluble substance (TSS), crude protein and hydroxyproline (Hyp), secondary structure of protein and distribution of molecular weight (MW), as well as color of gelatin and gel strength were studied. Furthermore, correlation analysis between indexes of CBP was also performed to establish possible linkages between physicochemical properties and gelatin properties of CBP.【Result】The results showed that hot-pressure extraction time had a significant effect on the yield of CBP (<0.05), leading to the variable structure of protein and consequently affected the properties of gelatin made by CBP. The contents of TSS, crude protein and Hyp were increased significantly during extraction (0-120 min) (<0.05). The result of MW distribution suggested that protein experienced dramatic degradation from 40 to 120 min (<0.05). The proportion of MW between 10 and 30 kDa decreased from 59.82% (40 min) to 13.99% (120 min) while the ratio of MW<10 kDa increased from 35.46% (40 min) to 86.01% (120 min). In addition, the extraction time caused the denaturation of protein and thus leading to the change of secondary structure. The CBP was composed of 100 percent of α-helix (0-40 min), and then β-sheet emerged at 60 and 90 min (9.9% and 17.6%, respectively) but disappeared at 120 min, which indicated that the secondary structure of protein experienced transformation during extraction. Results of CBP gelatin properties suggested that CBP at 0 min could not form a gelatin and thus had no gelatin properties. Gel strength at 20, 40 and 60 min was at same level and better than CBP gelatins of 90 and 120 min. In addition, transparency of CBE solutions was significantly impacted by extraction time, which increased sharply during hot-pressure extraction (20-120 min) (<0.05). Meanwhile, extraction time significantly affected the color of gelatins (<0.05) and gelatin at 40 and 60 min met the requirements of high lightness, low yellowness and high whiteness. However, water holding capacity was insensitive to the extraction time (>0.05). Correlation analysis showed that the content of Hyp, degradation of protein were considerably related to gelatin properties (<0.05).【Conclusion】In conclusion, extraction time could significantly affect the gelatin properties prepared by CBP at different extraction times. Given yield of protein, color of gelatin, gel strength, etc., CBP extracted at 40 min and 60 min were better proper for preparation of gelatin.
chicken bone protein; hot-pressure extraction; extraction time; gelatin properties; secondary structure
2016-03-18;接受日期:2016-12-21
国家自然科学基金(31401623)、对发展中国家科技援助项目(KY201401005)
岳鉴颖,E-mail:13161134960@163.com。 通信作者张春晖,Tel:010-62815950;E-mail:dr_zch@163.com

