北京协和医院桦树花粉变应原点刺液对桦树花粉过敏症的诊断价值
顾建青汤 蕊王瑞琦周俊雄尹 佳王良录支玉香孙劲旅李 宏文利平关 凯李丽莎王子熹徐 涛
[中国医学科学院北京协和医学院北京协和医院变态 (过敏)反应科过敏性疾病精准诊疗研究北京市重点实验室中国医学科学院临床免疫研究中心,北京100730]
桦树主要分布于北温带,在欧洲国家,桦树花粉是全年中最重要的致敏花粉,数量达到禾本科花粉的2倍以上[1]。我国北方地区桦树同样也广泛分布,北京城区空气中花粉分析显示,桦树花粉的含量占全年花粉总量的5.99%,是我国北方地区重要的春季致敏花粉,仅次于白蜡树、柏科和杨属花粉[2]。对20万项次过敏原特异性免疫球蛋白E(specific immunoglobulin E,sIgE)检测结果显示,桦树花粉sIgE的阳性检出率为45.1%,致敏率高[3]。
皮肤试验是诊断过敏性疾病最常用的体内诊断方法,主要包括皮内试验和皮肤点刺试验 (skin prick test,SPT)。1959年,Ebruster首次报道了 SPT用于过敏性疾病的诊断,与皮内试验相比,SPT具有操作简便、患者耐受性好、特异度高、重复性好、与临床相关性好、不良反应发生率低等优点,因此被欧洲变态反应和临床免疫学会 (European Academy of Allergy and Clinical Immunology,EAACI)推荐为诊断过敏性疾病的首选检查方法[4-5]。但在国内,目前仍主要以皮内试验的方法诊断包括花粉在内的吸入性变应原,而部分已开展花粉变应原点刺试验进行过敏性疾病诊断时采取的阳性判断标准也不尽相同[6-8]。本研究旨在以变应原sIgE检测值作为临床诊断标准,评价北京协和医院桦树花粉变应原 (简称协和桦树花粉变应原)SPT诊断桦树花粉过敏症的有效性和安全性,并确定SPT最佳诊断界值。
资料与方法
对象
选择2015年8月10日至2016年10月20日在北京协和医院变态 (过敏)反应科就诊,患有过敏性鼻炎、过敏性哮喘、过敏性结膜炎、过敏性皮炎、荨麻疹等过敏性疾病的门诊患者。本研究得到北京协和医院伦理委员会批准,所有受试者均签署书面知情同意书。
入选标准:年龄4~70岁;男女不限;已完成桦树花粉皮内试验和 (或)sIgE检测。
排除标准:妊娠期及哺乳期妇女;试验前未停用抗组胺药物或停药时间小于药物5个半衰期;正在服用全身糖皮质激素;皮肤划痕征阳性;试验部位有皮肤感染、皮炎或外伤、瘢痕等病理变化;银屑病;过敏性疾病急性发作期 (如过敏性哮喘急性发作);有严重影响全身状态的疾病 (包括严重的高血压、冠心病等);目前正在应用β受体阻滞剂治疗 (包括局部应用);3个月内参加过其他药物临床试验;研究者认为不适合参加试验的其他情况。
剔除标准:不符合入选标准或符合排除标准;桦树花粉血清sIgE结果缺失;SPT阳性或阴性对照数据缺失;SPT阳性对照出现阴性反应 [平均风团直径(mean wheal diameter,MWD) <3 mm],或阴性对照出现阳性反应者 (MWD≥3 mm)。
方法
本研究采用单中心、平行分组的设计方法。
所有入选的受试者同时接受包括圆柏、桦树、梧桐、洋白蜡4种春季花粉变应原点刺液以及阴性对照、阳性对照在内的SPT,SPT后留观1 h。本研究所用点刺液均由北京协和医院变应原制剂室生产:桦树花粉变应原点刺液批号为201508D002,于2~8℃保存。阴性对照为缓冲盐水甘油溶液,阳性对照为5 mg/ml磷酸组胺缓冲盐水甘油溶液。点刺针选用施莱TM一次性使用采血针 (片式点刺针),由淮安蓝星塑料器械开发有限公司生产。
SPT在受试者前臂屈侧皮肤进行,方法参照欧洲标准[5],点刺后15 min观察结果。以皮肤点刺后出现的风团大小为判断标准,用MWD表示。先测量风团的最长径为风团长轴 (D),于长轴的中点做长轴的垂线,以垂线形成的直径为风团短轴 (d)。MWD=(D+d)/2。同时观察并记录受试者在SPT后15 min、1 h以及6 h后出现的不良事件。
SPT后采集受试者血清进行桦树花粉变应原sIgE检测,应用ImmunoCAP®系统 (Phadia AB)的全自动荧光免疫分析仪Phadia®1000及配套试剂。
研究流程见表1。

表1 研究流程Table 1 Research process
统计学处理
以桦树花粉变应原sIgE检测结果为过敏原特异度诊断的相对金标准:sIgE≥0.35 kUA/L为阳性组,sIgE<0.35 kUA/L为阴性组。
进行受试者工作特征曲线 (receiver operating characteristic curve,ROC曲线)分析,计算ROC曲线下面积 (area under curve,AUC),估算SPT最佳诊断界值及特异度达95%时的诊断界值。分析桦树花粉SPT的敏感度、特异度、阳性预测值和阴性预测值。对不良事件的表现、严重程度、转归以及与SPT的关系等进行总结。
结 果
一般情况
本研究共计入组1 029例,无脱落病例,其中22例受试者的桦树花粉变应原sIgE结果缺失,不进入全分析集 (full analysis set,FAS),FAS共1 007例。另有不符合入选标准72例,阴性对照出现阳性反应104例,阳性对照出现阴性反应86例,无阴性、阳性对照1例。共剔除264例,剔除率25.66%,符合方案集 (per protocol set,PPS)765例。
FAS受试者的平均年龄为 (32.14±13.69)岁,最小5.68岁,最大65.28岁;男509例 (50.55%),女498例 (49.45%)。PPS受试者平均年龄为(32.55±13.62)岁,最小5.68岁,最大65.28岁;男392例 (51.24%),女373例 (48.76%)。
PPS的SPT组胺阳性对照MWD为 (4.74±1.38)mm,最小值3.00 mm,最大值25.50 mm。
所有受试者均有安全性评估记录,安全数据集(save set,SS) 为1 029例。
有效性评价
以桦树花粉变应原sIgE检测为标准,采用SPT诊断桦树花粉过敏的ROC曲线:FAS的AUC为0.909,95%可信区间为0.891~0.928;PPS的 ROC曲线AUC为0.919,95%可信区间为0.898~0.939(图1)。由FAS的ROC曲线确定最佳诊断界值为4.25mm,特异度达95%时的诊断界值为5.75 mm。由PPS的ROC曲线确定最佳诊断界值为4.25 mm,特异度达95%时的诊断界值为5.25mm。

图1 协和桦树花粉变应原用于诊断桦树花粉过敏的受试者工作特征曲线Fig 1 Receiver operating characteristic curve of birch allergen used to diagnose birch pollen allergy FAS:全分析集;PPS:符合方案集
分别以桦树花粉点刺试验结果MWD 3.00、4.25及5.75mm为诊断界值,SPT诊断桦树花粉过敏症的准确性见表2、3。
安全性分析
SS共纳入1 029例受试者,在整个研究过程中共6例出现了7次不良事件,不良事件发生率0.58%(6/1 029),这些不良反应均被认为与受试者接受的变应原SPT相关。本研究不良事件表现为鼻痒、喷嚏、流涕、鼻塞、眼痒以及点刺局部皮肤出现较大风团反应等 (表4)。所有不良事件均为轻度,无需特殊处理,且均可自行缓解。本研究过程未发生严重不良事件。
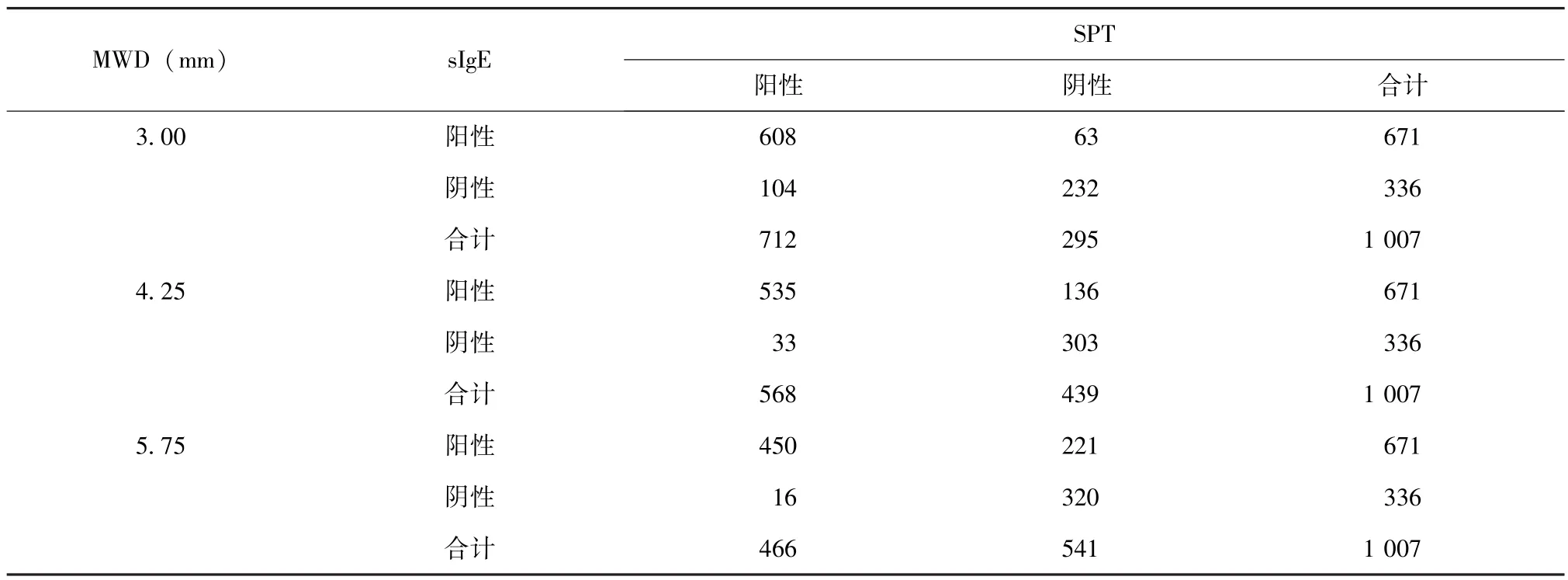
表2 以SPT不同界值诊断桦树花粉过敏症的病例分布 (FAS)Table 2 Diagnosis of birch pollen allergy with different boundary values of skin prick test(FAS)(n)

表3 以SPT不同界值诊断桦树花粉过敏症的的准确性 (FAS)Table 3 Accuracy of diagnosis of birch pollen allergy by different skin prick tests(FAS)

表4 不良事件分类及其发生率Tab le 4 Classification and incidence rate of adverse events
讨 论
在大多数情况下,过敏性疾病的标准诊断方法是基于详细的临床病史以及通过皮肤试验或体外测试明确的与临床病史一致的相关过敏原。过敏原激发试验作为诊断过敏性疾病的金标准,长期以来一直作为研究过敏性疾病发病机制或者抗过敏药物疗效的研究手段,由于激发试验可能诱发严重过敏反应等安全问题同时缺乏标准化的操作规程,而且随着目前体外检测方法的进步以及高质量的标准化变应原用于皮肤试验,激发试验已很少用于变态反应临床工作[9]。
20世纪70年代以来,过敏原体外诊断得到飞速发展。瑞典Pharmacia公司率先使用荧光酶联免疫法 (ImmunoCAP®系统)进行过敏原sIgE检测,目前该方法是国际上应用最为广泛的过敏原sIgE检测方法,具有很好的重复性与临床相关性[10]。北京协和医院于1992年将该检测方法引入国内以来,该检测系统在国内得到广泛应用,多年来的临床资料显示,ImmunoCAP®系统用于过敏性疾病的特异性诊断准确可靠[11]。国外很多研究资料也表明,SPT与ImmunoCAP®血清 sIgE检测结果一致性好[12-15]。EAACI推荐,对于常见花粉和宠物过敏原,依据临床病史,辅以SPT和 (或)sIgE检测结果,即可做出过敏原特异性诊断[4]。本研究以血清sIgE检测为相对金标准,评价SPT用于桦树花粉过敏原特异性诊断的有效性。
点刺针的种类多样,用不同的点刺针进行SPT的比较研究显示,针尖1.0 mm长的单头Lancet钢针的重复性最好,假阴性和假阳性少,受试者疼痛感轻[16-17]。但由于目前国内尚无变应原点刺试验的专用点刺针,故本研究选用由淮安蓝星塑料器械开发有限公司生产的一次性钢片式点刺针。
进行点刺试验时,点刺针穿过液滴垂直刺入皮肤,需停留至少1 s,点刺压力适中,如果压力过轻针尖没有刺入上皮,会造成假阴性反应;如果刺入过深引起出血,会造成假阳性反应。由于本研究所用的点刺针是原本用于采集指血的采血针,针尖稍大,容易刺入表皮,造成出血或假阳性反应,或者操作护士为了避免出血,用力过轻,造成假阴性反应,因此本研究的剔除病例数较多。但剔除后的PPS研究结果与FAS的分析结果一致。
SPT除了受点刺针、操作者手法的影响外,还受到受试者皮肤条件、用药史等多方面的影响,为了保证点刺试验结果的准确性,需同时加做阴性对照和阳性对照。阴性对照通常选用过敏原制剂提取缓冲液。阴性对照出现阳性反应的可能原因包括:受试者皮肤划痕征阳性,或操作者点刺时用力过度。为避免过敏原点刺试验结果解释困难,本研究剔除了阴性对照出现阳性反应者。阳性对照通常选用组胺溶液,目前欧洲推荐使用的是10 mg/ml盐酸组胺,引起皮肤反应的 MWD约7 mm(5.4~8.5 mm)[18]。因盐酸组胺的药用制剂在国内不易获得,故本研究选用的是5mg/ml磷酸组胺,组胺基质浓度约相当于3 mg/ml的盐酸组胺。结果显示,5 mg/ml磷酸组胺阳性对照引起皮肤反应的MWD为 (4.74±1.38)mm(3.0~25.5mm)。
阳性对照出现阴性反应的主要原因是合并用药对皮肤反应的抑制作用,常见对皮肤反应有抑制作用的药物,包括抗组胺药、皮质激素全身大剂量应用或试验部位局部应用、抗抑郁药、奥马珠单抗等[5],研究者在筛选期应仔细询问受试者合并用药种类和停用时间等,对有相关合并用药者予以排除。为保证试验结果的准确性,本研究剔除了阳性对照出现阴性结果者。
SPT后15 min观察和记录结果。本研究用记号笔沿风团和红晕的外缘描绘出其形状,然后用透明胶带平贴在风团与红晕上,使记号笔描绘的颜色转印至胶带上,揭起胶带贴于研究记录纸上。统一量取记录纸上的内缘直径作为测量依据。
风团大小可以用扫描面积、MWD或D表示,有研究显示,扫描面积可以最准确地反映风团大小[19-20],但量取方法比较复杂,不宜临床常规使用;当风团面积>17 mm2时,D能更好地反映风团大小,而且更易于量取;但MWD仍然最常用,MWD≥3 mm为SPT阳性。虽然皮肤对组胺的反应有个体差异,但这种差异与过敏原引起的皮肤反应无关[21],所以SPT结果的判读无需以组胺阳性对照的反应大小为标准。红晕反应的重复性差,不能作为SPT结果判读的参考指标。
ROC曲线是对所有可能的阈值作计算显示敏感度和特异度之间的相互关系,能动态、客观地反映诊断系统的效能。以敏感度为纵坐标,以 (1-特异性)为横坐标绘制曲线,AUC越大,诊断准确度越高。ROC曲线AUC为0.5~1.0,AUC越接近于1.0,说明诊断效果越好。通过ROC曲线能确定检测系统的最佳工作点,通常以阳性似然比、Youden指数、敏感度与特异度之和或平方和最大的一点的数据定为诊断临界值,此时准确率最大;但在实际应用中,需要考虑临床、经济等多种因素,明确误诊、漏诊带来的后果,有无补救措施等情况综合考虑,最终确定一个诊断临界值[22]。
对于SPT的MWD这一连续性资料,本研究采用了ROC曲线分析。ROC曲线AUC为0.909(95%可信区间0.891~0.928),因此可认为协和桦树花粉变应原用于桦树花粉过敏症的特异性诊断的准确度较高。
由ROC曲线分析推算最佳阈值为4.25 mm,特异度达95%时的阈值为5.25 mm。以国际推荐的MWD 3mm作诊断界值时,试验敏感度为0.906 1(95%可信区间0.884 0~0.928 2);以4.25mm作诊断界值时,试验敏感度为0.797 3(95%可信区间0.766 9~0.827 7)。因为SPT操作简便,价格便宜,常用于过敏原的初步筛查,需要保证较高的敏感度,减少漏诊率,所以选择3 mm作为协和桦树花粉变应原点刺试验的诊断界值为宜。以5.25 mm作诊断界值时,试验特异度为0.952 4(95%可信区间0.929 6~0.975 2),阳性预测值为0.965 7(95%可信区间0.949 1~0.982 2),即桦树花粉点刺试验MWD达5.25 mm的受试者中,有95%以上过敏原sIgE检测阳性,误诊率<5%。以上结果提示在结合临床病史的前提下,桦树花粉变应原SPT MWD>5.25 mm时,基本无需进行过敏原sIgE检测,即可做出过敏原特异性诊断;当5.25mm>MWD≥3mm时,过敏可能性大,需进行sIgE检测以明确诊断;当 MWD<3 mm时,如无春季花粉过敏的相关病史,则可基本排除桦树花粉过敏的诊断。Kanceljak-Macan等[23]的研究也发现对于不同的螨类变应原SPT也存在不同的最佳诊断界值。
点刺试验的不良反应有皮肤局部反应、迟发反应、全身性皮疹、鼻炎、哮喘和过敏性休克等全身反应。本试验1 029例共发生6例与变应原点刺试验有关的不良事件,表现为注射部位大风团或多个风团,鼻痒、流涕、喷嚏、鼻塞、眼痒。所有不良反应症状轻微,无需处理。试验中未出现严重过敏反应 (如过敏性休克等),说明该诊断试剂的安全性高。
Liccardi等[24]对皮肤试验进行的一项回顾性研究指出,1985至2005年皮肤试验共发生致死性事件7例,其中SPT未发生一例。其他欧洲的研究报道也显示,SPT引起严重过敏反应的风险为0.005%~0.008%[25]。尽管点刺试验出现严重不良反应的概率很低,但因为可能出现一些致死性的严重不良反应(如过敏性休克),因此需要经由专业的医护人员实施SPT,并至少观察30 min,进一步提高SPT的安全性。
综上所述,采用协和桦树花粉变应原进行SPT,操作简便,安全性好,用于桦树花粉过敏症特异性诊断的价值较高,可作为临床辅助检查方法。
[1]Smith M,Jäger S,Berger U,etal.Geographic and temporal variations in pollen exposure across Europe[J].Allergy,2014,69:913-923.
[2]何海娟,王良录,张宏誉.北京城区空气中花粉分析[J].中华临床免疫和变态反应杂志,2008,2:179-183.
[3]王瑞琦,张宏誉.万项次过敏原特异性IgE检测结果[J].中华临床免疫和变态反应杂志,2012,6:18-23.
[4]Position paper:Allergen standardization and skin tests.The European Academy of Allergology and Clinical Immunology[J].Allergy,1993,48:48-82.
[5]Heinzerling L,Mari A,Bergmann KC,et al.The skin prick test-European standards[J].Clin Transl Allergy,2013,3:3.
[6]刘文通,吴艳蓉,张娟.宁夏吴忠地区过敏性鼻炎过敏原筛查 260例 [J].宁夏医学杂志,2013,35:266.
[7]孙坚,周世良,刘晓静,等.皮肤过敏原点刺试验553例分析 [J].中山大学学报 (医学科学版),2009,30:104-106.
[8]李文静,刘光辉.圆柏花粉点刺试验阳性患者临床特点分析 [J].中国实用内科杂志,2014,34:610-611.
[9]Agache I,BilòM,Braunstahl GJ,et al.In vivodiagnosis of allergic diseases--allergen provocation tests[J].Allergy,2015,70:355-365.
[10]Paganelli R,Ansotegui IJ,Sastre J,et al.Specific IgE antibodies in the diagnosis of atopic disease.Clinical evaluation of a new in vitro test system,UniCAP,in six European allergy clinics[J].Allergy,1998,53:763-768.
[11]王瑞琦,张宏誉.CAP系统检测过敏原特异性IgE抗体的方法学评价 [J].临床检验杂志,2007,25:109-110.
[12]Crobach MJ,Hermans J,Kaptein AA,et al.The diagnosis of allergic rhinitis:how to combine the medical history with the results of radioallergosorbent tests and skin prick tests[J].Scand JPrim Health Care,1998,16:30-36.
[13]Droste JH,KerhofM,de Monchy JG,etal.Association of skin test reactivity,specific IgE,total IgE,and eosinophils with nasal symptoms in a community-based population study.The Dutch ECRHSGroup[J].JAllergy Clin Immunol,1996,97:922-932.
[14]Chauveau A,Dalphin ML,Mauny F,et al.Skin prick tests and specific IgE in 10-year-old children:Agreement and association with allergic diseases[J].Allergy,2017,72:1365-1373.
[15]Visitsunthorn N,Sripramong C,Bunnag C,et al.Comparison between specific IgE levels and skin prick test results of local and imported American cockroach,dog,cat,dust mites and mold allergen extracts[J].Asian Pac JAllergy Immunol,2017,35:60-65.
[16]CarrWW,Martin B,Howard RS,et al.Comparison of test devices for skin prick testing[J].J Allergy Clin Immunol,2005,116:341-346.
[17]Werther RL,Choo S,Lee KJ,et al.Variability in skin prick test results performed by multiple operators depends on the device used[J].World Allergy Organ J,2012,5:200-204.
[18]Malling HJ.Skin prick testing and the use of histamine references[J].Allergy,1984,39:596-601.
[19]van der Valk JP,Gerth van Wijk R,Hoorn E,et al.Measurement and interpretation of skin prick test results[J].Clin Transl Allergy,2016,6:8.
[20]Konstantinou GN,Bousquet PJ,Zuberbier T,etal.The longest wheal diameter is the optimal measurement for the evaluation of skin prick tests[J].Int Arch Allergy Immunol,2010,151:343-345.
[21]Bernstein IL,Storms WW.Practice parameters for allergy diagnostic testing.Joint Task Force on Practice Parameters for the Diagnosis and Treatment of Asthma.The American Academy of Allergy,Asthma and Immunology and the American College of Allergy,Asthma and Immunology[J].Ann Allergy Asthma Immunol,1995,75:543-625.
[22]陈卫中,潘晓平,宋兴勃,等.ROC曲线中最佳工作点的选择 [J].中国卫生统计,2006,23:157-158.
[23]Kanceljak-Macan B,Macan J,Plavec D,et al.The 3 mm skin prick test(SPT)threshold criterion is not reliable for Tyrophagus putrescentiae:the re-evaluation of SPT criterion to dust mites[J].Allergy,2002,57:1187-1190.
[24]LiccardiG,D'Amato G,Canonica GW,et al.Systemic reactions from skin testing:literature review[J].J Investig Allergol Clin Immunol,2006,16:75-78.
[25]Sleeaturay P,Nasser S,Ewan P.The incidence and features of systemic reactions to skin prick tests[J].Ann Allergy Asthma Immunol,2015,115:229-233.

