金耳发酵液多糖的制备、分析及生物活性研究
邓 超, 付海田, 尚京迎, 乔祉琦, 赵 楚, 陈敬华*
金耳发酵液多糖的制备、分析及生物活性研究
邓 超1, 付海田2, 尚京迎2, 乔祉琦1, 赵 楚1, 陈敬华*2
(1.江南大学 无锡医学院,江苏 无锡214122;2.江南大学 药学院,江苏 无锡214122)
探讨了金耳发酵液多糖的化学成分和生物活性。通过液体发酵法获得了金耳发酵液多糖,分别采用苯酚硫酸法、气相色谱-质谱联用技术(GC-MS)、凝胶渗透色谱(GPC)、红外光谱对其总糖含量、单糖组成、相对分子质量、糖苷键类型进行测定。此外,对金耳发酵液多糖的体外抗氧化和体内降血糖活性进行了研究。结果表明,金耳发酵液多糖总糖质量分数为85.85%,主要的单糖组成为甘露糖、葡萄糖和半乳糖,相对分子质量为14 000,主链以β糖苷键相连。具有一定的还原能力以及较强的清除DPPH和羟基自由基活性,可显著降低四氧嘧啶诱导的糖尿病小鼠血糖含量。
金耳;发酵;多糖;制备;化学分析;生物活性
金耳,俗称脑耳,隶属于担子菌亚门,银耳目、银耳科、银耳属,主要分布于中国云贵高原,是一种稀有的珍贵药食用真菌。近年来,对金耳多糖的研究主要集中于子实体多糖的生物活性方面。如Kiho等发现腹腔注射金耳子实体水溶性多糖和醇溶多糖对正常小鼠,链脲霉素诱导的糖尿病小鼠以及基因缺陷型糖尿病小鼠均具降血糖作用[1-2]。杜秀菊等研究结果表明,金耳子实体氯仿提取物对肿瘤细胞株L1210和SW 620的抑制作用效果最好并且是其抗氧化活性的主要有效成分,而乙醇提取物是保护PC12细胞氧化损伤的主要有效成分[3-4]。陈龙等报道,金耳提取液具有较强的自由基清除能力和 Fe3+还原能力,其中对 DPPH与O2-的清除能力较强,对羟基自由基的清除能力较弱[5]。苑小林等研究发现,金耳子实体多糖对移植性人肺腺癌(AX-83)有显著抑制作用[6]。然而,由于金耳子实体的栽培周期长,产量较小,易受季节影响以及病虫害的侵袭,质量不可控,使得从子实体中提取多糖缺少商业可行性。而液体发酵技术可以进行工业化连续生产、规模大、周期短、产品质量稳定、不受环境和季节的影响。因此,金耳的研究逐渐转向于发酵产物的生物活性方面。如张雯等研究发现,金耳菌丝体多糖腹腔注射正常小鼠12 d,或用金耳菌丝体多糖灌胃四氧嘧啶致高血糖大鼠7 d和23 d,都可降低其血糖水平[7]。刘春卉等报道,金耳菌丝发酵物能够显著对抗小鼠体内血栓形成,抑制脑组织缺血时过氧化脂质分解产物丙二醛含量增加,明显抑制二磷酸腺苷诱导的血小板凝集,延长动物凝血酶原的作用时间,给药5 min后能明显增加动物脑膜的血流量[8]。
此外,多糖的结构是其生物活性的基础,不同来源的金耳多糖,同一来源通过不同提取方法得到的金耳多糖,具有各种不同的单糖组成、不同的糖苷键类型,不同的相对分子质量、能形成不同的构象,从而影响其生物活性。因此,作者通过液体培养获得了金耳发酵液多糖,对其化学组成和结构进行了初步分析,并比较了发酵液粗多糖和纯化后多糖的体外抗氧化活性和体内降血糖活性,为金耳资源的可持续利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种和动物 金耳 (Tremella aurantialba)斜面菌种:中国农业微生物菌种保藏管理中心(编号:50347);健康昆明小鼠(清洁级,雄性,4-5周龄,体重 (20±2)g):上海斯莱克实验动物有限责任公司(SCXK(沪)2007-0005)。
1.1.2 试剂 乙醇、三氯甲烷、正丁醇、硫酸、苯酚、氢氧化钠、盐酸、盐酸羟胺、肌醇、乙酸酐、考马斯亮蓝、葡萄糖、KH2PO4、牛血清蛋白、铁氰化钾、三氯化铁、三氟乙酸、乙二胺四乙酸、H2O2、水杨酸钠、冰醋酸、甲酰胺、四氧嘧啶、分子筛(4A):国药集团(上海)化学试剂有限公司产品;1-二甲基-2-三硝基苯肼(DPPH)、抗坏血酸(VC):美国Sigma公司产品。
1.1.3 培养基 PDA固体培养基(质量分数) 马铃薯20%,葡萄糖2%,KH2PO40.3%,MgSO4·7H2O 0.15%,琼脂2%,自然pH值;液体发酵培养基:马铃薯20%,葡萄糖2%,KH2PO40.3%,MgSO4·7H2O 0.15%,VB1 1~2 mg/dL,自然pH值。
1.1.4 仪器与设备 精密电子天平:美国Mettler Toledo公司产品;RE52-99旋转蒸发仪:上海亚荣生化仪器厂产品:立式压力蒸汽灭菌锅、生物洁净工作台、SPX-250B-Z型生化培养箱:上海博讯实业有限公司产品;气质联用色谱仪QP2010s、紫外可见分光光度计:岛津国际贸易上海有限公司产品;红外光谱仪: 美国 Thermo Electron公司产品;FreeZone2.5L冷冻干燥机:美国Labconco公司产品;HEA-230血糖仪:欧姆龙中国有限公司产品。
1.2 方法
1.2.1 金耳发酵液多糖的制备
1)金耳发酵 将保存于冰箱中的斜面菌种接种至平板PDA固体培养基,28℃培养7~10 d,使菌种恢复到正常生理状况。将平板菌种分割成黄豆大的小块,取3~4块接种到液体发酵培养基中,于28℃、220 r/min摇床振荡培养10~14 d[9]。
2)金耳发酵液多糖的提取 对发酵产物抽滤分离发酵液和菌丝体,通过旋转蒸发仪将金耳发酵液浓缩至原有体积的1/5,加入无水乙醇(V(发酵浓缩液)∶V(乙醇)=1∶4),4℃静止过夜,离心收集沉淀,加去离子水复溶后采用Sevage法脱蛋白,分离得到上清液后再次用无水乙醇沉淀,收集沉淀物后经冷冻干燥得金耳粗多糖(CLQP)。
3)金耳粗多糖的纯化 金耳粗多糖用去离子水溶解至质量浓度为5 mg/mL,选取1 cm×30 cm玻璃柱为层析柱,以Sephadex G-100葡聚糖凝胶为固定相,0.1 mol/L的NaCl溶液为流动相,上样量1 mL,全自动部分收集器控制流动相速度为1.5 min/管,0.75 mL/管,收集流出液。以苯酚-硫酸法监测收集液吸光值,结束后以洗脱体积为横坐标,收集液吸光值为纵坐标绘制洗脱曲线。合并单峰位置收集液,透析除盐后冷冻干燥,得到纯化后的金耳发酵液多糖(LQP)。
1.2.2 金耳发酵液多糖的化学分析
1)粗多糖产量测定 发酵液粗多糖产量(mg/ L)=发酵液粗多糖质量(mg)/发酵液体积(L)×100%
2)蛋白质含量的检测 多糖中的蛋白质含量测定采用考马斯亮蓝法。
3)全波长扫描检测 用去离子水溶解各种真菌多糖配制成质量浓度为1 mg/mL的多糖溶液,在200~800 nm的范围内进行紫外扫描。
4)总糖含量测量 多糖中总糖含量的测定采用苯酚-硫酸法。
5)多糖的单糖组成分析 称取20 mg多糖置于水解管中,加入2 mL浓度为1 mol/L的H2SO4溶液并封管,置于100℃恒温水浴锅水解4 h,水解液用过量BaCO3中和,8 000 r/min离心15 min,收集上清液冷冻干燥或置真空烘箱45℃下真空干燥,得到的干燥物即为游离单糖。
衍生化:称取上述干燥单糖样加入10 mg盐酸羟胺,如要定量加入2 mg肌醇作为内标,0.5 mL吡啶,于90℃水浴中保持30 min;取出冷却后加入0.5 mL乙酸 酐于90℃水浴中保持30 min,待样品冷却后进行GC分析。
色谱分析条件:采用OV1701石英毛细管柱(30 m×0.53 mm×1.0 μm);检测器为FID(氢火焰离子鉴定器);气化室温度:260℃,检测器温度:250℃;柱温升温程序:起始温度120℃,保持3 min,以10℃/ min升温至195℃,保持0.1 min后,再以3℃/min升温至240℃,保留10 min;载气压力(N2):0.60 kg/ cm2;燃气压力(H2):0.65 kg/cm2;助燃气压力(空气):0.50 kg/cm2,分流比:30∶1,进样量:2.0 μL。
6)多糖的相对分子质量测定 称取适量干燥多糖样品溶于去离子水得到样品质量浓度为 1 mg/ mL的多糖水溶液,过 0.45 μL微孔水系滤膜后用凝胶渗透色谱法(GPC)测定多糖样品重均相对分子质量。
GPC分析条件:流动相为 0.1 mol/L NaNO3溶液,流量为0.8 mL/min,进样量10 μL。
7)多糖的红外分析 室温条件下,将2 mg左右的干燥多糖样品与200 mg干燥溴化钾混合研磨压片后,在4 000~500 cm-1范围内进行FTIR分析。
1.2.3 金耳发酵多糖体外抗氧化活性测定
1)还原力测定 在试管中分别加入1 mL不同质量浓度的金耳发酵液多糖样品(50、100、200、400、1 000 μg/mL)、0.2 mL浓度为2.0 mol/L的PBS(pH 6.6)和0.25 mL质量分数为1%的铁氰化钾溶液。置50℃恒温水浴中反应20 min,迅速冷却,再加入0.5 mL质量分数10%三氯乙酸溶液,3 000 g离心10 min,取上清液1.5 mL,加入0.1 mL质量分数1%三氯化铁溶液和3 mL去离子水,振荡均匀,静置5 min,在700 nm处以蒸馏水代替多糖溶液为空白测定其吸光值[10]。
2)清除DPPH活性的测定 试管中加入1 mL不同浓度的多糖溶液 (50、100、200、400、1 000 μg/ mL)与3.0 mL溶于体积分数95%乙醇的0.004% DPPH溶液,室温静置30 min后,517 nm处测定吸光值。清除DPPH的公式为:清除率(%)=(1-(A1-A2)/A0)×100;式中A1为多糖样品溶液吸光值;A2为95%乙醇代替DPPH时的吸光值;A0为蒸馏水代替多糖溶液是的吸光值[11]。
3)清除羟基自由基活性的测定 在试管中依次加入1mL不同浓度的金耳发酵液多糖样品(50、100、200、400、1 000 μg/mL)、0.9 mL的FeSO4(0.15 mmol/L),0.5 mL水杨酸 (9 mmol/L)、0.5 mL H2O2(8.8 mmol/L),37℃反应60 min,于510 nm处测吸光值。清除·OH的公式为:清除率(%)=(1-(A1-A2)/A0)×100;式中A1为多糖样品溶液吸光值;A2为水杨酸代替H2O2时的吸光值,A0为水杨酸替代多糖测得的空白对照吸光值[12]。
1.2.4 金耳发酵液多糖的降血糖作用
1)糖尿病小鼠动物模型的建立 小鼠饲养温度25℃,相对湿度55%,自由进食,适应性喂养 。禁食(16 h)不禁水后,小鼠腹腔注射质量分数2%四氧嘧啶生理盐水溶液(200 mg/kg),72 h后,断尾取血,测空腹血糖,其值≥11.1mmol/L者为造模成功小鼠[13]。
2)分组和给药 选取糖尿病模型小鼠 50只,随机分为5组,分别作为模型对照组、CLQP高剂量组(200 mg/(kg·d))和低剂量组(50 mg/(kg·d))、LQP高剂量组和低剂量组,另取10只正常未做诱导处理的小鼠作为空白对照组。其中实验组连续灌胃上述剂量的多糖溶液14 d,模型对照组和空白对照组给予等量生理盐水。末次给药后1 h,尾部取血测定空腹血糖,实验数据用SPSS软件进行单因素方差统计分析处理。
2 结果与分析
2.1 金耳发酵液多糖的制备
2.1.1 金耳发酵 图1(a)为平板固体培养基中金耳菌丝生长形态,可知金耳菌丝在平板中的生长特征为:白色、不透明、表面无光泽的丝状圆形菌落。图1(b)显示金耳菌丝体在液体培养基中为金黄色球状颗粒,分散性良好,发酵液澄清透明,随着发酵时间延长颜色逐渐加深。

图1 平板中的金耳菌和摇瓶培养基中的菌丝体Fig.1 T.aurantialba in the plate culture and the mycelium in the shake-flask liquid culture
平板中金耳菌的生长曲线和摇瓶液体培养基中菌丝体的生长曲线如图2所示。平板中的金耳菌落半径会随着时间的延长逐渐增加,在14 d时长满整个平板。在液体培养基中,随着培养时间的延长,菌丝体生物量增加,至第10 d时生物量达到0.68 g/ dL,之后趋于平稳并有下降的趋势。
2.1.2 金耳发酵多糖的提取和纯化 CLQP的产量约为66 mg/L,总糖质量分数14.43%,残留蛋白质质量分数为 22.5%。经 Sevage法脱蛋白处理和Sephadex G-100葡聚糖凝胶柱纯化后,LQP总糖质量分数为85.85%。图3为金耳发酵液多糖的洗脱曲线,从图中看出,洗脱曲线洗脱峰单一,对称形较好,说明样品纯度比较高。用考马斯亮蓝法测得LQP中残留蛋白质质量分数为2.6%,可能是样品中蛋白质与多糖紧密结合的糖蛋白。图4为LQP在200~800 nm范围内的全波长扫描图,可知在260 nm处和280 nm处均无明显吸收,即LQP中核酸和蛋白质含量极低。
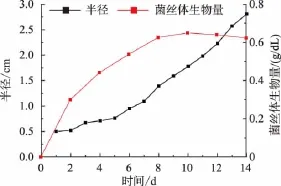
图2 平板中金耳菌的生长曲线和摇瓶培养基中菌丝体的生长曲线Fig.2 Growth curves of T.aurantialba in the plate culture and its mycelium in the shake-flask liquid culture

图3 发酵液多糖的洗脱曲线Fig.3 Elution curve of polysaccharides
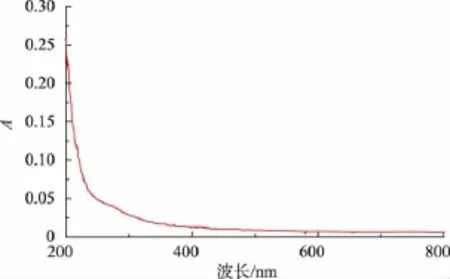
图4 LQP全波长扫描图Fig.4 Full wave scanning of LQP
2.2 多糖的组成和结构初步分析
2.2.1 单糖组成分析 选取常见的6种标准单糖作为对照品来进行分析,对照标准品出峰时间见表1。图5为LQP乙酰化处理后GC色谱图,LQP的单糖组成及含量结果见表2,其主要由葡萄糖、半乳糖和甘露糖组成。图谱中在15.604 min出现的峰可能是一种不常见的单糖。
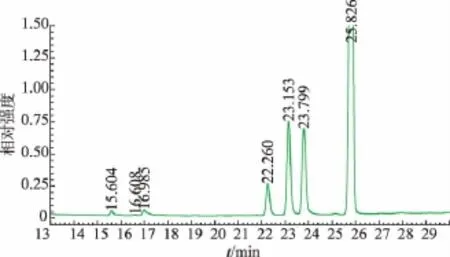
图5 LQP的GC图谱Fig.5 GC spectrum of LQP
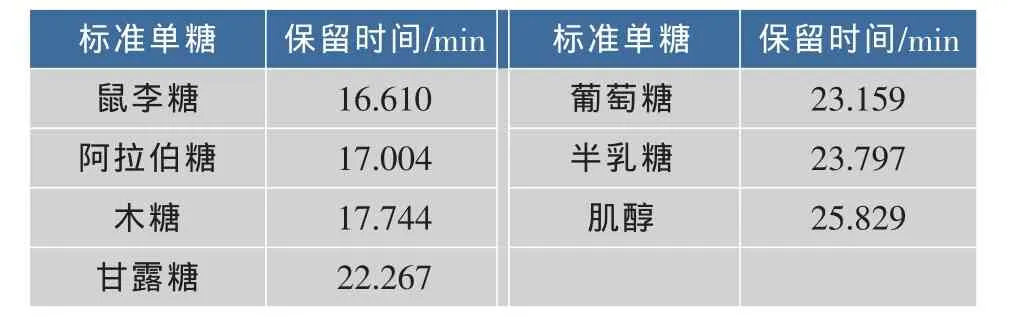
表1 标准单糖出峰时间Table 1 Migration time of monosaccharide standards

表2 LQP的单糖组成Table 2 Monosaccharide composition of LQP
2.2.2 多糖相对分子质量 多糖的相对分子质量很大程度上决定了多糖的生物活性,因为相对分子质量直接影响物质的水溶性和高级结构的形成。经GPC检测,LQP的相对分子质量为14 000。
2.2.3 红外分析 图6为LQP的红外光谱。在3 600~3 200 cm-1之间出现的宽峰,主要是O-H的伸缩振动引起的,表明多糖样品中均存在分子内和分子间氢键;在2 930 cm-1处的吸收峰是由C-H伸缩振动引起的,该峰为糖类物质的特征吸收峰;在1 640 cm-1处的吸收峰是羰基上C=O的伸缩振动峰,说明多糖样品中含有羰基;在3 000~2 500 cm-1之间除C-H伸缩振动峰以外,无明显的羧基振动峰,说明多糖样品中糖醛酸含量较少,主要成分为中性多糖,在1 100~1 010 cm-1区域之间,多糖有两个明显的吸收峰,这两个吸收峰为D-吡喃糖苷的特征吸收峰。此外,多糖在890 cm-1处的吸收峰说明多糖是以β糖苷键相连的。
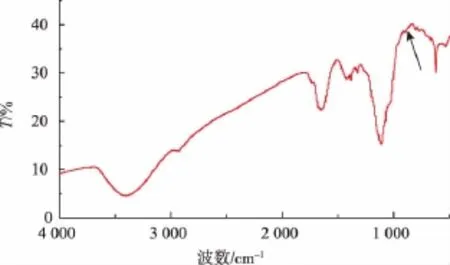
图6 LQP的红外光谱Fig.6 FTIR spectrum of LQP
2.3 金耳发酵多糖体外抗氧化活性测定
2.3.1 还原力测定 铁氰化钾K3Fe(CN)6可被还原试剂还原成亚铁氰化钾K4Fe(CN)6,K4Fe(CN)6可与Fe3+作用生成普鲁士蓝,普鲁士蓝在700 nm处有最大吸收值,可间接的反映样品的还原力,吸光值越大,还原力越高[14]。
由图7(a)可知,CLQP和LQP的还原能力随多糖质量浓度的增加呈现逐渐增长趋势。当多糖质量浓度为50~400 μg/mL时,两者的还原能力无明显差异;多糖质量浓度大于400 μg/mL后,LQP还原能力的增长幅度大于CLQP;当质量浓度为1 000 μg/mL时,CLQP和LQP的还原力均达到最高,其中LQP的还原力(A700为0.260)略高于CLQP(A700为0.216)。
2.3.2 清除DPPH活性的测定 DPPH自由基是一种稳定的自由基,在可见光区517 nm有最大吸收峰,抗氧化剂与DPPH反应,DPPH溶液变色程度反应了提取物的清除能力。这一反应已被广泛用于测试化合物自由基清除能力和评价食品、植物提取物的抗氧化活性。
由图7(b)可看出,随着多糖质量浓度的增加,CLQP和LQP对DPPH自由基清除能力均呈现较为明显的增长趋势,其中LQP清除DPPH自由基活性在50~1 000 μg/mL质量浓度范围内均明显高于CLQP。当多糖质量浓度达到1 000 μg/mL时,两者的DPPH自由基清除能力均达到最大,其中CLQP为41.62%,LQP为74.74%。
2.3.3 清除羟基自由基活性的测定 利用H2O2和Fe2+混合反应Fenton反应,生成具有很高反应活性的·OH,在该体系内加入水杨酸钠可捕捉·OH并产生深色物资,该物质在510 nm处有最大吸收。多糖对羟基自由基清除率随样品浓度的变化趋势见图7C。由图可知,随着多糖质量浓度的增加,CLQP和LQP对羟基自由基清除能力呈明显的增长,其变化趋势类似多糖对DPPH自由基清除能力。LQP的清除能力明显强于CLQP。从以上3组抗氧化试验结果可看出,纯化后金耳发酵液多糖的抗氧化活性强于金耳发酵液粗多糖,由于上述两种多糖在总糖质量分数上有巨大差异,推测金耳多糖抗氧化活性的强弱与多糖质量分数有关。
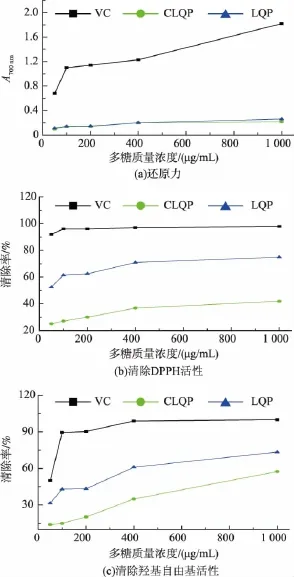
图7 金耳发酵液多糖抗氧化活性Fig.7 Antioxidant activities of polysaccharides from fermented T.aurantialba
2.4 金耳发酵液多糖的降血糖作用
四氧嘧啶对胰岛β细胞具有特殊的破坏作用,使胰岛分泌功能受到损伤[15],从而引起动物实验性糖尿病,血糖含量不能正常降低。造模后,小鼠出现多饮、多尿、多食等明显的糖尿病症状且血糖明显升高。在整个实验过程中,模型组小鼠的血糖水平无明显变化(在12 mmol/L左右)。给药14 d后,金耳发酵多糖对四氧嘧啶诱导糖尿病小鼠空腹血糖的作用见图8。从图中可看出,与模型组相比,CLQP和LQP均可显著降低小鼠血糖含量(P<0.05),高剂量组的效果强于低剂量组,但未达到空白对照组血糖水平(P<0.05)。当剂量相同时,LQP的降血糖作用大于CLQP(P<0.05)。

图8 金耳发酵液多糖的降血糖作用Fig.8 Hypoglycemic function of polysaccharides from fermented T.aurantialba
3 结语
通过液体发酵法收集金耳发酵液,发酵液经浓缩后醇沉得到CLQP,再经Sevage法脱蛋白、蒸馏水透析,葡聚糖凝胶层析、冷冻干燥一系列处理过程最终获得LQP。同时,对CLQP和LQP的体外抗氧化和体内降血糖活性进行了研究。CLQP产率为66 mg/L,总糖质量分数14.43%,残留蛋白质质量分数为22.5%;LQP总糖质量分数为85.85%,残留蛋白质质量分数为2.6%,相对分子质量为14 000,主链以β糖苷键相连,主要的单糖组成为甘露糖、葡萄糖和半乳糖。体外抗氧化实验显示,CLQP和LQP均具有一定的还原能力以及较强的清除DPPH和羟基自由基活性,但在还原力方面两者只有在多糖质量浓度为1 000 μg/mL时有略微差异,而在清除DPPH和羟基自由基活性方面,LQP明显强于CLQP。此外,CLQP和LQP均可显著降低四氧嘧啶诱导的糖尿病小鼠血糖含量。金耳发酵液多糖具有的抗氧化和降血糖活性,为金耳的进一步开发应用提供了依据。
参考文献:
[1]KIHO T,MORIMOTO H,KOBAYASHI T,et al.Effect of a polysaccharide from the bodies of Tremella aurantia on glucose metabolism in mouse live[J].Bioscience Biotechnology and Biochemistry,2000,64:417-419.
[2]KIHO T,KOCHI M,USUI S,et al.Antidiabetic effect of an acidic polysaccharide(TAP)from Tremella aurantia and its degradation product(TAP-H)[J].Biological&Pharmaceutical Bulletin,2001,24(12):1400-1403.
[3]DU Xiuju,ZHANG Jingsong,JIA Wei.Antitumor and immunostimulating activities of the extracts from Tremella aurantialba fruting bodies in vitro[J].Natural Product Research and Development,2011,23:351-355.(in Chinese)
[4]DU Xiuju,ZHANG Jingsong,LIU Yanfang,et al.The antioxidant activity of various extracts from Tremella aurantialba fruting bodies and their protective effects on PC12 cells injured by oxidation[J].Acta Agriculturae Shanghai,2010,26(2):49-52.(in Chinese)
[5]CHEN Long,LI Wenfeng,LING Bo,et al.Extraction and antioxidant activity of polyphenols from Tremella aurantialba,Tremella fucitormis and Auricularia aurricula[J].Food Science,2011,32(20):52-56.(in Chinese)
[6]YUAN Xiaolin,ZHANG Peide,CHEN Shigen.Preliminary study on chemical properties of a soluble polysaccharide from the mushroom Tremella aurantia,and its oncosuppressive activity[J].Journal of Fudan University(Natural Science),1996,35(6):703-706.(in Chinese)
[7]ZHANG Wen,QU Weijing,ZHANG Xiaoli,et al.The anti-hyperglycemic activity of polysaccharides from Tremella aurantialba mycelium[J].Acta Nutrimenta Sinica,2004,26(4):300-303.(in Chinese)
[8]LIU Chunhui,XIE Hong,SU Binnan,et al.Anti-thrombus effect on the fermented products of mycelium from Tremella aurantialba[J].Natural Product Research and Development,2003,15(4):289-292.(in Chinese)
[9]DONG Changjin.Study on the liquid-submerged fementation and polysaccharide extraction of Tremella aurantialba mycelia[J]. Journal of Anhui Agricultural Science,2010,38(1):342-344.(in Chinese)
[10]HE Y H,FEREIDOON S.Antioxidant activity of green tea and its catechins in a fish meat model system[J].Journal of Agricultural and Food Chemistry,1997,45:4262-4266.
[11]ZHANG Lini,ZHANG Jing,SUN Runguang,et al.Study on antioxidant activity and spatial structure of Ophiopogon japonicus polysaccharide with modified[J].Journal of Food Science and Biotechnology,2014,33(1):27-33.(in Chinese)
[12]HE Z S,CAO Z H.Photometric determination of hydroxyl free radical in fenton system by brilliant green[J].American journal of Chinese Medicine,2004(6):236-237.
[13]GONG Huiling,YIN Yanyan,LI Weiping,et al.Effects of polygona-polysaccharose on blood glucose level and antioxidant activity in diabetic mice induced by alloxan[J].Acta Universitatis Medicinalis Anhui,2008,43(5):538-540.(in Chinese)
[14]ZOU C,DU Y M,LI Y,et al.Preparation of lacquer polysaccharide sulfates and their antioxidant activity in vitro[J]. Carbohydrate Polymers,2008,73(2):322-331.
[15]YANG Yanchao,XU Deping.Hypoglycemic effect and structural determination of polysaccharides from barley malt[J].Journal of Food Science and Biotechnology,2012,31(10):1087-1092.(in Chinese)
Preparation,Chemical Analysis and Biological Activity of Polysaccharides from Fermented Tremella aurantialba
DENG Chao1, FU Haitian2, SHANG Jingying2, QIAO Zhiqi1, ZHAO Chu1, CHEN Jinghua*2
(1.Wuxi Medical School,Jiangnan University,Wuxi 214122,China;2.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China)
The study aimed to investigate chemical constituents and biological activities of the polysaccharides from Tremella aurantialba.The polysaccharides were first produced by liquid fermentation.Then the content of total sugar,monosaccharide composition,molecular weight and the type of glycosidic bonds were analyzed by the phenol-sulfuric acid method,GC-MS,GPC and FTIR,respectively.In addition,antioxidant and hypoglycemic activities were investigated.Results showed that the content of total sugar and the molecular weight of the polysaccharides were 85.85% and 1.4×104g/mol.The monosaccharides primarily included mannose,glucose and galactose and the backbone of the polysaccharides was connected with β-glucosidic bonds.In vitro antioxidant activities such as the reduction capacity,DPPH and hydroxyl scavenging activities were observed and the polysaccharides also significantly reduced the blood glucose of diabetic mice induced by alloxan.
Tremella aurantialba,fermentation,polysaccharide,preparation,chemicalanalysis,biological activity
R 285.5
A
1673—1689(2017)01—0067—07
2015-03-05
教育部博士点基金(博导类)资助项目(20110093110008)。
邓 超(1972—),男,江苏无锡人,副教授,主要从事天然产物的提取及活性评价研究。E-mail:jscdcdjl@163.com
*通信作者:陈敬华(1971—),男,湖北黄石人,理学博士,教授,主要从事生物大分子和生物功能材料研究。E-mail:jhchenwhut@126.com
邓 超,付海田,尚京迎,等.金耳发酵液多糖的制备、分析及生物活性研究[J].食品与生物技术学报,2017,36(01):67-73.

