早期食管癌中ATM和p16蛋白的表达及临床意义
韩 笑,陆荣柱
食管癌是全球最常见的恶性肿瘤之一,我国食管癌的发病率居全球之首,每年发病率和病死率均占全球发病率和病死率的一半以上。食管癌的5年生存率仅为10%,但早期食管癌的生存率可达90%[1]。所以“早发现、早诊断、早治疗”对于食管癌患者来说意义重大。ATM和p16基因均为抑癌基因,两者通过特定途径影响细胞周期,在食管癌的发生中起重要作用。本文采用免疫组化法检测ATM和p16蛋白在早期食管癌组织及癌旁正常鳞状上皮组织中的表达,探讨两者在早期食管癌发生中的作用及两者的相关性,旨在为诊断早期食管癌提供新方法。
1 材料与方法
1.1一般资料选取淮安市肿瘤医院2012年1月~2015年12月手术后经病理证实的早期食管癌患者69例,其中男性42例,女性27例,年龄46~78岁,平均62岁。所选取组织肉眼分型有糜烂型、斑块型、隐伏型,以斑块型为主;病理组织学类型均为鳞状细胞癌,其中原位癌9例,黏膜内癌22例,黏膜下癌38例,高分化23例,中分化30例,低分化16例;癌旁组织均为早期食管癌患者手术后大标本的切缘组织,组织学上均为正常的鳞状上皮组织。
1.2方法采用免疫组化SP法检测ATM蛋白和p16蛋白的表达。免疫组化染色严格按试剂盒说明进行,用PBS缓冲液作为一抗,作为阴性对照;用已知的阳性片作为阳性对照。ATM抗体购自Abcam公司,p16抗体、SP试剂盒及DAB显色剂均购自福州迈新公司。
1.3结果判定ATM蛋白和p16蛋白部分表达于细胞核,部分表达于细胞质,镜下细胞核或细胞质内呈现棕黄色颗粒。(1)按着色程度评分:无阳性染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞百分比评分:阳性细胞数<10%为0分,10%~25%为1分,25%~50%为2分,>50%为3分。将两项得分结果相乘:0分为阴性(-);1分以上为阳性(+~),其中1、2分为(+),3、4分为(),6~9分为()。
1.4统计学方法采用SPSS 17.0软件对数据进行统计学分析。ATM蛋白和p16蛋白表达与早期食管癌的临床病理特征的研究采用χ2检验,显著性检验水准α=0.05,P<0.05为差异有计学意义。ATM蛋白和p16蛋白表达的相关性分析采用Spearman相关分析,r<1.0为两者有相关性。
2 结果
本组实验中ATM蛋白和p16蛋白部分表达于细胞核,部分表达于细胞质。69例早期食管癌组织中ATM蛋白阳性率为60.9%,p16蛋白阳性率为68.1%,两者在早期食管癌组织中的表达均低于癌旁正常鳞状上皮组织(图1、2),两者表达与患者年龄、性别、肿块位置无关(P>0.05),与分化程度、浸润深度有关(P<0.05),随着分化程度的降低、浸润深度的加深,两者表达均下降(表1)。实验亦发现ATM蛋白和p16蛋白的表达有一定的相关性(r=0.598,表2)。
3 讨论
ATM基因是肌醇激酶-3(Phosphatidylinostiol 3-kinase, PI3K)基因家族的成员,是一种肿瘤抑制基因[2]。由其编码的ATM蛋白是一种自动磷酸化蛋白[3],主要存在于细胞核和细胞质中。该蛋白最主要的功能区位于蛋白C末端,主要参与细胞周期的调控、DNA损伤识别和修复[4]。DNA损伤诱导ATM激活,ATM通过磷酸和去磷酸化一系列蛋白底物如p53等参与细胞周期检测点的监管和DNA损伤后修复信号网络系统,使受损的DNA阻滞细胞周期的G1/S期、S期和G2/M期这3个检测点,并对其进行修复。但当ATM由于突变而造成功能受损时,细胞则丧失这一功能,不能对受损的DNA给予正常修复,这样受损的DNA很容易随细胞分裂而传入子代细胞,最终导致细胞癌变。Seshagiri等[5]报道ATM蛋白和结肠癌也有一定的关系,Roberts等[6]报道ATM蛋白和胰腺癌有一定的关系,可见ATM蛋白在消化道肿瘤中起很大作用。本实验采用免疫组化法检测发现ATM在早期食管癌组织中的表达低于癌旁正常鳞状上皮组织,且其表达与组织分化程度、浸润深度有关。实验亦发现随着分化程度的降低、浸润深度的加深,ATM蛋白在早期食管癌组织中的表达越低。这说明当ATM由于突变而造成功能受损时,不能对受损的DNA给予正常修复,使得受损的DNA很容易随细胞分裂而传入子代细胞,最终导致细胞癌变。表明ATM蛋白低表达在早期食管癌的发生、发展中起重要作用。

表2 早期食管癌组织中ATM蛋白和p16蛋白表达的相关性

①②
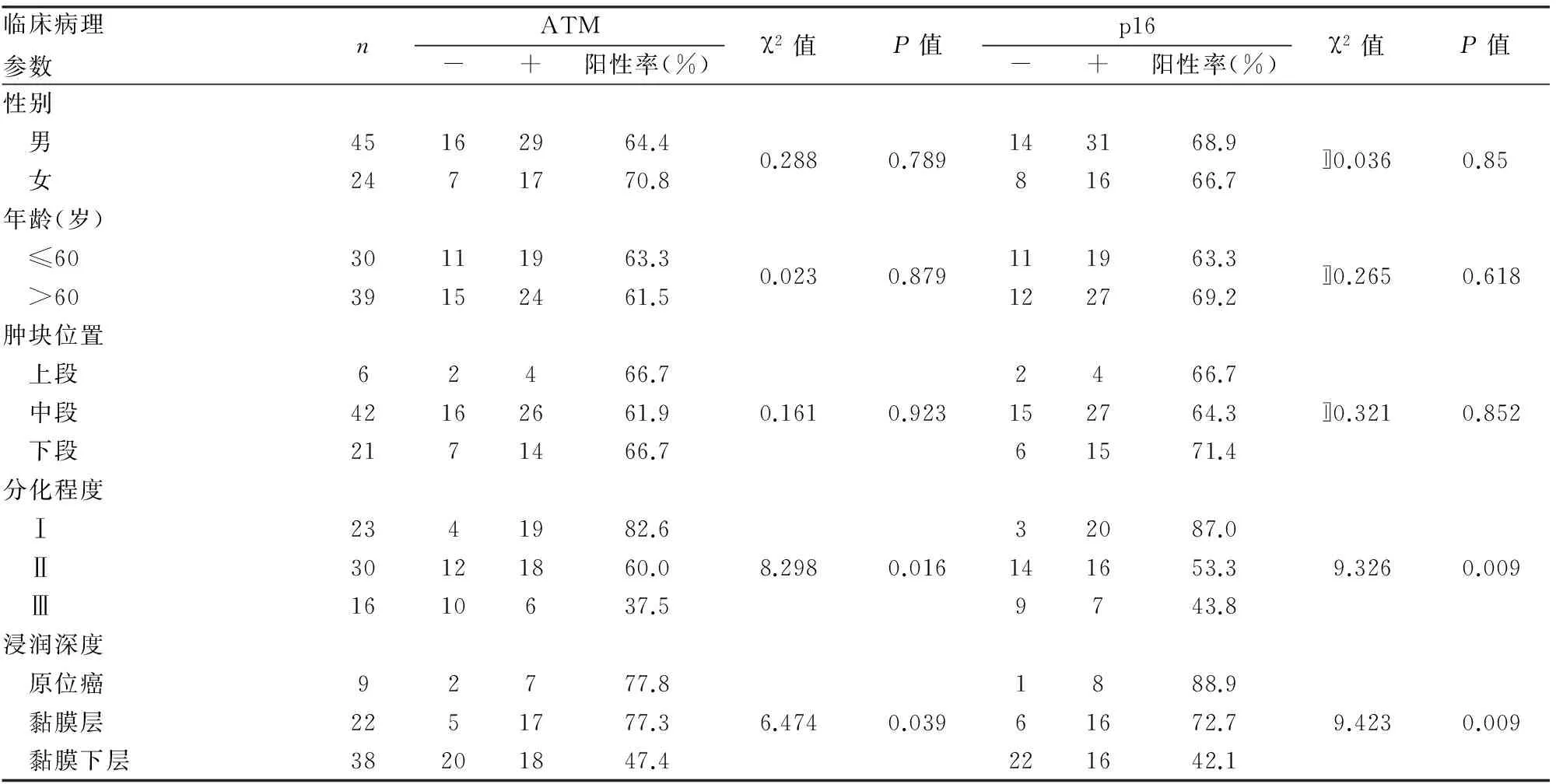
图1 ATM在早期食管癌中的表达,SP法图2 p16蛋白在早期食管癌中表达,SP法
p16是一种非常重要的抑癌基因[7],编码表达一个含148个氨基酸残基的蛋白质。该蛋白可以特异性地与细胞周期素4(CDK4)结合,抑制CDK4的活性,从而使细胞生长停滞在G1期,细胞的生长受到抑制[8]。在肿瘤细胞内,p16基因突变或甲基化后失去正常的蛋白表达功能,出现细胞周期素D与CDK4结合增加,使细胞增殖加速,最终演变为细胞的生长活动失去控制。本组免疫组化检测结果发现,p16蛋白在早期食管癌组织中低表达,且其与组织分化程度、浸润深度有关,且随着分化程度的降低、浸润深度的加深,在早期食管癌组织中的表达越低。这些均说明p16蛋白的低表达或表达缺失在早期食管癌的发生、发展中起重要的促进作用。Noushin等[9]研究发现在食管癌中p16蛋白表达也下降,还有研究发现p16蛋白表达缺失可能出现在食管鳞状细胞癌发生的早期阶段[10]。
ATM和p16均为抑癌基因,可以使细胞周期停滞于G1期,使受损的DNA得到修复或者细胞生长得以抑制。在食管鳞状细胞癌中p16蛋白和多种蛋白相关性研究报道很多,赵醒等[11]报道p16蛋白和Cyclin D1的表达无明显相关性,本组实验结果显示,在早期食管癌中p16蛋白和ATM蛋白表达呈正相关(r=0.598),两者表达是否有高度相关或者显著性相关,可能还要进一步扩大样本研究。实验亦发现38例ATM蛋白和p16蛋白同时阳性者中有24例患者分化程度均为Ⅰ~Ⅱ级、浸润深度在黏膜层以上,这表明联合检测两者的表达,对判断早期食管癌的分化程度和浸润深度上有一定提示作用,这也间接表明两者对预后有一定提示作用。
本组69例早期食管癌患者手术后均未行放、化疗,有2例死于脑血管疾病,1例术后随访胸部X线发现肺部小粟粒状阴影,拒绝进一步检查治疗,所以不能确定是否是转移灶。本组实验对ATM蛋白和p16蛋白在早期食管癌中的表达情况进行观察,旨在为诊断早期食管癌提供新的诊断思路和方向,且两者表达呈正相关,对判断早期食管癌的分化程度和浸润深度上有一定的提示作用。
[1] Ding G C, Ren J L, Chang F B,etal. Human papillomavirus DNA and p16INK4Aexpression in concurrent esophageal and gastric cardia cancers[J]. World J Gastroenterol, 2010,6(46):5901-5906.
[2] Kim H S, Choi S I, Min H L,etal. Mutation at intronic repeats of the ataxia-telangiectasia mutated (ATM) gene and ATM protein loss in primary gastric cancer with microsatellite instability[J]. PLoS One, 2013,8(12):e82769.
[3] Venturina S, Veronica O, Giulia F,etal. Tug of war between survival and death: exploring ATM function in cancer[J]. Int J Mol Sci, 2014,15(4):5388-5409.
[4] Chris T, Williamson, Huong M,etal. ATM-deficiency sensitizes mantle cell Lymphoma cells to PARP-1 inhibitors[J]. Mol Cancer Ther, 2010,9(2):347-357.
[5] Seshagiri S, Stawiski E W, Durinck S,etal. Recurrent r-spondin fusions in colon cancer[J]. Nature, 2012,488(7413):660-664.
[6] Roberts N J, Jiao Y, Yu J P,etal. ATM mutations in patients with hereditary pancreatic cancer[J]. Cancer Discov, 2012,2(1):41-46.
[7] Christine H C, Qiang Z, Christina S K,etal. p16 protein expression and human papillomavirus status as prognostic biomarkers of nonoropharyngeal head and neck squamous cell carcinoma[J]. J Clin Oncol, 2014,32(35):3930-3938.
[8] 王文普, 孙 红. 子宫颈鳞状细胞癌中p16和CXCR4的表达及意义[J]. 临床与实验病理学杂志, 2013,29(8):914-918.
[9] Noushin T, Firouzeh B, Masoud S,etal. p16INK4ahypermethylation and p53, p16 and MDM2 protein expression in esophageal squamous cell carcinoma[J]. BMC Cancer, 2010,10:138.
[10] Li J, Poi M J, Tsai M D. The regulatory mechanisms of tumor suppressor p16INK4Aand relevance to cancer[J]. Biochemistry, 2011,50(25):5566-5582.
[11] 赵 醒, 赵宇阳, 王 军, 等. 食管鳞状细胞癌中细胞周期素D1和p16蛋白的表达及意义[J]. 广东医学, 2015,1(36):273-275.

