胰腺实性假乳头状瘤临床病理学与术后复发/转移的相关性分析
高汉青,庞 霞,赵香田,王青杰,马怡晖
胰腺实性假乳头状瘤(solid-pseuopapillary neoplasm, SPN)是一种罕见的胰腺囊实性肿瘤,随着近年来影像学技术的应用和发展,SPN发病率有所提高[1]。WHO(2000)胰腺肿瘤分类将SPN分为具有交界性恶性潜能的SPN和实性假乳头状癌,并指出血管侵犯、神经周围侵犯以及周围胰腺实质的深部浸润提示恶性生物学行为;WHO(2010)胰腺肿瘤分类则直接将SPN归入恶性肿瘤范畴。虽然SPN预后良好,手术完整切除肿瘤,患者5年生存率可达95%以上[2],但仍有部分患者出现转移或复发。目前关于SPN复发或转移的研究较少。作者搜集了具有完整的临床病理资料和随访记录的73例手术切除的胰腺SPN,分析其临床病理学特征,探讨临床病理学特征与其术后复发或转移的相关性,以期更深入地认识与SPN复发/转移的相关因素。
1 材料与方法
1.1材料收集2008年1月~2016年6月郑州大学第一附属医院手术切除的具有完整的临床资料及随访资料的SPN患者73例,由两名经验丰富的病理医师复查切片。
1.2方法手术切除标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚切片后行HE染色。免疫组化采用SP法,染色步骤按照试剂盒操作说明书在自动免疫组化仪上进行,一抗Ki-67以及所需试剂均购自福州迈新公司。
1.3Ki-67结果判定于热点区随机选择10个高倍视野,计数1 000个肿瘤细胞,以其中阳性肿瘤细胞数的百分数表示Ki-67的增殖指数。
1.4随访采用电话随访患者的方法,以患者手术后第1天为随访起始点,以各种原因死亡为随访终止点,截止随访日期为2017年6月底。
1.5统计学分析采用SPSS 20.0软件进行统计学分析,对非复发/转移组与复发/转移组患者性别、年龄、肿瘤大小采用两独立样本非参数检验,对肿瘤发生部位、肿瘤病理学特点采用χ2或Fisher确切概率法检验,P<0.05为差异有统计学意义。
2 结果
2.1临床特征73例胰腺SPN中女性57例(78%),男性16例(22%),发病年龄7~68岁,平均28岁,中位年龄27岁。25例(34.2%)无明显临床症状,于体检时发现胰腺占位,5例(6.8%)因触及腹部肿块就诊,41例(56.2%)出现腹痛、恶心、呕吐等症状,1例(1.4%)出现肝功能异常,1例(1.4%)出现黄疸。73例胰腺SPN患者术前均行CT和(或)MRI检查,其中30例(41.1%)术前考虑胰腺SPN,其余43例(58.9%)考虑为胰腺神经内分泌肿瘤、胰腺囊腺瘤、胰母细胞瘤或间叶来源肿瘤等。10例(13.7%)行胰十二指肠切除术,23例(31.5%)行胰体尾及脾脏切除术,7例(9.6%)行胰体尾切除术,33例(45.2%)行肿物切除术。所有手术均是R0切除,未发现有肿物残留。30例SPN(41.1%%)位于胰头、9例(12.3%)位于胰体、33例(45.2%)位于胰尾,1例(1.4%)为多发病灶,分别位于胰头及胰尾。根据WHO(2010)胰腺肿瘤TNM分期对73例患者进行分期,ⅠA期3例(4.1%),ⅡA期61例(83.6%),ⅡB期9例(12.3%)。
2.2病理检查
2.2.1眼观 73例胰腺SPN瘤体平均直径为6.47 cm(范围0.13~14 cm),43例(59.0%)切面呈实性,15例(20.5%)呈囊性,15例(20.5%)呈囊实性。
2.2.2镜检 SPN实性区由细胞丰富的实性巢团构成,间质内血管丰富纤细,远离血管的肿瘤细胞出现退变、黏附性差,围绕血管周围形成所谓的假乳头状排列;囊性区常可见出血、坏死、泡沫细胞聚集及胆固醇结晶沉积。40例(54.8%)伴有坏死,20例(27.3%)伴有胆固醇结晶,20例(27.3%)伴有钙化,9例(12.3%)伴有泡沫细胞,2例(2.7%)细胞核有异型性(图1)。40例(54.8%)有完整纤维性包膜,但可见瘤组织侵入包膜并平行穿插在包膜中生长(未突破包膜)(图2);33例(45.2%)包膜不完整或无包膜,于胰腺组织内浸润性生长(图3)或侵及胰腺外。16例(21.9%)见神经周围侵犯(图4);3例见脉管内瘤栓(图5);10例(13.7%)见胰腺外侵犯,包括1例同时侵犯脾脏被膜及结肠浆膜面,2例侵犯脾脏被膜(图6),3例侵犯肠壁(2例侵犯十二指肠固有肌层,1例侵犯十二指肠浆膜面),4例侵犯周围脂肪及网膜组织。
2.2.3免疫表型 73例胰腺SPN中66例(90.4%)Ki-67增殖指数<4%;7例(9.6%)Ki-67≥4%。
2.3非复发/转移组和复发/转移组病理学特征的差异比较73例患者随访12~99个月,平均随访34.8个月。3例出现复发或转移,其余患者术后均无瘤生存至今。1例患者于术后84个月复发,原发SPN中存在脉管瘤栓、神经侵犯、包膜不完整并浸润性生长,局部侵犯结肠浆膜面及脾脏被膜,Ki-67增殖指数约10%;该患者后带瘤生存至今。1例患者于术后27个月发现肝脏多发转移(图7),原发肿瘤包膜完整,有脉管瘤栓及神经侵犯,细胞核异型性大,Ki-67增殖指数约20%(图8);该患者发现转移后行肝右叶及部分肝左叶切除,目前仍健在。另1例患者于术后10个月复发,原发肿瘤包膜不完整,于胰腺组织内浸润性生长并局部浸润胰腺周围脂肪组织,Ki-67增殖指数约2%;该患者未治疗生存至今。进一步分析非复发/转移组和复发/转移组临床病理学特征结果显示:患者性别(P=0.119)、年龄(P=0.707)、瘤体大小(P=0.558)、瘤体部位(P=0.166)、切面囊性变(P=0.630)、坏死(P=0.247)、钙化(P=0.557)、胆固醇结晶(P=0.180)、泡沫细胞(P=1.000)、细胞核异型性(P=0.081)、神经侵犯(P=0.119)、浸润性生长(P=0.586)等病理特征与SNP的复发或转移无明显差异,而脉管内瘤栓(P<0.005)、胰腺外侵犯(P<0.05)以及Ki-67增殖指数≥4%(P<0.05)在非复发/转移组与复发/转移组间存在差异(表1)。
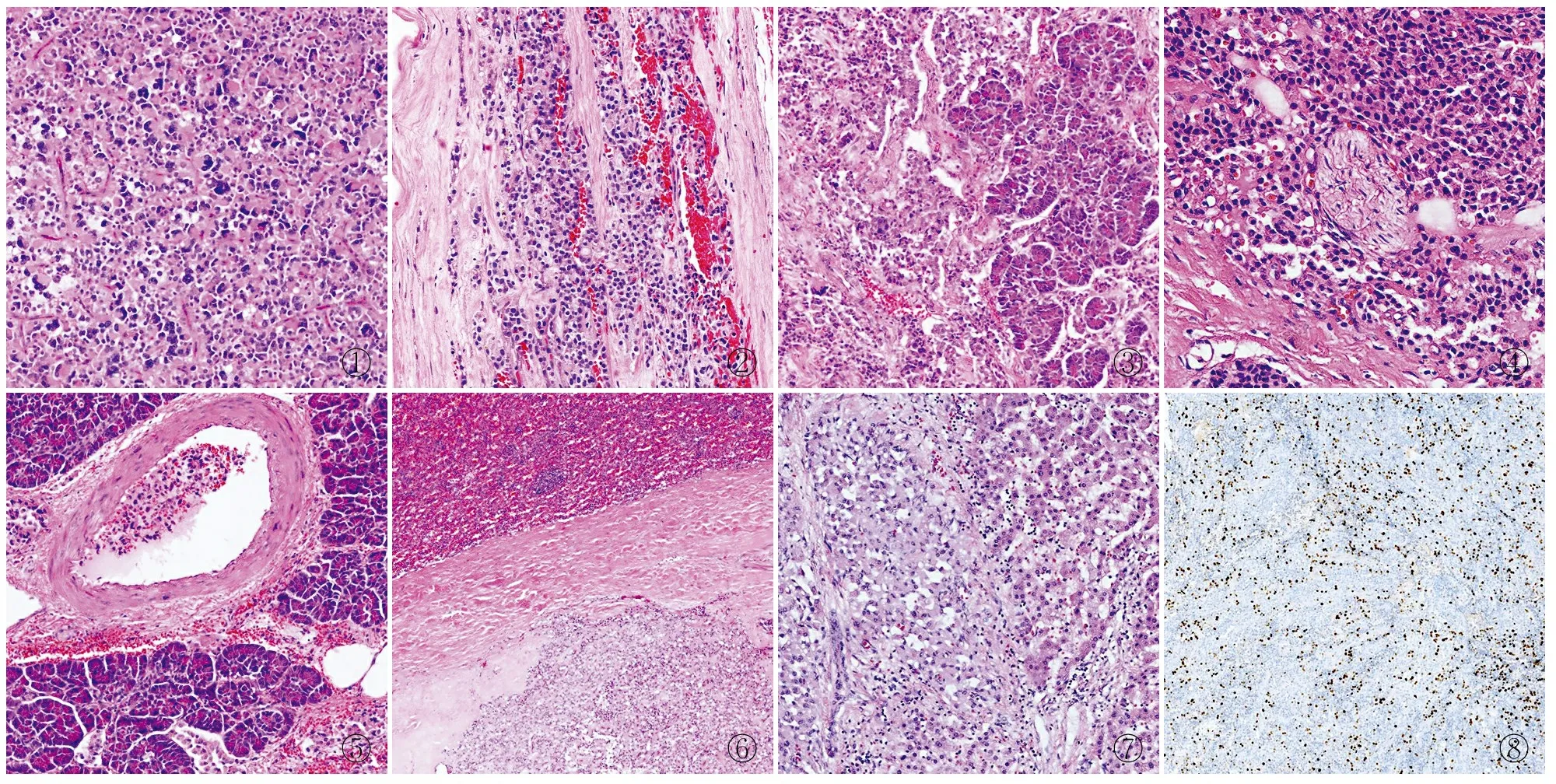
①②③④⑤⑥⑦⑧
图1肿瘤细胞核重度异型性图2肿瘤组织在包膜内平行生长图3肿瘤与周围胰腺浸润性生长图4神经周围侵犯图5脉管内瘤栓图6肿瘤侵犯脾脏被膜图7肿瘤肝脏转移图8胰腺实性假乳头状瘤肝转移患者胰腺原发灶肿瘤细胞散在阳性表达Ki-67,增殖指数约20%,SP法

表1 胰腺实性假乳头状瘤患者组织病理学特点在非复发/转移组和复发/转移组中的差异
*P<0.05
3 讨论
SPN是一种少见的具有恶性潜能的胰腺肿瘤,好发于20~40岁年轻女性,临床表现往往无特异性,常因体检发现[3]。病理学将镜下神经侵犯、血管侵犯、胰腺实质的侵犯和胰外组织浸润作为判定恶性SPN的指标[4],但关于SPN临床病理特征与恶性潜能之间相关性的研究结果却有所不同。Kang等[5]认为,肿瘤直径大于8 cm、淋巴血管侵犯、包膜侵犯、广泛肿瘤性坏死以及远处转移是预测SPN复发的重要因素。Yang等[6-8]认为血管内瘤栓形成、胰腺外侵犯、淋巴结转移以及Ki-67增殖指数≥4%与肿瘤复发有关。有文献报道老年男性肿瘤不完整切除术后可能具有更高的复发和死亡风险[9]。但也有学者认为,病理学的恶性特征不能可靠地反映肿瘤的恶性生物学行为,缺乏这些特征的SPN也会出现复发或转移[10]。WHO(2010)胰腺肿瘤分类中神经、血管侵犯及胰腺内浸润性生长并不提示肿瘤具有更高的恶性程度,因为无上述恶性组织学特征的SPN也有可能发生转移[11]。
本组73例具有完整临床病理资料和随访资料的SPN患者,经分析发现,SPN复发或转移与患者性别、年龄、瘤体大小、瘤体部位、切面囊性变、细胞核异型性、坏死、钙化、胆固醇结晶、泡沫细胞、神经侵犯以及是否浸润性生长等无关,但与瘤组织胰腺外侵犯、脉管内瘤栓形成以及Ki-67增殖指数≥4%显著相关。
脉管瘤栓常出现在恶性肿瘤中,胰腺癌中脉管癌栓形成后随血液进入肝脏更易在肝窦内存活,是影响胰腺癌术后肝转移的独立因素[12]。本组实验亦发现脉管瘤栓的形成与SPN的复发或转移相关。包膜是肿瘤在生长过程中与周围正常组织之间形成的一个纤维性的分隔,恶性肿瘤较少形成包膜,即便形成也会出现包膜的侵犯。实验发现本组约半数SPN存在完整的纤维性包膜,部分包膜内可见肿瘤成分,一定程度上显示了SPN作为恶性肿瘤的生物学特点。但比较有趣的是,侵入包膜内的瘤组织大都平行于包膜生长,仅有极个别垂直突破包膜浸润至周围胰腺组织内,而且统计结果显示,即便SPN呈浸润性生长,也并没有提示更高的复发或转移率,只有当SPN瘤组织侵犯到胰腺外时才和更高的复发或转移率显著相关。因此,作者认为SPN这种生长方式一定程度反映其相对“惰性”的特点。另外,实验发现SPN瘤组织在侵犯神经束时,均表现为环周紧密包绕神经束,而非侵入并破坏神经束,曾有文献报道将这种神经侵犯称为“神经嵌顿”[13],作者认为,SPN在神经侵犯中表现出的这种相对“温和”的特征也同样反映了其生长方式的相对“惰性”。Ki-67是评估细胞增殖的有效指标,很多恶性肿瘤的不良预后均与其有关[14]。SPN作为一种低度恶性肿瘤,绝大多数Ki-67增殖指数较低,所以Ki-67的增殖指数对于SPN预后的预测一直存在疑问,尤其是其临界值的界定。Yang等[8]通过ROC分析寻找并判定SPN的Ki-67临界值,最终发现Ki-67增殖指数≥4%是预测SPN的有效因素。在本组实验中也证实了Ki-67增殖指数≥4%对于预测SPN的转移或复发有意义。
综上所述,SPN虽然具有某些病理学的恶性特征,但其相对“温和”生长方式和良好的预后说明SPN是一种“惰性”的恶性肿瘤,手术完整切除后很少复发或转移[15]。对于脉管内瘤栓形成、胰腺外侵犯及Ki-67增殖指数≥4%的患者,因术后复发或转移风险较高,临床应对这部分SPN患者需长期随访。
[1] Yu P, Cheng X, Du Y,etal. Solid pseudopapillary neoplasms of the pancreas: a 19-year multicenter experience in China[J]. J Gastrointest Surg, 2015,19(8):1433-1440.
[2] Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature[J]. J Am Coll Surg, 2005,200(6):965-972.
[3] Ugras N, Yerci O, Coskun S K,etal. Retrospective analysis of clinicopathological features of solid pseudopapillary neoplasm of the pancreas[J]. Kaohsiung J Med Sci, 2016,32(7):356-361.
[4] Goh B K, Tan Y M, Cheow P C,etal. Solid pseudopapillary neoplasms of the pancreas: an updated experience[J]. J Surg Oncol, 2007,95(8):640-644.
[5] Kang C M, Choi S H, Kim S C,etal. Predicting recurrence of pancreatic solid pseudopapillary tumors after surgical resection: a multicenter analysis in Korea[J]. Ann Surg, 2014,260(2):348-355.
[6] Serrano P E, Serra S, Al-Ali H,etal. Risk factors associated with recurrence in patients with solid pseudopapillary tumors of the pancreas[J]. JOP, 2014,15(6):561-568.
[7] Tang L H, Aydin H, Brennan M F,etal. Clinically aggressive solid pseudopapillary tumors of the pancreas: a report of two cases with components of undifferentiated carcinoma and a comparative clinicopathologic analysis of 34 conventional cases[J]. Am J Surg Pathol, 2005,29(4):512-519.
[8] Yang F, Yu X, Bao Y,etal. Prognostic value of Ki-67 in solid pseudopapillary tumor of the pancreas: huashan experience and systematic review of the literature[J]. Surgery, 2016,159(4):1023-1031.
[9] Naar L, Spanomichou D A, Mastoraki A,etal. Solid pseudopapillary neoplasms of the pancreas: a surgical and genetic enigma[J]. World J Surg, 2017,41(7):1871-1881.
[10] Kim J H, Lee J M. Clinicopathologic review of 31 cases of solid pseudopapillary pancreatic tumors: can we use the scoring system of microscopic features for suggesting clinically malignant potential?[J]. Am Surg, 2016,82(4):308-313.
[11] Ft B, Carneiro F, Rh H. WHO classification of tumours of the digestive system[M]. 4th ed. Lyon:IARC Press, 2010:327-330.
[12] 孟泽武, 陈燕凌, 韩圣华, 等. 胰腺癌术后肝转移的危险因素分析[J]. 中华肿瘤杂志, 2015, 37(4):312-316.
[13] Bergmann F, Ceyhan G O, Rieker R J,etal. Fundamental differences in the neural invasion behavior of pancreatic endocrine tumors: relevance for local recurrence rates?[J]. Hum Pathol, 2009,40(1):50-57.
[14] Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown[J]. J Cell Physiol, 2000,182(3):311-322.
[15] Kang C M, Kim H, Cho Y,etal.Invitroadenosine triphosphate-based chemotherapy response assay (ATP-CRA) in solid pseudopapillary tumor of the pancreas[J]. Pancreas, 2012,41(3):498-500.

