子宫内膜癌中PKD1的表达及其临床意义
赵彩琴,钮红丽
子宫内膜癌中PKD1的表达及其临床意义
赵彩琴,钮红丽
目的探讨蛋白激酶 D1(protein kinase D1,PKD1)在子宫内膜癌组织和正常子宫内膜组织中的表达,并分析其与子宫内膜癌临床病理特征的关系。方法应用免疫组化 SP法及 qRT-PCR法检测92例子宫内膜癌组织和48例正常子宫内膜组织中 PKD1 mRNA及其蛋白的表达,分析 PKD1在子宫内膜癌组织中的表达及其与分化程度、临床分期的关系。应用 Western blot法检测 PKD1蛋白在正常子宫内膜细胞株及不同分化程度的子宫内膜癌细胞株中的表达水平。结果子宫内膜癌组织中的 PKD1 mRNA及蛋白表达水平均显著高于正常子宫内膜组织(P<0.01);PKD1 mRNA及蛋白表达与子宫内膜癌的组织分化程度均有相关性,且组织分化程度越低,临床病理分期越高,PKD1的表达越丰富。PKD1蛋白在子宫内膜癌细胞株中的表达水平也远高于正常子宫内膜细胞中的表达(P<0.01),且癌细胞株的分化水平越低,PKD1蛋白表达的水平越高。结论PKD1在子宫内膜癌患者癌灶中呈高表达,PKD1表达水平的高、低可以做为预测子宫内膜癌恶性程度的一项重要参考依据。
子宫肿瘤;子宫内膜癌;蛋白激酶 D1;表达;病理诊断
子宫内膜癌是妇科常见的恶性肿瘤,其病死率高[1],发病机制目前尚不明确。蛋白激酶D1(protein kinase D1,PKD1)在肿瘤形成的进程中倍受关注,PKD1信号级联反应和胰腺癌、肝癌、胃癌、肠癌、乳腺癌、前列腺癌等的发生、发展密切相关[2-4],其原因在于 PKD1与癌细胞的增殖和分化以及癌细胞生长区域血管的新生密切相关[5]。然而,PKD1和子宫内膜癌的关系鲜有报道,本文通过检测PKD1在不同子宫内膜组织和子宫内膜细胞株中的表达水平,探讨PKD1与子宫内膜癌临床病理特征的关系,为子宫内膜癌的预后判断提供新的参考指标。
1 材料与方法
1.1 临床资料收集2015年3月~2016年3月南阳市第一人民医院诊治的92例有完整临床资料的子宫内膜癌石蜡标本。患者年龄42~71岁,平均(56.1±11.2)岁,均为首次手术患者,术前未行其他治疗。FIGO临床组织学分级及病理分期:高分化癌39例,中分化癌32例,低分化癌21例;Ⅰ+Ⅱ期60例,Ⅲ+Ⅳ期32例。对照组为同期就诊的48例经病理诊断为增殖期或分泌期内膜的刮宫标本:年龄39~66岁,平均(50.8±9.6)岁。新鲜肿瘤组织标本收集2016年3~5月南阳市第一人民医院因子宫内膜癌诊断行子宫切除术患者的癌组织标本,以及同期因人工流产行刮诊手术的子宫内膜标本,剪取0.5 cm3的新鲜肿瘤组织 2块,无菌去离子水冲洗后置RNA later液中,采用 TRIzol法提取总 RNA后,-80℃冰箱储存备用。
1.2 细胞及培养子宫内膜上皮细胞系 ESC和人高分化子宫内膜样腺癌细胞株 Ishikawa由肿瘤科主任赵旭林教授馈赠,中分化子宫内膜癌细胞株 JEC及低分化子宫内膜样腺癌细胞株 KLE购自武汉大学细胞保藏中心。用含10%胎牛血清的RPMI 1640培养基孵育各细胞株,在37℃、5%CO2及饱和湿度的条件下培养,倒置显微镜下观察细胞的贴壁生长情况,待细胞贴壁75%~85%时,用0.25%的胰蛋白酶消化细胞,制备单细胞悬液,以每毫升 1×106个的浓度接种于6孔细胞培养板传代培养,选取对数生长期的细胞,用于后续的实验。
1.3 免疫组化免疫组化采用 SP法,子宫内膜组织用10%的中性福尔马林固定后,石蜡包埋,4μm厚连续切片,固定于经多聚赖氨酸预处理的载玻片上。常规脱蜡后,柠檬酸缓冲液中微波抗原修复 12 ~15min,3%H2O2溶液室温下孵育10min,山羊血清室温下封闭20 min。滴加PKD1抗体(OSP00005W,美国Pierce公司)(1∶125),4℃过夜。羊抗兔 IgG二抗和DAB按照试剂盒(TC1378和 DD1660,武汉博士德公司)说明书执行。PKD1蛋白主要定位于细胞核,呈棕黄色或棕褐色,病理医师采用双盲法阅片,每张切片随机选取阳性细胞富集的10个高倍视野观察(×200)。(1)根据阳性细胞数量所占比计分:无阳性细胞为0分;≤25%为1分;26%~50% 为2分;51%~75%为3分;>75%为4分。(2)根据着色强度计分:未着色为 0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。将两项得分结果相加:0~1分为(-),2分为(+),3~4分为(⧺),>5分为(⧻),其中(+~⧻)为阳性,(-)为阴性。
1.4 qRT-PCR检测 依据 MMLV逆转录试剂盒(RTP50,北京盛科博源公司)说明书,将总RNA逆转成cDNA。qRT-PCR检测严格依据试剂盒说明书操作流程进行:每个反应体系分别加入 SYBER 5 μL,ROX Reference DyeⅡ 0.2μL,上下游引物各0.3μL,cDNA 2μL,加入无酶水至10μL,实时荧光定量 PCR仪上执行40个热循环反应,PCR反应条件:95℃ 30 s预变性,58℃ 30 s,65℃ 15 s。每份样本设3个复孔,实验重复3次。依据内参的标准化算 出 目的 基 因相 对 表达 量,即 RQ=2-ΔΔCT、ΔCTPKD1基因= CTPKD1基因- CTβ-actin基因、ΔΔCT =ΔCTPKD1基因-ΔCT正常子宫内膜组织均值。引 物 PKD1-F:3’-GCATGAGCTAGCCTACAGCC-5’,PKD1-R:3’-CTAATCACGACGCTGGGACT-5′。β-actin-F:3′-GCAGTTGGTTGGAGCAA-5′,β-actin-R:3′-ATGCCGTGGATACTTGGA-5′。
1.5 Western blot检测对数生长期培养细胞 RIPA裂解提取总蛋白,BCA法测定蛋白的浓度。取100μg蛋白上样,行SDS-PAGE电泳,转至PVDF膜上,用 5%的脱脂牛奶封闭2 h,加入 1∶800的PKD1单克隆抗体4℃冰箱中孵育过夜,内参为 βactin;37℃复温1 h,TBST洗膜3次,每次10min;加入1∶2 000的山羊抗兔二抗孵育2 h,TBST洗膜 3次,每次10 min;ECL显影,测量目的条带和内参条带的光密度比值。
1.6 统计学分析采用 SPSS 19.0软件进行统计学分析,实验数据以±s表示,两组间比较采用独立样本t检验、多组间比较采用 F检验,当方差不齐时,采用秩和检验。两变量间的相关性采用Spearman等级相关分析。
2 结果
2.1 PKD1蛋白在不同子宫内膜组织中的表达免疫组化结果显示,PKD1蛋白在子宫内膜癌组中的表达高于正常对照组(t=189.85,P<0.01,表1),PKD1蛋白主要集聚在子宫内膜癌组织中的细胞核中,呈棕黄色或棕褐色;正常子宫内膜组织细胞中 PKD1蛋白呈散在性表达,核阳性的细胞数量极少。39例高分化子宫内膜癌患者中PKD1蛋白主要呈散在性表达,核阳性者22例(56.41%),32例中分化子宫内膜癌患者中 PKD1蛋白主要呈局灶阳性,核阳性者23例(71.88%),21例低分化子宫内膜癌患者中 PKD1蛋白主要呈弥漫阳性,核阳性者18例(85.71%);60例临床Ⅰ+Ⅱ期阳性者 37例(61.67%),PKD1蛋白主要呈散在性和局灶性表达,Ⅲ+Ⅳ期阳性者25例(78.13%),PKD1蛋白主要呈弥漫阳性。PKD1蛋白的表达和肿瘤的组织学分化程度有相关性(rs=0.83,P<0.01),且组织分化程度越低,PKD1蛋白越丰富(F=7.23,P<0.01);与肿瘤临床分期也有相关性(rs=0.69,P<0.05),且临床分期越高,PKD1蛋白越丰富(F=4.54,P<0.05,表2,图1~3)。


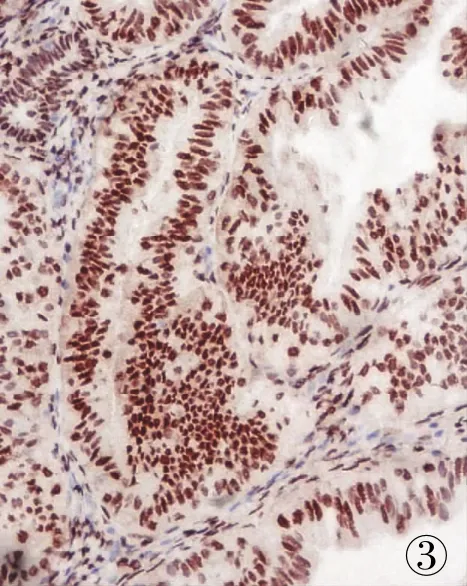
图 1 高分化子宫内膜癌中PKD1的表达,SP法
图 2 中分化子宫内膜癌中PKD1的表达,SP法
图 3 低分化子宫内膜癌中PKD1的表达,SP法
2.2 PKD1 m RNA在不同子宫内膜组织中的表达比较 qRT-PCR检测结果表明,PKD1 mRNA在子宫内膜癌中的表达水平远高于正常对照组(t=33.57,P<0.01,表3),且PKD1 mRNA的表达和肿瘤的组织学分化程度(rs=0.79,P<0.01)及临床分期均呈相关性(rs=0.65,P<0.05);与 PKD1蛋白表达的结果高度吻合,肿瘤组织分化程度越低(F =6.78,P<0.01),临床分期越高(F=8.92,P<0.01),PKD1 mRNA的表达丰度越高(表4)。

表1 PKD1蛋白在正常子宫内膜、子宫内膜癌组织中的表达

表2 PKD1蛋白表达与子宫内膜癌临床病理特征的关系
表3 PKD1 mRNA在正常子宫内膜、子宫内膜癌组织中的表达(±s)

表3 PKD1 mRNA在正常子宫内膜、子宫内膜癌组织中的表达(±s)
组别 n PKD1 mRNA t值 P值正常子宫内膜 48 0.56±0.1333.57 <0.01子宫内膜癌92 3.72±0.35
表4 PKD1 m RNA表达与子宫内膜癌临床病理特征的关系(±s)

表4 PKD1 m RNA表达与子宫内膜癌临床病理特征的关系(±s)
临床病理参数 n PKD1 mRNA F值 P值组织学分级高39 1.82±0.33 中32 3.54±0.97 6.78 <0.01 低21 4.91±1.12临床分期Ⅰ+Ⅱ 60 1.97±0.44 8.92 <0.01Ⅲ+Ⅳ32 4.45±0.82
2.3 PKD1蛋白在不同子宫内膜细胞中的表达PKD1蛋白表达在KLE细胞株中表达最高,其次为JEC、Ishikawa、ESC细胞株中表达;PKD1蛋白在不同子宫内膜细胞中表达,差异有统计学意义(F=7.63,P<0.05,图4,表5)。
表5 PKD1蛋白在不同子宫内膜细胞株中的表达(±s)

表5 PKD1蛋白在不同子宫内膜细胞株中的表达(±s)
细胞株 PKD1 F值 P值ESC 0.073±0.00 Ishikawa 0.542±0.06 7.63 <0.05 JEC 0.713±0.11 KLE 0.896±0.13

图4 PKD1蛋白在不同子宫内膜细胞株中的表达
3 讨论
PKD1属于钙调蛋白依赖性激酶家族成员之一,广泛参与多种细胞内关键信号通路的转导。有文献报道,PKD1涉及肿瘤进展过程中细胞的生长、凋亡、运动及血管生成等作用[6],并且在不同类型的肿瘤发生、发展中发挥不同的生物学功能。如在前列腺癌组织中,PKD1的表达聚集在细胞的胞核中,且比正常的前列腺上皮高[7];在胰腺癌细胞中,PKD1的表达也比正常的胰腺组织高[8],且研究证实,采用特异的PKD1蛋白抑制剂可显著抑制胰腺癌组织生长,缩小肿瘤体积[9]。在肺小细胞癌的报道中也发现,作为 PKC的主要下游靶基因之一,PKD1参与肿瘤的演进进程[10]。相反,在乳腺浸润性导管癌组织中,PKD1的表达却较正常乳腺组织低,激活 PKD1可通过上调 MMP蛋白的表达水平抑制乳腺癌的侵袭和转移[11];在胃癌癌组织的细胞中,由于 PKD1的启动子区域的高度甲基化,使PKD1蛋白的表达水平也远较正常组织低[12]。
本实验通过免疫组化 SP法和qRT-PCR法检测,发现子宫内膜癌组织的 PKD1表达较正常子宫内膜组织明显升高。免疫组化SP法证实,随着子宫内膜癌组织的分化程度由高到低,子宫内膜癌组织细胞核中的PKD1表达则由低到高。qRT-PCR法证实子宫内膜癌组织的分化程度越低,临床分期越高,PKD1 mRNA的表达丰度也越高,且PKD1 mRNA的表达和肿瘤的组织学分化程度及临床分期均有相关性。Western blot实验进一步证实,随着人子宫内膜癌细胞株分化程度的降低,PKD1蛋白表达呈显著升高趋势,而正常的人子宫内膜细胞株中虽能检测到 PKD1蛋白的表达,但远低于人子宫内膜癌细胞株。提示子宫内膜组织中 PKD1的表达可能与子宫内膜癌的发病有相关性,PKD1蛋白的表达升高可能促进子宫内膜癌的发生;且子宫内膜癌组织中PKD1蛋白的表达越高,其恶性程度可能越高,与之前报道的胰腺癌和前列腺癌中 PKD1的表达特征高度相似[7-8],与胃癌及乳腺癌中 PKD1的表达特征相反。最新胰腺癌研究表明,癌组织中 PKD1蛋白表达已成为肿瘤预后判定的重要参考指标[13]。我们推测,PKD1蛋白表达可能作为子宫内膜癌恶性程度高、低及预后判定的重要参考指标。
综上所述,PKD1可以显著上调VEGF的表达,促进CXCL8分泌、胰腺肿瘤生长区域血管的新生和成熟,进而增进癌细胞的生长、存活、运动及细胞骨架重建,为肿瘤的生长发育提供充足的营养来源[14]。PKD1还可以上调癌组织中 MMP的表达,增强其对细胞外基质的降解,促进癌细胞的侵蚀和转移[15]。子宫内膜癌中,PKD1是否发挥同等或类似的作用是我们下一步工作的重点,旨在为 PKD1潜在的可能靶标治疗子宫内膜癌提供理论和实验支持。
[1] 张雅丽,侯安丽,王杏茶,等.84例子宫内膜癌中 Foxp3的表达及临床意义[J].临床与实验病理学杂志,2015,31(7):748 -751.
[2] Evans IM,Bagherzadeh A,Charles M,et al.Characterization of the biological effects of a novel protein kinase D inhibitor in endothelial cells[J].Biochem,2010,429(3):565-572.
[3] di Blasio L,Droetto S,Norman J,et al.Protein kinase D1 regulates VEGF-A-induced alphavbeta3 integrin trafficking and endothelial cellmigration[J].Traffic,2010,11(8):1107-1118.
[4] 刘 暖,杨 雷,毛秉豫,等.蛋白激酶 D1在大鼠骨髓源性内皮祖细胞中的促血管新生作用[J].中国药理学通报,2015,31(9):1259-1264.
[5] 杨 雷,刘 暖,毛秉豫,等.蛋白激酶 D1促血管新生的体内外实验分析[J].中国病理生理杂志,2016,32(1):146-150,155.
[6] Stravodimou A,Voutsadakis IA.Statin use and peripheral blood progenitor cells mobilization in patients with multiple myeloma [J].Clin Transl Oncol,2014,16(1):85-90.
[7] Rozengurt E.Protein kinase D signaling:multiple biological functions in health and disease[J].Physiology(Bethesda),2011,26(1):23-33.
[8] Guha S,Tanasanvimon S,Sinnett-Smith J,et al.Role of protein kinase D signaling in pancreatic cancer[J].Biochem Pharmacol,2010,80(12):1946-1954.
[9] Ziegler S,Eiseler T,Scholz R P,et al.A novel protein kinase D phosphorylation site in the tumor suppressor rabinteractor1 is critical for coordination of cellmigration[J].Mol Biol Cell,2011,22 (5):570-580.
[10]Wong C,Jin Z G.Protein kinase C-dependent protein kinase D activationmodulates ERK signal pathway and endothelial cell proliferation by vascular endothelial growth factor[J].JBiol Chem,2005,280(39):33262-33269.
[11]Kisfalvi K,Hurd C,Guha S,etal.Induced overexpression of protein kinase D1 stimulatesmitogenic signaling in human pancreatic carcinoma PANC-1 cells[J].JCell Physiol,2010,223(2):309 -316.
[12]Eiseler T,Doppler H,Yan IK,etal.Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot[J].Nat Cell Biol,2009,11(5):545-556.
[13]Liou G Y,Storz P.Protein kinase D enzymes:novel kinase targets in pancreatic cancer[J].Expert Rev Gastroenterol Hepatol,2015,9(9):1143-1146.
[14]Sinnett-Smith J,Ni Y,Wang J,etal.Protein kinase D1mediates class IIa histone deacetylase phosphorylation and nuclear extrusion in intestinal epithelial cells:role inmitogenic signaling[J].Am J Physiol Cell Physiol,2014,306(10):961-971.
[15]Aicart-Ramos C,Sanchez-Ruiloba T,Gomez-Parrizas M,et al. Protein kinase D activity controls endothelial nitricoxide synthesis [J].JCell Sci,2014,127(Pt15):3360-3372.
Expression and clinical significance of PKD1 in human endometrial carcinoma
ZHAO Cai-qin,NIU Hong-li
(Department of Reproductive Gynecology of Nanyang First People’s Hospital,Nanyang 473000,China)
PurposeTo investigate the expression of protein kinase D1(PKD1)in endometrial carcinoma and normal endometrium,and to investigate its relationship with the clinicopathological features of endometrial carcinoma.MethodsImmunohistochemical SP and qRT-PCR was used to detect themRNA and protein expression of PKD1 in 92 cases of endometrial cancer and 48 cases of normal endometrium,and to analyze the relationship of expression of PKD1 with the tumor differentiation and clinical stage of endometrial carcinoma tissue.Western blot method was used to detect the expression level of PKD1 protein in normal endometrial cell line and endometrial carcinoma cell lines with different degree of differentiation.ResultsmRNA and protein expression of PKD1 in endometrial carcinoma tissues was significantly higher than those in normal endometrial tissues (P<0.01),which showing a correlation to the degree of tissue differentiation and clinical pathologic staging.While,the expression level of PKD1 protein in endometrial cancer cell lines was alsomuch higher than that in normal endometrial cells(P<0.01),and the lower differentiation,the higher level of PKD1 protein expression.ConclusionPKD1 is highly expressed in endometrial cancer patients.The level of PKD1 expression may be an important reference for predicting themalignant degree of endometrial cancer.
endometrial neoplasm;endometrial carcinoma;protein kinase D1;expression;pathologic diagnosis
R 737.33
A
1001-7399(2017)01-0008-04
10.13315/j.cnki.cjcep.2017.01.003
接受日期:2016-11-20
国家自然科学基金(81473438)、河南省科技攻关课题(122102330049)
河南省南阳市第一人民医院生殖妇科 473000
赵彩琴,女,副主任医师。Tel:(0377)63310287,E-mail:hnnywy611@126.com

