三七总皂苷联合淫羊藿总黄酮改善D—gal致H9c2大鼠心肌细胞衰老的保护作用
李靳+邓丽丽+周志勇+袁丁+张长城+王婷


[摘要]研究三七總皂苷(total saponins of Panax notoginseng,TPNS)联合淫羊藿总黄酮(total flavonoids of epimedium,TFE)改善D-半乳糖(D-galactose,D-gal)致H9c2大鼠心肌细胞衰老的保护作用及可能机制。采用50 mol·L-1D-gal处理H9c2大鼠心肌细胞,以不同浓度TPNS单药、TFE单药、TPNS联合TFE预处理细胞4 h,D-gal刺激H9c2心肌细胞24 h,MTT检测细胞活率进而确定协同效果最佳的联合方案;β-半乳糖苷酶染色法鉴定细胞衰老程度;DCFH-DA探针检测细胞内活性氧(reactive oxgen species,ROS)水平;线粒体膜电位法(JC-1)检测线粒体膜电位变化情况;Western blot检测沉默信息调节因子2相关酶类1(silentmating type information regulation 2 Homolog-1,SIRT1),过氧化物酶体激活物受体γ辅激活因子1α(peroxisomal proliferator-activated receptor-coactivator 1α,PGC-1α),沉默信息调节因子2相关酶类3(silentmating type information regulation 2 homolog-3,SIRT3)蛋白表达情况。研究表明TPNS(5 mg·L-1)联合TFE(5 mg·L-1)对H9c2心肌细胞增殖具有显著的协同作用(Q=1.154),因此确定其为协同作用最佳的联合方案;TPNS(5 mg·L-1)联合TFE(5 mg·L-1)显著降低β-半乳糖苷酶染色阳性细胞数目和ROS荧光强度,显著提高线粒体膜电位和SIRT1,PGC-1α,SIRT3蛋白的表达量。TPNS(5 mg·L-1)联合TFE(5 mg·L-1)可产生改善D-gal致H9c2大鼠心肌细胞衰老的保护作用,机制可能与调节SIRT1/PGC-1α和SIRT3信号通路,进而调控线粒体的功能和减少氧化应激损伤有关。
[关键词]三七总皂苷; TFE; 衰老
[Abstract]To investigate the protective effect of Panax notoginseng saponins combined with total flavonoids of epimedium on D-gal-induced senescence of H9c2 cells and explore its underlying mechanisms. The 50 mol·L-1D-gal was used to induce H9c2 cells senescence. Different concentrations of TPNS, TFE, and TPNS combined with TFE were used for 4 hours for pre-treatment. D-gal was used to stimulate H9c2 cardiac muscle cells for 24 h. Then in order to determine the best combined scheme, MTT was used to detect cell viability. Cell senescence was identified by β-galactosidase staining. Levels of reactive oxygen species(ROS) was observed by DCFH-DA detection. The changes of mitochondrial membrane potential were identified by JC-1 detection. Protein levels of silentmating type information regulation 2 Homolog-1(SIRT1), peroxisomal proliferator-activated receptor-coactivator 1α(PGC-1α) and silentmating type information regulation 2 Homolog-3(SIRT3) were detected by western blot analysis. The results showed that TPNS(5 mg·L-1) combined with TFE(5 mg·L-1) had significant synergistic effect on H9c2 myocardial cell proliferation(Q=1.154), so 5 mg·L-1TPNS combined with 5 mg·L-1 TFE was determined as the best scheme. The quantity of β-galactosidase staining and the fluorescence intensity of ROS were apparently decreased in 5 mg·L-1TPNS combined with 5 mg·L-1TFE scheme. Meanwhile, it markedly increased the florescence intensity of mitochondrial membrane potential and enhanced the protein expression of SIRT1, PGC-1α and SIRT3. TPNS combined with TFE could protect H9c2 cells from D-gal-induced senescence. The mechanism might be related to adjusting the signal pathways of SIRT1/PGC-1α, SIRT3, adjusting the structure and function of mitochondria and reducing oxidative stress injury.
[Key words]total saponins of Panax notoginseng; total flavonoids of epimedium; senescence
随着年龄的增长,由心脏衰老导致的心血管疾病接踵而至,严重威胁患者的生命。心肌细胞是心脏发挥功能的主要细胞,研究发现心肌细胞衰老可导致心血管疾病[1]。心肌细胞衰老的作用机制仍不清楚,因此寻找延缓心肌细胞衰老的有效药物对防治心血管疾病的发生发展具有重要意义。
三七总皂苷(total saponins of Panax notoginseng,TPNS)具有抗氧化应激的作用[2]。TPNS对H9c2大鼠心肌细胞衰老具有保护作用[3]。TFE具有消除氧自由基,抗氧化应激等作用[4], 淫羊藿总黄酮(total flavonoids of epimedium,TFE)可通过减轻氧化应激和减少细胞早期凋亡来对抗H9c2大鼠心肌细胞衰老[5]。然而,TPNS联合TFE对D-gal致H9c2大鼠心肌细胞衰老的保护作用及机制研究尚未见国内(外)文献报道。因此本实验建立心肌细胞衰老模型,探讨TPNS联合TFE改善H9c2大鼠衰老心肌细胞的保护作用及可能机制。
1 材料
1.1 细胞株 H9c2大鼠心肌细胞,购于中国科学院典型培养物保藏委员会细胞库。
1.2 药物与试剂 TPNS(购于成都植标化纯生物技术有限公司,质量分数>95%);TFE(购于成都仁诚生物科技有限公司,质量分数80%);D-gal(Sigma公司,1724619);高糖DMEM(GIBCO公司,884684);胎牛血清(GIBCO公司,10099141);胰蛋白酶(GIBCO公司,EC2901);细胞衰老特异性-半乳糖苷酶原位染色试剂盒(上海杰美基因医药科技有限公司,GMS10012.1);活性氧检测试剂盒(普利莱基因技术有限公司,C1300);线粒体膜电位检测试剂盒(碧云天生物技术研究所,C2005);SIRT3抗体(Millipore,2199719);SIRT1抗体(Millipore,2465249);β-actin(谷歌生物,GB13001);PGC-1α(Santa Cruz,sc-13067)。
1.3 仪器 生物洁净工作台(苏州安泰空气有限公司);NU-4750E型二氧化碳培养箱(NuAire公司);DMR型多功能显微镜及图像分析系统(Syngne公司);JA2003电子分析天平(上海天平仪器厂)。
2 方法
2.1 细胞培养及给药 基于前期工作基础[2,4],H9c2大鼠心肌细胞培养于DMEM培养基中(含10%胎牛血清、青霉素100 U·mL-1、链霉素100 U·mL-1)。将培养瓶放于37 ℃,5%CO2无菌培养箱中,当H9c2大鼠心肌细胞长到80%时,用0.25%胰蛋白酶消化传代,接种于24或96孔板中,在培养箱中培养24 h,分别加入不同浓度TPNS单药、TFE单药、TPNS联合TFE培养H9c2大鼠心肌细胞4 h,再加入D-gal(50 mol·L-1)培养24 h。正常对照组细胞在相同条件下培养24 h后每隔12 h换液1次,D-半乳糖组细胞在相同环境下直接加入50 mol·L-1 D-gal刺激24 h。
2.2 MTT法检测H9c2大鼠心肌细胞活率 H9c2大鼠心肌细胞悬液以5×103 个/mL接种于96孔板,每孔100 μL,设置10个组:①正常对照组;②D-半乳糖组(50 mol·L-1);③TPNS单药组(5 mg·L-1);④TPNS单药组(25 mg·L-1);⑤TFE单药组(5 mg·L-1);⑥TFE单药组(25 mg·L-1);⑦TPNS(5 mg·L-1)联合TFE(5 mg·L-1)组;⑧TPNS(5 mg·L-1)联合TFE(25 mg·L-1)组;⑨TPNS(25 mg·L-1)联合TFE(5 mg·L-1)组;⑩TPNS(25 mg·L-1)联合TFE(25 mg·L-1)组。每个组设置6个复孔。药物作用24 h后弃去上清液,每孔加入终浓度为0.5 mg·L-1 MTT的培养基100 μL,培养4 h后,离心弃去上清液,每孔加入150 μL DMSO,震荡10 min至结晶完全溶解,立即放置在波长于490 nm的酶标仪中检测其吸光度A,確定协同效果最佳的方案。
2.3 β-半乳糖苷酶染色检测H9c2大鼠心肌细胞衰老程度 H9c2大鼠心肌细胞悬液以1×105个/mL接种于24孔板中,每孔1 mL,根据MTT法确定的最佳联合方案,设置5个组:①正常对照组;②D-半乳糖组(50 mol·L-1);③TPNS单药组(5 mg·L-1);④TFE单药组(5 mg·L-1);⑤TPNS(5 mg·L-1)联合TFE(5 mg·L-1)组,每孔设置6个复孔,作用24 h后,弃去上清液,每孔加入500 μL的清理液清理细胞表面,弃去清理液,每孔中加入500 μL的固定液,室温孵育5 min后,弃去固定液,每孔加入500 μL的酸性液清洗细胞表面,弃去酸性液,每孔加入400 μL提前预热的染色工作液, 37 ℃恒温箱孵育16 h,在100倍光学显微镜(视野50 μm)下观察细胞染成蓝色的情况。
2.4 DCFH-DA探针法检测H9c2大鼠心肌细胞内ROS荧光强度 H9c2大鼠心肌细胞悬液以1×105 个/mL接种于24孔板中,每孔1 mL,分组同2.3项下,每孔设置6个复孔,作用24 h后,弃去上清液,加入1 mL,10 μmol·L-1的DCFA-DA溶液,将其放入37 ℃恒温箱中孵育1 h,用不含FBS的DMEM小心地将细胞清洗3遍,倒置荧光显微镜(100倍,视野50 μm)下观察荧光强度。
2.5 JC-1检测H9c2大鼠心肌细胞线粒体膜电位水平 H9c2大鼠心肌细胞悬液以1×105 个/mL接种于24孔板中,每孔1 mL,分组同2.3项下,每孔设置6个复孔,作用24 h后,弃去上清液,加入JC-1染色工作液,在37 ℃恒温相中孵育20 min后终止孵育,弃去工作液,用JC-1染色缓冲液清洗2遍后,弃去缓冲液,第3遍加入JC-1染色缓冲液,在倒置荧光显微镜(100倍,视野50 μm)下观察荧光强度。
2.6 蛋白免疫印迹检测SRIT1,PGC-1,SRIT3蛋白表达情况 H9c2大鼠心肌细胞悬液以5×105 个/mL接种于6孔板中,每孔2 mL,分组同2.3项下,每孔设置6个复孔,作用24 h后,收集细胞,裂解细胞并提取总蛋白,根据BCA蛋白定量法检测各蛋白浓度,采用95 ℃灭活10 min,依次进行电泳,转膜,封闭,一抗孵育,二抗孵育,采用凝胶成像系统进行检测。
2.7 统计学方法 蛋白免疫印迹图像采用Image J软件分析,数据采用SPSS 16.0软件分析,以±s表示,各组间数据比较采用t检验,P<0.05为差异具有统计学意义。
判断药物联合作用的性质采用金正均法计算Q值。Q=Ea+b/(Ea+Eb-Ea×Eb)进行计算,其中Ea+b为 A,B 2药合用时对细胞的效率,Ea为A药对细胞的效率,Eb为B药对细胞的效率;Q值<0.55为明显拮抗,0.55~ 0.85为拮抗,0.85~1.15为单纯相加,1.15~2.0为增强,>2.0为明显增强。
3 结果
3.1 TPNS联合TFE对衰老H9c2大鼠心肌细胞活率的影响 与正常对照组比较,D-gal组细胞的活率显著下降(P<0.05);与D-gal组比较,随着TPNS和TFE浓度的增加,细胞活率逐渐增加(P<0.05),而TPNS联合TFE对细胞活率的增加更为明显(P<0.05),与TPNS单药、TFE单药组比较,各联合用药组中细胞活率显著增加(P<0.05),且各联合用药具有相加或者协同作用,其中TPNS 5 mg·L-1联合TFE 5 mg·L-1协同效果最好(Q=1.154),因此选择TPNS 5 mg·L-1联合 TFE 5 mg·L-1组为最佳联合方案,见表1。
3.2 TPNS联合TFE对衰老H9c2大鼠心肌细胞内β-半乳糖苷酶活性的影响 与正常对照组比较,D-gal组中大量的H9c2大鼠心肌细胞被染成蓝色,与D-gal组比较,5 mg·L-1 TPNS单剂量组、5 mg·L-1TFE单剂量组中被染成蓝色的H9c2大鼠心肌细胞数量减少,与D-gal 组、5 mg·L-1TPNS单剂量组及5 mg·L-1TFE单剂量相比,5 mg·L-1TPNS联合5 mg·L-1TFE组中被染成蓝色的H9c2大鼠心肌细胞数量显著减少,见图1。
3.3 TPNS联合TFE对衰老H9c2大鼠心肌细胞内ROS的影响 与正常对照组比较,D-gal组中ROS的荧光强度显著增强,与D-gal组比较,5 mg·L-1TPNS单剂量组及5 mg·L-1TFE单剂量组中ROS的荧光强度均降低,与D-gal 组、5 mg·L-1TPNS单剂量组及5 mg·L-1TFE单剂量比较,5 mg·L-1TPNS联合5 mg·L-1TFE组中ROS的荧光强度显著降低。见图2。
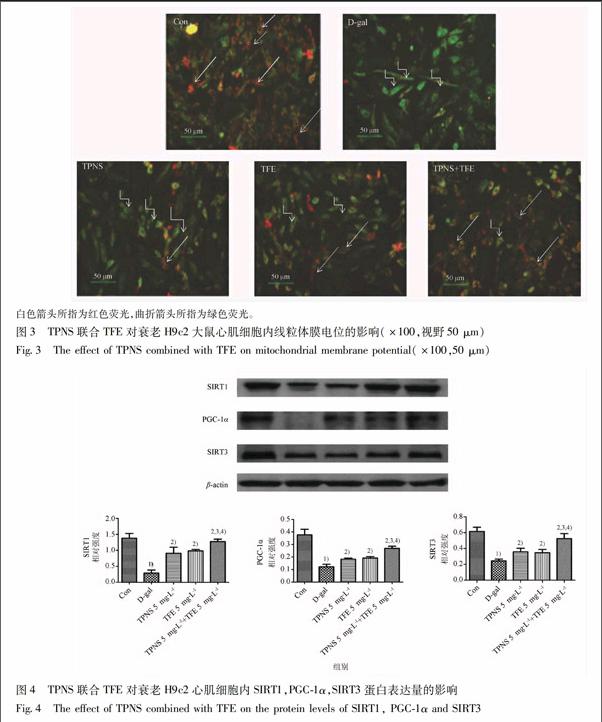
3.4 TPNS联合TFE对衰老H9c2大鼠心肌细胞内线粒体膜电位的影响 与正常对照组比较,D-gal组中绿色荧光强度增强,而红色荧光微弱;与D-gal组比较,5 mg·L-1TPNS单剂量组以及5 mg·L-1TFE单剂量组中红色荧光增强而绿色荧光减弱,与D-gal组、5 mg·L-1TPNS单剂量组以及5 mg·L-1TFE單剂量比较,红色荧光显著增强,绿色荧光显著减弱。见图3。
3.5 TPNS联合TFE对衰老H9c2心肌细胞内SIRT1,PGC-1α,SIRT3蛋白表达量的影响 与正常对照组比较,D-gal组中,SIRT1,PGC-1α以及SIRT3蛋白表达量显著降低(P<0.05);与D-gal组比较,5 mg·L-1TPNS单剂量组以及5 mg·L-1TFE单剂量组中SIRT1,PGC-1α以及SIRT3蛋白表达量增加(P<0.05);与D-半乳糖组,5 mg·L-1TPNS单剂量组以及5 mg·L-1TFE单剂量组相比,5 mg·L-1TPNS联合5 mg·L-1TFE组中SIRT1,PGC-1α,SIRT3蛋白表达量显著增加(P<0.05)。见图4。
4 讨论
中医理论认为,衰老是由肾虚血瘀导致[6]。《难经》云:“肾者,原气之所系”。《医林改错》云:“元气既虚,必不能达于血管,血管无气必停留而为瘀。血府,血之根本,瘀则殒命”。提示肾虚必然导致血瘀,血瘀是促使衰老的重要因素之一。因此将补肾与活血有机结合起来组成补肾活血方改善肾虚血瘀的状态进而延缓衰老。
心脏衰老是导致心功能衰退和各种心血管疾病的主要因素,中医理论认为,肾中精气虚衰必然导致心脏功能衰退[7]。因此肾虚血瘀是导致心脏衰老的主要原因之一,补肾活血方是防治心脏衰老的基本治则。现代研究显示,补肾中药通过调节线粒体结构与功能进而延缓心脏衰老[8]。
淫羊藿为小檗科淫羊藿属植物,《本草纲目》云:“淫羊藿,益精气,坚筋骨,补腰膝,强心力”。TFE是淫羊藿的主要成分。现代研究表明:TFE具有补肾壮阳、延缓衰老的药理作用[9]。三七为五加科多年生草本植物,《医学衷中参西录》云:“三七,善化瘀血,为吐衄要药”。提示三七具有活血化瘀之功效。TPNS是三七主要成分,與三七生药相比,药效突出。胡志洁研究结果显示TPNS具有抑制动脉硬化,防治心肌缺血,降血脂的功能[10]。因此TPNS与TFE相结合组成补肾活血方延缓衰老。本实验结果显示,与D-gal 组、TPNS单剂量组以及TFE单剂量比较,5 mg·L-1TPNS联合5 mg·L-1TFE细胞活率显著且协同作用最佳。
线粒体是真核细胞生物氧化和能量转换的主要场所,线粒体亦是产生活性氧(ROS)的主要场所。大部分研究者认可 “自由基与线粒体衰老理论”。线粒体在病理条件下,电子传递出现障碍,导致线粒体内ROS增加,进一步损伤线粒体膜以及mtDNA等,形成恶性循环,从而导致线粒体衰老[11]。心脏是耗能最多的器官之一,因此心脏中含有大量的线粒体。新近研究表明:线粒体结构与功能损伤及ROS增加是导致心脏衰老的重要原因之一[12]。Escobales N等[13]研究表明线粒体靶向活性氧清除剂:XJB-5-131有效降低衰老大鼠心脏线粒体中ROS含量,同时提高线粒体膜电位水平进而改善由于衰老引起的心血管疾病。Baris O R等 [14]研究显示老龄大鼠心肌线粒体内膜通透性增加、线粒体肿胀、呼吸链功能减退及氧化磷酸化脱偶联。前期研究表明TPNS显著降低衰老H9c2大鼠心肌细胞内ROS的荧光强度[3],显著增加线粒体膜电位水平[15]。TFE通过抗氧化应激改善D-gal致H9c2大鼠心肌细胞衰老[5]。本实验结果表明TPNS联合TFE能有效清除衰老H9c2大鼠心肌细胞内过多的ROS,显著升高线粒体膜电位水平。提示,TPNS联合TFE延缓H9c2大鼠心肌细胞衰老,可能与其减轻氧化应激和调节线粒体结构与功能有关。
研究表明SIRT1/PGC-1α通路与线粒体功能有密切的关系[17-18]。SIRT1去乙酰化线粒体内多种转录因子如PGC-1α,p53等,促进线粒体发生[19]。PGC-1α是线粒体发生的主要调节因子,其能调控心肌氧化程度[20]。白藜芦醇(SIRT1激动剂)可通过诱导细胞激活SIRT1/PGC-1α信号通路,以促进线粒体生物合成进而延缓细胞衰老[21]。衰老小鼠高表达SIRT1时,提高PGC-1α表达,能有效防治心肌肥厚,抑制心肌细胞凋亡[22]。前期研究结果显示TPNS[9]、TFE可能通过调节线粒体SIRT1/PGC-1α途径改善线粒体功能。本实验研究结果表明TPNS联合TFE可显著升高SIRT1/PGC-1α蛋白表达水平。
研究表明SIRT3与线粒体结构与功能有着密切的联系[23]。小分子SIRT3仅存在于心肌细胞的线粒体中,SIRT3对能量生成、代谢、细胞凋亡及线粒体自由基产生起到很重要作用[24]。Chen Y等[25]研究发现SIRT3可以通过上调线粒体内Mn-SOD的表达,进而提高线粒体清除ROS能力。Sundaresan N R等[26]研究发现SIRT3表达缺陷小鼠在第8周出现心肌肥大、纤维化等心脏衰老表现。本实验研究表明TPNS联合TFE能显著提高SIRT3蛋白表达水平。提示,TPNS联合TFE可能通过调节SIRT3信号通路进而调节线粒体结构与功能。
综上所述,TPNS联合TFE对D-gal致H9c2大鼠心肌细胞衰老具有保护作用,这种作用可能与调节SIRT1/PGC-1α,SIRT3信号通路,进而调节线粒体功能和减轻氧化应激有关。
[参考文献]
[1]Mohamed S A, Hanke T, Erasmi A W. Mitochondrial DNA deletions and the aging heart [J]. Exp Gerontol, 2006, 41(5): 508.
[2]A F G Cicero, E Bandieri, R Arletti. Orally administered Panax notoginseng influence on rat spontaneous behaviour[J]. Ethnopharmacol, 2000, 73(3): 373.
[3]李靳,杨莉,万静枝,等.三七总皂苷对D-半乳糖致H9c2细胞衰老的保护作用研究[J]. 中药材,2014,37(8):1421.
[4]孟宁,孔凯,李师翁.淫羊藿植物化学成分及药理活性研究进展[J]. 细胞植物学报,2010,30(5):1063.
[5]李靳,张长城,杨莉,等.淫羊藿总黄酮对D-半乳糖致H9c2细胞衰老的保护作用研究[J]. 中药材,2014,37(12):2255.
[6]成海燕,于建春,李国民,等.衰老-血瘀相关研究概况[J].辽宁中医杂志,2010,37(9):1660.
[7]师双斌. “肾藏精”藏象基础理论核心概念诠释[D].沈阳:辽宁中医药大学,2013.
[8]程莉娟,刘群良,谭峰,等.还少丹对D-半乳糖衰老模型小鼠心肌线粒体DNA缺失的影响[J]. 湖南中医药大学学报,2011,31(5):20.
[9]蒋淑君,许兰芝. 淫羊藿总黄酮的药理作用研究进展[J].中医药学报,2004,32(4):60.
[10]胡志洁,张志耘. 三七总皂苷对心脑血管的药理作用研究[J].天津药学,2006(6):51.
[11]Oyewole A O, Birch-Machin M A. Mitochondria-targeted antioxidants[J]. FASEB J, 2015,29(12):4766.
[12]Paradies G, Petrosillo G, Paradies V, et al. Oxidative stress, mitochondrial bioenergetics, and cardiolipin in aging [J]. Free Rad Biol Med, 2010, 48(10): 1286.
[13]Nelson Escobales, Rebeca E Nunez, Sehwan Jang, et al. Mitochondria-targeted ROS scavenger improves post-ischemic recovery of cardiac function and attenuates mitochondrial abnormalities in aged rats [J]. J Mol Cell Cardiol, 2014, 77: 136.
[14]Baris O R, Ederer S, Neuhaus J F, et al. Mosaic deficiency in mitochondrial oxidative metabolism promotes cardiac arrhythmia during aging[J]. Cell Metabol, 2015, 21(5): 667.
[15]李靳,張长城,王佼,等.三七总皂苷对抗H9c2细胞线粒体氧化损伤的保护作用研究[J].时珍国医国药,2015,26(12):2851.
[17]Wang Yi, Liang Xingying, Chen Yaqi, et al. Screening SIRT1 activators from medicinal plants as bioactive compounds against oxidative damage in mitochondrial function[J]. Oxid Med Cell Long, 2016, 2016: 1.
[18]Cunninqham K E, Vincent G, Sodhi C P, et al. Peroxisome proliferator-activated receptor γ coactivator 1α (PGC1α) protects against experimental murine colitis[J]. J Biol Chem, 2016, 291(15): 1.
[19]Alcendor R R, Gao S, Zhai P, et al. Sirt1 regulates aging and resistance to oxidative stress in the heart [J]. Circ Res, 2007, 100(10): 1512.
[20]郭茜,郭家彬,李梨,等. PGC-1α与线粒体O生成调控在心血管疾病中的作用[J].中国药理学通报,2013,29(1):1.
[21]Lagouge M. Resveratrol improves mitochondrial function and Protects against metabolic disease by activating SIRT1 and PGC-1a [J]. Cell, 2006, 127(6): 1.
[22]Alcendor R R, Gao S, Zhai P, et al. Sirt1 regulates aging and resistance to oxidative stress in the heart [J]. Circ Res, 2007, 100(10): 1512.
[23]Cheng A, Yang Y, Zhou Y, et al. Mitochondrial SIRT3 mediates adaptive responses of neurons to exercise and metabolic and excitatory challenges [J].Cell Metab, 2016, 23(1): 128.
[24]Ahn B H, Kim H S, Song S, et al. A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J]. Proc Natl Acad Sci USA, 2008, 105(38): 14447.
[25]Chen Y, Zhang J, Lin Y, et al. Tumour suppressor SIRT3 deacetylates and activates manganese superoxide dismutase to scavenge [J]. Ros Embo Rep, 2011, 12(6): 534.
[26]Sundaresan N R, Gupta M, Kim G, et al. Sirt3 blocks the cardiac hypertrophic response by augmenting Foxo3a-dependent antioxidant defense mechanisms in mice[J]. J Clin Invest, 2009, 119(9): 2758.
[责任编辑 张宁宁]

