大肠杆菌工程菌利用甘蔗糖蜜发酵产L—乳酸研究
赵锦芳++薛葳蕤++张晓敏++王永泽+王金华
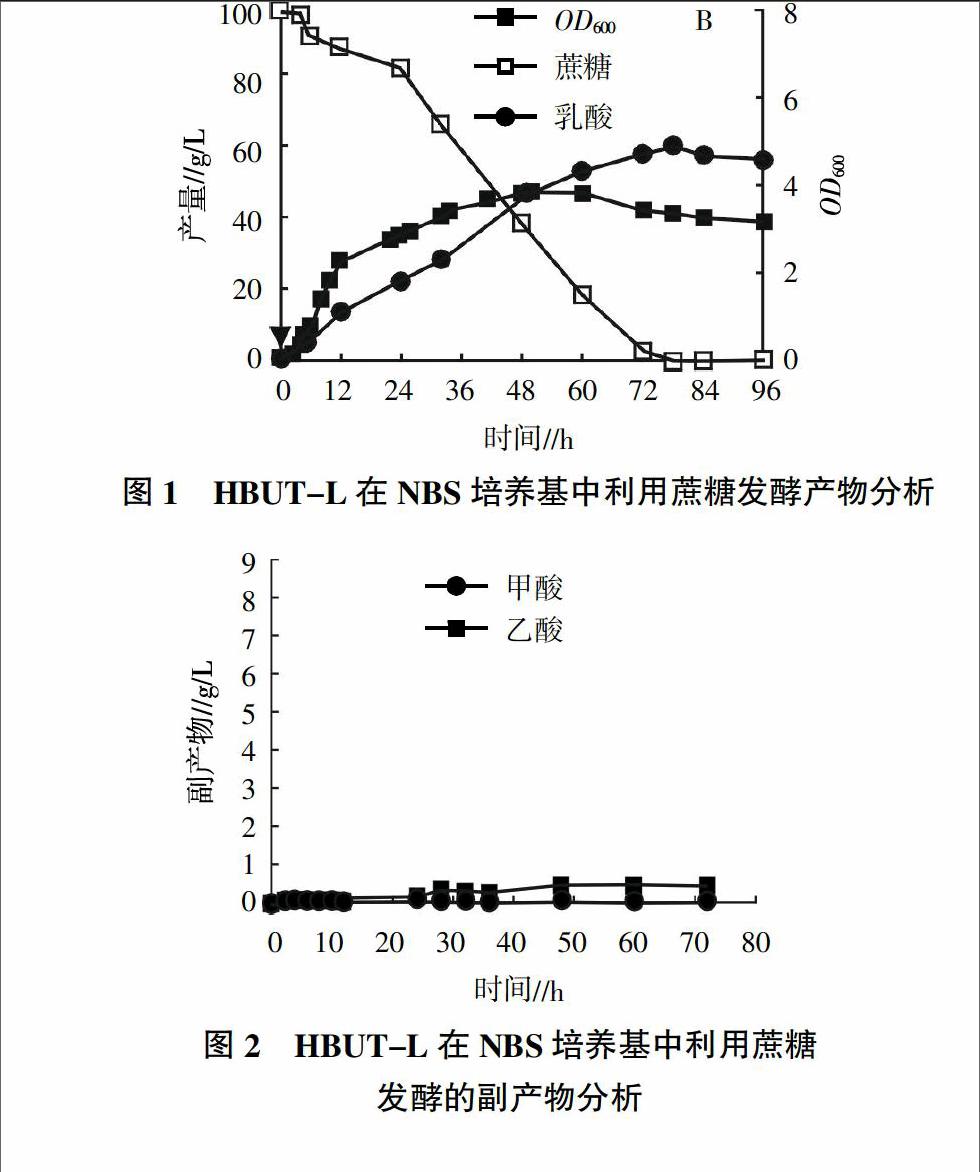

摘要:大肠杆菌HBUT-L来源于HBUT-D,因此具有快速利用蔗糖的特性。对HBUT-L利用蔗糖及甘蔗糖蜜发酵产L-乳酸的特性进行了研究。结果表明,该菌株在96 h的发酵过程中,可將100 g/L的蔗糖转化生成60.0 g/L乳酸,转化率达到74.0%,杂酸产量少,具有工业化开发潜力。在玉米浆培养基中可以直接添加未经处理的甘蔗糖蜜,发酵周期持续224 h,发酵液所得乳酸产量为87.0 g/L,发酵液残糖为28.6 g/L,但乳酸产率极低,仅为0.389 g/(L·h),后续将对甘蔗糖蜜预处理工艺进行研究,进一步提高乳酸发酵速度和产量。
关键词:大肠杆菌工程菌;甘蔗糖蜜;发酵;L-乳酸
中图分类号:TQ92 文献标识码:A 文章编号:0439-8114(2016)24-6541-04
L-乳酸是一种重要的有机酸,广泛应用于食品、医药和化工领域,L-乳酸最具前景的应用在于聚乳酸(PLA),PLA是一种可降解的、具有良好使用性能的生物相容性高分子材料,用于制造可生物降解塑料,近些年一直成为关注和研究的热点[1]。但是,由于乳酸生产成本偏高,使得聚乳酸制造成本居高不下,难以在价格上与传统塑料竞争。因此,如何高效低成本地生产L-乳酸显得尤为重要[2]。
微生物发酵法生产乳酸因其原料来源广泛、产品光学纯度高、安全性高等优点已成为生产乳酸的主要方法。目前发酵工业上生产乳酸的原料主要是淀粉质原料,常用的有大米、小麦、玉米、马铃薯、红薯、木薯等,这也是造成乳酸生产成本较高的原因之一。由于乳酸及其衍生物应用研究的不断深入,利用农业废弃物、制浆造纸污泥、纺织废料和食品工业含糖废料和下脚料等作为廉价碳源进行乳酸发酵,已经成为该领域的研究热点,一方面可以解决废弃物的资源化问题,同时还能够降低乳酸的生产成本[3,4]。
甘蔗糖蜜是糖厂生产过程中的主要副产品,其干固物中含有约40%的蔗糖和15%的还原糖,可作为微生物发酵的碳源,甘蔗糖蜜可用于发酵生产多种产品,如乙醇、味精、柠檬酸、赖氨酸、焦糖色素等。目前国内尚未有利用甘蔗糖蜜发酵制L-乳酸的工业化生产,甘蔗糖蜜用于乳酸发酵相关报道还仅限于实验室研究阶段。黄靖华等[5]经过诱变筛选得到一株鼠李糖乳杆菌SCT-10-10-60,可利用甘蔗糖蜜为原料发酵生产L-乳酸,发酵40 h后,L-乳酸的产量最高可以达到106 g/L。汪群慧等[6]分离纯化并获得一株乳酸杆菌FM37,采用正交设计试验对其进行糖蜜发酵产L-乳酸的研究,并得出初始糖浓度对乳酸产量的影响最显著。广西大学秦菊蔽等[7]通过诱变筛选获得一株米根霉,并对其以蔗糖及甘蔗糖蜜为碳源生产L-乳酸的发酵条件进行了研究。
近年来,国内外开始研究使用大肠杆菌(Escherichia coli)基因工程菌发酵生产L-乳酸。大肠杆菌具有遗传背景清楚、易操作、易调控、培养基要求简单和生长迅速等优点,易于进行工业化大规模生产。野生大肠杆菌在糖酵解过程中产生一系列有机酸(甲酸、乙酸、琥珀酸、乳酸)和乙醇等[8],乳酸占总代谢产物不到50%。因此,需要通过代谢工程手段阻断乳酸的竞争性支路,将代谢流引向乳酸的产生,构建高产量、高光学纯度大肠杆菌基因工程菌。本实验室在D-乳酸工程菌HBUT-D(来源于原始菌株E. coli W(ATCC 9637))[9]的基础上,利用染色体插入技术,引入乳酸片球菌(Pediococcus acidilactici)的ldhL基因[10],构建可生产L-型乳酸的大肠杆菌工程菌株HBUT-L(ΔfrdBC,ΔadhE,Δpta,ΔpflB,ΔcscR,ΔaldA,ΔldhA∶∶ldhL)。该菌株能在无机盐培养基中高效利用葡萄糖进行L-型乳酸发酵,并能利用蔗糖发酵产L-乳酸,发酵60 h后,L-乳酸产量达到81.92 g/L,光学纯度可达到99.9%,糖酸转化率为82%[11,12],具有极大的工业化应用价值。
本研究主要利用甘蔗糖蜜为碳源,研究大肠杆菌工程菌生产L-乳酸的发酵特性,以此为低成本L-乳酸工业化生产提供技术参考,同时也为开发糖厂废蜜高附加值产品奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 Escherichia coli HBUT-L(ΔfrdBC,ΔadhE,Δpta,ΔpflB,ΔcscR,ΔaldA,ΔldhA∶∶ldhL)由本试验构建和保藏,该菌株是以可利用蔗糖发酵产D-乳酸的工程菌HBUT-D为出发菌株,利用同源重组技术敲除其D-乳酸脱氢酶基因,同时插入乳酸片球菌的L-乳酸脱氢酶基因(1dhL),并带有自身启动子序列,该工程菌具有良好的L-乳酸发酵特性。
1.1.2 原料和培养基 甘蔗糖蜜购自广西柳州蔗糖厂,总糖含量为48%,其中蔗糖为主,占51.7%,其次为果糖,含量为30.6%,葡萄糖最低,为17.7%,保存于4 ℃冰箱备用,使用时按重量比1∶3加去离子水稀释后,经0.45 μm滤膜过滤,在121 ℃条件下灭菌15 min。玉米浆由山东潍坊盛泰药业有限公司提供,使用时无需预处理,115 ℃灭菌30 min后直接使用。
种子培养基:NBS培养基[13],添加2%蔗糖。
无机盐发酵培养基:NBS培养基,添加10%蔗糖,再加入1 mmol/L甜菜碱。
玉米浆发酵培养基:玉米浆直接添加甘蔗糖蜜,使培养基中蛋白质含量在20 g/L左右,总糖含量达到10%。添加2 mmol/L甜菜碱。
1.1.3 主要仪器设备 BIOSTAT?誖Bplus发酵罐(德国赛多利斯公司),722型可见分光光度计(上海精密科学仪器有限公司),Agilent 1200 series反相高效液相色谱仪(美国安捷伦科技公司),恒温摇床(上海智诚分析仪器制造有限公司),恒温振荡培养箱(上海智诚分析仪器制造有限公司)。
1.2 方法
1.2.1 种子培养 将HBUT-L接种于NBS蔗糖固体平板,于37 ℃培养箱中培养24~48 h,接入种子培养基中(1 000 mL三角瓶,装液量500 mL),200 r/min,37 ℃條件下摇瓶培养至菌体浓度(OD600)达到1.2~1.5。
1.2.2 发酵方式 NBS培养基发酵:按5%的接种量接入带有自动调节系统的7 L发酵罐中,装有体积为4 L NBS培养基。发酵罐条件为初始糖含量10%,转速200 r/min,37 ℃,以6 mol/L KOH作为中和剂,采用流加方式控制pH稳定在7.0左右。定时取样,检测OD值、糖浓度、L-乳酸产量及其他杂酸浓度。
玉米浆培养基发酵:接种量为10%,其他操作同上。
1.2.3 发酵产物分析 OD值采用紫外分光光度计测量,波长选定600 nm;所取发酵液样品在10 000 r/min条件下离心10 min,去除细胞残留,收集上清液用于测定残糖及其他代谢产物的含量。残糖含量和有机酸检测采用高效液相色谱法(HPLC)检测。Agilent 1200 series反相高效液相色谱仪检测条件为[14]色谱柱:Bio-Rad HPX 87H;流动相:4 mmol/L H2SO4;检测器:示差检测器;柱温:35 ℃;进样量: 20 μL;流速:0.5 mL/min。乳酸光学纯度采用HPLC测定检测条件为:色谱柱:NUCLEOSIL 120-5 Chiral-L;流动相:0.2 mmol/L H2SO4;紫外检测器240 nm;柱温:35 ℃;进样量:10 μL;流速:0.5 mL/min。
1.2.4 计算方法 乳酸和蔗糖浓度以发酵初始体积(4 L)计算,其浓度由测量值乘以发酵体积(初始体积与加碱体积之和,取样体积忽略不计)再除以发酵初始体积计算得到。
2 结果与分析
2.1 HBUT-L在NBS培养基的发酵特性
大肠杆菌工程菌HBUT-L厌氧条件下,在含有10%蔗糖的4 L无机盐培养基中发酵,发酵过程中定期取样,检测细胞生物量、残糖和乳酸产量,结果如图1所示。工程菌HBUT-L来源于HBUT-D,因此具有快速利用蔗糖的特性,发酵到48 h时OD600达到4.16,之后进入稳定期。96 h发酵结束。经检测,发酵液中乳酸产量为60.0 g/L,转化率达到74.0%,乳酸产率最大值达到0.98 g/(L·h)。
发酵液中主要代谢产物为乳酸,仅有少量乙酸和甲酸产生,其产量分别为0.39、0.06 g/L,发酵液中未检测到琥珀酸及乙醇产生,结果如图2所示。发酵液中杂酸产量少,乳酸浓度占总酸产量的99.3%,有利于后续的分离纯化。
对HBUT-L发酵产生的L-乳酸进行光学纯度分析(图3),经检测光学纯度达到99.3%以上。该结果说明通过乳酸脱氢酶基因的替换(ldhL→ldhA),可发酵产生高光学纯度L-乳酸。
2.2 HBUT-L在玉米浆培养基中的发酵特性
大肠杆菌工程菌HBUT-L可利用玉米浆和蔗糖糖蜜发酵生产L-乳酸,其发酵结果如图4所示,整个发酵周期持续至224 h,经检测,发酵液中乳酸产量为87.0 g/L。本研究中所用甘蔗糖蜜中蔗糖占主要成分,还含有果糖和葡萄糖,其液相色谱图见图5。发酵结束后,总残糖为28.6 g/L,其中果糖浓度最高,为23.2 g/L,其次为蔗糖和葡萄糖,由此可见,HBUT-L可有效利用蔗糖和葡萄糖,同时也能部分利用果糖。HBUT-L来源于HBUT-D菌株,为了促进蔗糖代谢操纵子基因cscA、cscB、cscK的表达,其蔗糖启动子抑制基因cscR已经被敲除掉,因此,蔗糖可以被有效的转运并进一步水解生成果糖,但是果糖地累积说明HBUT-L对果糖的代谢和利用是不完全的,推测原因可能是由于果糖激酶活力不高。Sabri等[15]也报道指出,蔗糖的充分利用需要3种酶的协同作用,蔗糖透过酶CscB、蔗糖水解酶CscA和果糖激酶CscK,因此,后续可以对HBUT-L进一步进行分子改良和遗传驯化,提高其蔗糖和果糖的利用效率。
本研究所得甘蔗糖蜜乳酸发酵产率很低,仅有0.389 g/(L·h),推测甘蔗糖蜜中的某些物质可能阻碍了微生物生长和发酵,使发酵周期延长。有文献也报道指出,甘蔗糖蜜含有胶体物质、灰分和其他悬浮物质,这些杂质可能会妨碍微生物的生长和发酵。因此,糖蜜在使用前,一般要根据发酵菌株的要求进行合适的前处理,发酵过程中可能还需添加一些其他营养成分[16]。本试验所用糖蜜只经过稀释和高压灭菌,没有进行过预处理。可进一步研究甘蔗糖蜜的预处理,以除去其中的抑制发酵的物质,缩短发酵周期。
3 小结与讨论
研究利用来源丰富、廉价的发酵底物甘蔗糖蜜也成为人们关注的热点。中国是世界上第三大产糖国,甘蔗制糖是制糖行业的主体,但是在甘蔗制糖过程中会产生大量的废糖蜜和蔗渣,目前大部分制糖企业利用废糖蜜生产乙醇,但所得的乙醇废液中COD高达104~105 mg/L以上。因此,如何合理有效地将制糖工业加工副产物进行资源化利用,已经成为一项重要的研究课题,一方面能变废为宝,创造经济价值,同时又能解决环境污染问题。
本研究中所采用的工程菌HBUT-L,同其出发工程菌HBUT-D一样,也来源于野生型菌株E. coli W(ATCC 9637,Scr+),该野生菌作为为数不多的Scr+型菌,具有可直接利用蔗糖的能力[17]。同时,该工程菌保留了ppc基因(磷酸烯醇丙酮酸羧化酶),仍具有合成氨基酸的能力,因此发酵过程中可直接利用无机盐培养基,降低了对营养成分的需求,可进一步减少生产成本。蔗糖发酵结果显示HBUT-L的乳酸产量为60.0 g/L,光学纯度可达到99%以上,杂酸产量少,具有很大的工业化应用潜力。
玉米浆含有可溶性蛋白质、生物素、无机盐等,营养丰富,常常被用作细菌发酵的有机氮源,以取代昂贵的酵母粉、牛肉膏。但是,利用玉米浆发酵产L-乳酸仍存在产量低的问题,很难达到工业化的要求,并且常常需要向玉米浆中添加其他物质或需对其进行特殊处理。本研究在前期已经通过试验证实,HBUT-L在玉米浆发酵培养基中能生长,并且可高效快速地将葡萄糖转化成L-乳酸,经过50 h厌氧发酵,乳酸产量可达到108.3 g/L,糖酸转化率在97%以上,产率为2.16 g/(L·h)[18]。
目前,国内一般不宜直接利用甘蔗糖蜜发酵生产L-乳酸,本研究所采用的工程菌HBUT-L在玉米浆发酵培养基中可以发酵甘蔗糖蜜产L-乳酸,甘蔗糖蜜在没有经过预处理条件下,发酵周期需要224 h,乳酸产量为87.0 g/L,发酵液残糖为28.6 g/L,乳酸产率仅为0.389 g/(L·h),后续将进一步对甘蔗糖蜜预处理工艺进行研究,提高乳酸发酵速度和产量,为制糖工业加工副产物的资源化利用和L-乳酸工业化生产提供技术参考。
参考文献:
[1] WEE Y J,KIM J N,RYU H W.Biotechnological production of lactic acid and its recent applications[J].Food Technology and Biotechnology,2006,44(2):163-172.
[2] 田康明,周 丽,陈献忠,等.L-乳酸的发酵生产和聚L-乳酸的化学加工[J].中国生物工程杂志,2011,31(2):102-115.
[3] JOHN R P,NAMPOOTHIRI K M,PANDEY A. Fermentative production of lactic acid from biomass:An overview on process developments and future perspectives[J].Applied Microbiology and Biotechnology,2007,74(3):524-534.
[4] 黄谷亮,周晓薇,郭海蓉.糖蜜发酵制乳酸的市场前景[J].广西蔗糖,2003(4):31-32.
[5] 黄靖华,孙 靓,吴军华,等.甘蔗糖蜜发酵生产L-乳酸工艺条件研究[J].广西科学,2011,18(3):273-277.
[6] 汪群慧,马鸿志,王旭明,等.甜菜糖蜜乳酸发酵工艺参数的优化及酵母膏替代物的初探[J].环境科学,2004(s1):59-62.
[7] 秦菊蔽,苏 萍,黄谷亮,等.甘蔗糖蜜用米根霉发酵产乳酸的研究[J].食品工业,2008(5):44-46.
[8] CLARK D P.The fermentation pathways of Escherichia coli[J].FEMS Microbiology Letters,1989,63(3):223-234.
[9] WANG Y,TIAN T,ZHAO J,et al.Homofermentative production of d-lactic acid from sucrose by a metabolically engineered Escherichia coli[J].Biotechnology Letters,2012,34(11):2069-2075.
[10] ZHOU S,CAUSEY T B,HASONA A,et al.Production of optically pure D-lactic acid in mineral salts medium by metabolically engineered Escherichia coli W3110[J].Appl Environ Microbiol,2003,69(1):399-407.
[11] WANG Y,LI K,WANG J,et al.Engineering and adaptive evolution of Escherichia coli W for L-lactic acid fermentation from molasses and corn steep liquor without additional nutrients[J].Bioresource Technology,2013,148:394-400.
[12] 趙 筱,李坤朋,赵锦芳,等.高光学纯度L-乳酸工程菌的构建及其蔗糖发酵[J].食品与发酵科技,2012(5):40-45.
[13] VIJAYAKUMAR J,ARAVINDAN R,VIRUTHAGIRI T.Recent trends in the production,purification and application of lactic acid[J].Chem Biochem Eng Q,2008,22(2):245-264.
[14] ZHAO J,XU L,WANG Y,et al. Homofermentative production of optically pure L-lactic acid from xylose by genetically engineered Escherichia coli B[J].Microbial Cell Factories,2013, 12(1):57.
[15] SABRI S,NIELSEN L K,VICKERS C E. Molecular control of sucrose utilization in Escherichia coli W,an efficient sucrose-utilizing strain[J].Appl Environ Microbiol,2013,79(2):478-487.
[16] NI Y,WANG Y,SUN Z. Butanol production from cane molasses by Clostridium saccharobutylicum DSM 13864:Batch and semicontinuous fermentation[J].Applied Biochemistry and Biotechnology,2012,166(8):1896-1907.
[17] LEE J,LEE S Y,PARK S. Fed-batch culture of Escherichia coli W by exponential feeding of sucrose as a carbon source[J].Biotechnology Technique,1997(11):59-62.
[18] 李坤朋,许雅洁,赵锦芳,等.大肠杆菌利用玉米浆发酵产L-乳酸的研究[J].中国酿造,2012,31(12):64-67.

