不同类型粘土矿物对镉吸附与解吸行为的研究
李丽,刘中,宁阳,李朝丽*
(1.云南农业大学 资源与环境学院,云南 昆明 650201; 2.宁波市环境保护科学研究设计院,浙江 宁波 315012)
不同类型粘土矿物对镉吸附与解吸行为的研究
李丽1,刘中2,宁阳1,李朝丽1*
(1.云南农业大学 资源与环境学院,云南 昆明 650201; 2.宁波市环境保护科学研究设计院,浙江 宁波 315012)
[目的]揭示镉在土壤环境中的化学行为。[方法]采用批量吸附试验研究了4种不同类型的粘土矿物:蒙脱石、高岭石、针铁矿、三水铝石对镉的吸附与解吸特性,同时探讨了矿物用量及pH对镉吸附的影响。[结果]与Freundlich方程相比,Langmuir方程(R2>0.98)能较好的表征4种矿物对镉的吸附行为 ,说明矿物对镉的吸附是单层吸附。4种矿物对镉的最大吸附量大小为:蒙脱石(32.62 mg·g-1)>针铁矿(11.52 mg·g-1)>高岭石(7.99 mg·g-1)>三水铝石(6.29 mg·g-1)。4种矿物对镉的解吸率范围分别为:蒙脱石(19.99%~32.77%)、高岭石(13.48%~19.09%)、针铁矿(2.02%~3.48%)、三水铝石(1.09%~2.43%)。随pH升高蒙脱石、高岭石、针铁矿对镉的吸附量均呈增长趋势,而三水铝石基本保持不变。矿物用量在10.0 g·L-1时,针铁矿对镉的吸附率达72.8%,与蒙脱石相近(79.1%)。[结论]针铁矿吸附率较高,而解吸率低,是一种较好的吸附剂。
镉;粘土矿物;吸附;解吸;pH;矿物用量
镉是一种非必需且蓄积性强、毒性持久、对人体与动物危害极大的元素[1]。据2014年环境保护部发布的全国土壤污染状况调查数据显示,在所有污染物中镉污染点位超标率最大,达到7.0%[2]。另外,镉对水体污染较严重,黄海涛[3]等研究表明:黄埔江干流表层沉积物中Cd超背景值2倍;苏州河中,Cd为75%超标。因此,镉污染问题已引起人们的高度重视。
目前,已有许多技术用于去除环境中重金属,如化学沉淀、离子交换、溶剂提取法等。吸附是去除重金属的一种低成本高效益的可行方法。近几年来,粘土矿物由于具有比表面积大、阳离子交换量高、吸附性能强、化学稳定性强等特点,已逐渐成为新型高效吸附材料开发的热点[4,5]。吸附与解吸是影响重金属在环境中的浓度、生物有效性及其迁移转化的重要因素,该过程受矿物类型、矿物用量、pH、温度、离子强度、重金属浓度等的影响[6~10]。如何宏平[11]、Bhattacharyya[5]、朱霞萍[12]等研究了高岭石、蒙脱石对镉的吸附行为,表明不同矿物对镉的吸附能力不同。G. Mustafa等[13~15]研究了针铁矿对镉的吸附及pH对镉吸附的影响。曾祥峰[16]研究了碱性盐化条件下,pH、矿物用量、时间、镉离子初始浓度对蒙脱石和伊利石吸附镉的影响。但对于不同类型矿物对镉吸附与解吸行为比较的研究相对较少。为了明确不同类型矿物对镉去除的影响,本研究分别以2种层状硅酸盐矿物∶高岭石(1∶1型粘土矿物)、蒙脱石(2∶1型粘土矿物)及针铁矿(铁氧化物)和三水铝石(铝氢氧化物)作为粘土矿物的代表,探讨不同矿物对镉的吸附与解吸行为,并研究了矿物用量与pH对矿物吸附镉行为的影响,以期为镉污染修复与治理提供科学依据。
1 材料与方法
1.1 供试材料
试验所用高岭石产自广东茂名,蒙脱石产自四川绵阳。
蒙脱石、高岭石胶体的制备(沉降法):取50 g 60目筛的风干土壤矿物(蒙脱石、高岭石)于高型烧杯中,加适量去离子水,搅拌均匀,超声分散2 h后,加NaOH调节pH到8.5左右,再进行超声分散。然后用沉降虹吸法分离出<2m的组分(即为胶体)。然后加水搅拌再用沉降虹吸法分离,如此反复多次,直至加水搅拌沉降了规定时间后上层溶液基本澄清无胶体为止。向稀的胶体中加入几滴盐酸使其絮凝,倾去上层清液,如此反复浓缩后电析,风干,磨细过60目筛备用[17]。
氧化物类粘土矿物针铁矿和三水铝石的制备采用化学合成法。
针铁矿的制备:称取50 g的Fe(NO3)3·9H2O于5 000 mL大烧杯中,加水大约是Fe(NO3)3·9H2O的17倍体积搅动使其充分溶解,剧烈搅拌下,以5 mL·min-1的速度滴加2.5 mol·L-1NaOH直至溶液pH稍高于12(用pH电极测定)即可,然后将此溶液放入恒温箱中60 ℃老化24 h,期间搅动几次;弃去上清液后用蒸馏水洗几次,后电渗析处理,检验合格后,60 ℃红外灯下烘干,磨细过60目筛备用[18]。
三水铝石的制备:称取100 g的 AlCl3·6H2O于5 000 mL刻度大烧杯中,加适量水(此时溶液浓度为1 mol·L-1),溶解后在搅动下均匀地滴加4 mol·L-1NaOH直至pH稳定在4.6,然后放入恒温箱内40 ℃老化2 h取出,然后进行电渗析处理;检验合格后风干,磨细过60目筛备用[19]。
供试粘土矿物的基本性质见表1,矿物扫描特征见图1。
表1 材供试矿物基本理化性质积
Table 1 Physical and chemical properties of the minerals samples
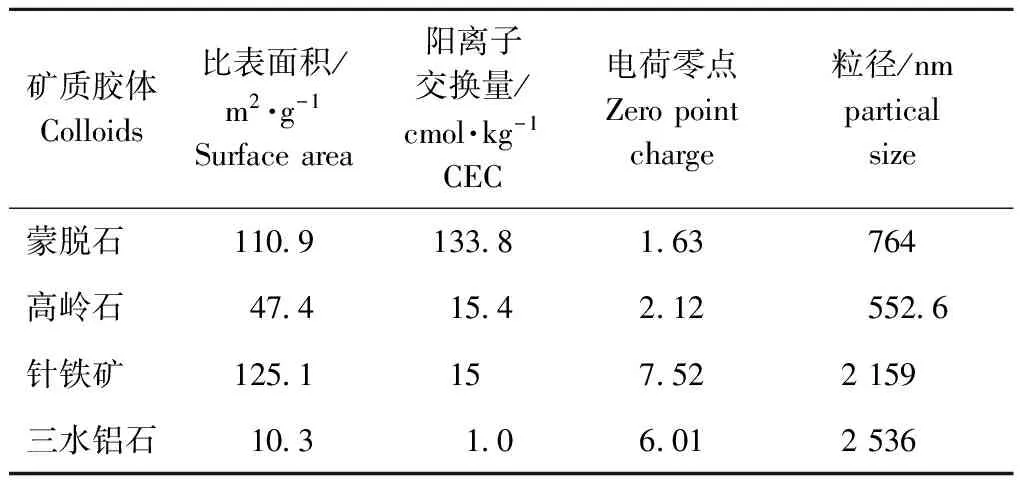
矿质胶体Colloids比表面积/m2·g-1Surfacearea阳离子交换量/cmol·kg-1CEC电荷零点Zeropointcharge粒径/nmparticalsize蒙脱石11091338163764高岭石4741542125526针铁矿1251157522159三水铝石103106012536

图1 高岭石(a)、蒙脱石(b)、针铁矿(c)、与三水铝石(d)的扫描电镜图Fig.1 SEM micrographs of kaolinite(a),montmorillonite(b), goethite(c) and gibbsite
1.2 试验药品
试验所用药品:Cd(NO3)2·2.5H2O(优级纯),NaNO3、NaCl均为分析纯。
1.3 试验方法
1.3.1 等温吸附试验
称取0.050 0 g 高岭石、蒙脱石、针铁矿和三水铝石于50 mL 聚乙烯塑料离心管中,依次加入25 mL初始浓度分别为1、5、10、20、50、100、200、500 mg·g-1的Cd(NO3)2溶液,以0.01 mol·L-1的NaNO3溶液作为支持电解质,用0.1 mol·L-1的HNO3和NaOH调节体系pH为5.5左右,在25 ℃条件下恒温震荡24 h,4 000 r·min-1下离心10 min,过0.45 μm滤膜,用ICP-OES法测定滤液中Cd(Ⅱ)浓度。
根据加入液和平衡液的浓度差按下式计算矿物对重金属离子的吸附量:
(1)
式中,qe为平衡时单位质量的矿物吸附的镉的质量/mg·g-1;C0为初始溶液的Cd(Ⅱ)质量浓度/mg·L-1,Ce为平衡时溶液的Cd(Ⅱ)质量浓度/mg·L-1,V为溶液体积/L,m为土壤矿物质量/g。
1.3.2 解吸试验
向吸附反应后的矿物残渣加入25 mL 0.1 mol·L-1的NaCl溶液,解吸振荡24 h,4 000 r·min-1离心10 min后过0.45 μm滤膜,测定滤液中Cd(Ⅱ)浓度。用称重法扣除解吸前残渣残留液中Cd进而计算解吸量。
1.3.3 pH对矿物吸附镉的影响
称取0.0500 g 的粘土矿物于50 mL聚乙烯塑料离心管中,加入初始pH 分别为2.0、3.0、4.0、5.0、6.0、7.0,Cd(Ⅱ) 浓度为100 mg·L-1的Cd(NO3)2溶液进行吸附实验,其间用稀HNO3和 NaOH 反复调节pH,使平衡溶液pH与初始pH基本一致。测定滤液中Cd(Ⅱ)浓度。
1.3.4 矿物浓度对矿物吸附镉的影响
分别称取0.020、0.040、0.100、0.200 矿物样品,加入初始浓度为100 mg·L-1Cd(Ⅱ)溶液20 mL,以0.01 mol·L-1的NaNO3溶液为背景电解质,调节体系pH为5.0。在25 ℃条件下恒温振荡24 h,4 000 r·min-1下离心10 min,过0.45 μm滤膜,测定滤液中Cd(Ⅱ)浓度。
1.4 矿物理化性质测定指标及方法
采用多次KCl吸附平衡-高浓度NH4NO3取代法测定阳离子交换量(CEC)[20];BET法测定吸附剂的比表面积[21];微电泳法测定Zeta电位;激光粒度分析仪测定吸附剂粒径;扫描电镜观察吸附剂表观特征。
1.5 数据处理
采用Microsoft Excel 2007 软件对数据进行处理,origin 8.0绘图软件对等温线进行数据拟合。所有试验处理均重复3次,文中结果均为重复的平均值,图中标出了试验结果的标准差。
2 结果与分析
2.1 4种粘土矿物对镉的等温吸附
在25 ℃、pH 5.5、离子强度为0.01 mol·L-1条件下,供试4种粘土矿物对不同浓度Cd2+的吸附等温线如图2所示。由图2可以看出:随着平衡液Cd2+浓度增加,矿物对Cd2+的吸附量逐渐增加。Cd2+浓度较低时,吸附量随Cd2+浓度增加较快,且蒙脱石对镉的吸附量增幅最大。当平衡液中Cd2+浓度大于100 mol·L-1时,Cd2+的吸附量逐渐趋于平衡。
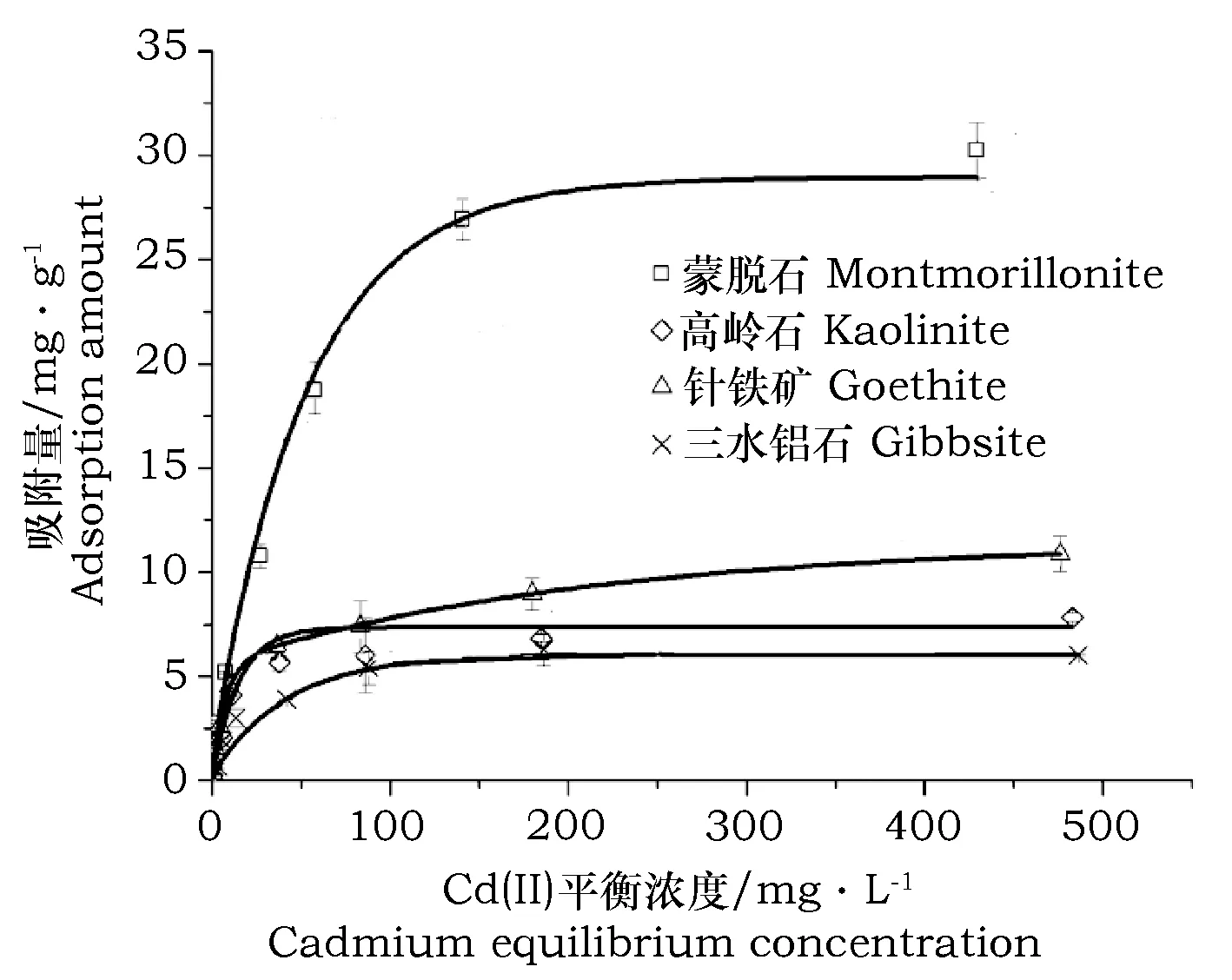
图2 4种矿物对镉的吸附等温线Fig.2 Cd(Ⅱ) adsorption equilibrium curve of four soil minerals
分别应用Langmuir和Freundlich两种等温吸附方程对吸附过程进行拟合。
Langmuir方程 :ce/qe=ce/qm+1/Kqm
(2)
Freundlich方程:qe=kf+ce/n
(3)
式中:Ce为吸附平衡时金属离子浓度/ mg·L-1;qe为吸附平衡时的吸附量 /mg·L-1;qm为最大吸附量/ mg·L-1;k为langmuir常数;kf、n为Freundlich特征常数。
由表2中R2可知,与Freundlich方程相比,Langmuir方程能较好的表征4种矿物对镉的吸附行为(R2>0.98),说明其对镉的吸附为单层吸附。4种矿物对镉的吸附量变化趋势均表现为先增加后趋于平衡,这是由于在一定条件下,矿物对镉的吸附位点一定,随着镉离子质量浓度增加,镉的吸附量逐渐增加,而吸附位点逐渐减少,矿物对镉吸附量的增幅减小。4种矿物对Cd(Ⅱ)的饱和吸附量分别为:蒙脱石(32.62 mg·g-1)>针铁矿(11.52 mg·g-1)>高岭石(7.99 mg·g-1)>三水铝石(6.29 mg·g-1)。该研究结果与方临川[22]对矿物吸附镉的研究结果一致,结果表明蒙脱石、高岭石、针铁矿对镉的最大吸附量大小为:蒙脱石>针铁矿>高岭石。
表2 4种矿物吸附Cd(Ⅱ)等温方程拟合参数
Table 2 Parameters of various models for Adsorption of four minerals

矿物SoilmineralLangmuir方程LangmuirequationFreundlich方程FreundlichequationKqmR2kf1/nR2蒙脱石002932620990138905780976高岭石00587990997074304590854针铁矿004311520987100604530889三水铝石00636290996056004670877
2.2 等温解吸曲线
4种矿物对镉的等温解吸与解吸率曲线如图3所示,可以看出:随着Cd2+浓度的增加,矿物对镉的解吸量逐渐上升,但4种矿物对镉的解吸量增幅不同,其中蒙脱石的增幅最大。蒙脱石、高岭石、针铁矿和三水铝石的解吸量分别在0.075~6.135,0.036~1.053,0.006~0.317,0.004~0.169 mg·g-1之间。其解吸量的大小表现为:蒙脱石>高岭石>针铁矿≈三水铝石。
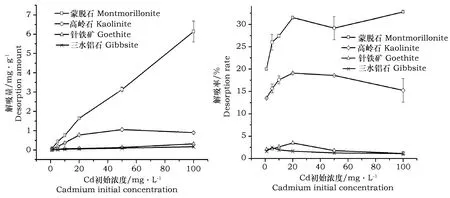
图3 4种矿物对Cd(Ⅱ)的等温解吸与解吸率曲线Fig.3 Desorption equilibrium curve and desorption rate of cadmium of four soil minerals
对矿物镉吸附量与解吸量进行相关性分析发现(表3),4种矿物对镉的解吸量均随镉吸附量的增加而增加,两者间呈线性正相关。但被矿物吸附的镉不能完全解吸,4种矿物对镉的解吸能力不同。蒙脱石的解吸率在19.99%~32.77%之间,高岭石在13.48%~19.09%之间;针铁矿在2.02%~3.48%之间;三水铝石的在1.09~2.43%之间。 Cd浓度小于20 mg·L-1时,4种矿物对镉的解吸率均随镉浓度的增加而增加。Cd浓度超过20 mg·L-1,除蒙脱石外,其他3种矿物的解吸率均有所下降。
表3 等温吸附-解吸曲线回归方程及相关性分析
Table 3 linear regression equation and correlation analysis between adsorption and desorpyion
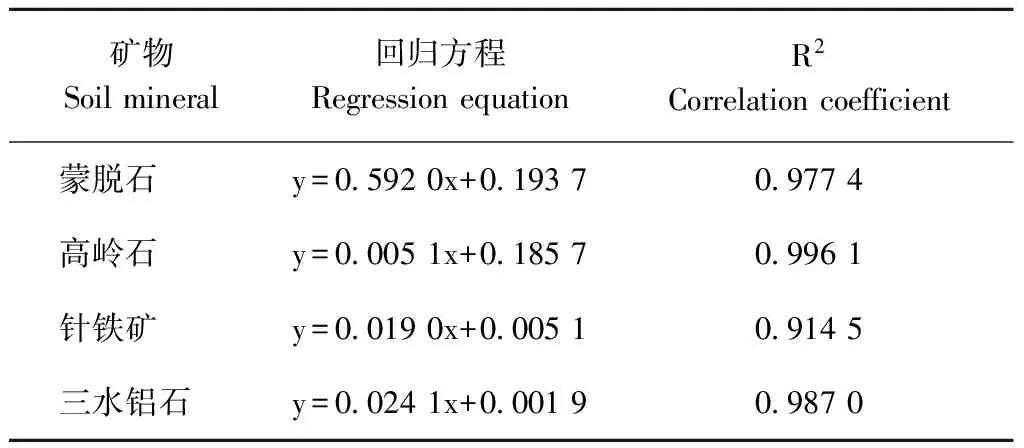
矿物Soilmineral回归方程RegressionequationR2Correlationcoefficient蒙脱石y=05920x+0193709774高岭石y=00051x+0185709961针铁矿y=00190x+0005109145三水铝石y=00241x+0001909870
2.3 pH对矿物吸附Cd的影响
图4为蒙脱石、高岭石、针铁矿和三水铝石的Cd(Ⅱ)的吸附量随pH的变化趋势。从图中可以看出,pH在2~7范围内蒙脱石、高岭石、针铁矿3种矿物对Cd(Ⅱ)的吸附量随pH的增加而不同程度地增加。pH为7.0时蒙脱石、高岭石、针铁矿对Cd的吸附量分别是pH为2.0时的50倍、2倍、4倍。而三水铝石在pH在2~7范围内Cd的吸附量基本上无变化,这可能是三水铝石的阳离子交换量(CEC)最低,仅为1.0 cmol·kg1,三水铝石带正电荷,pH的变化对其吸附镉影响较小。
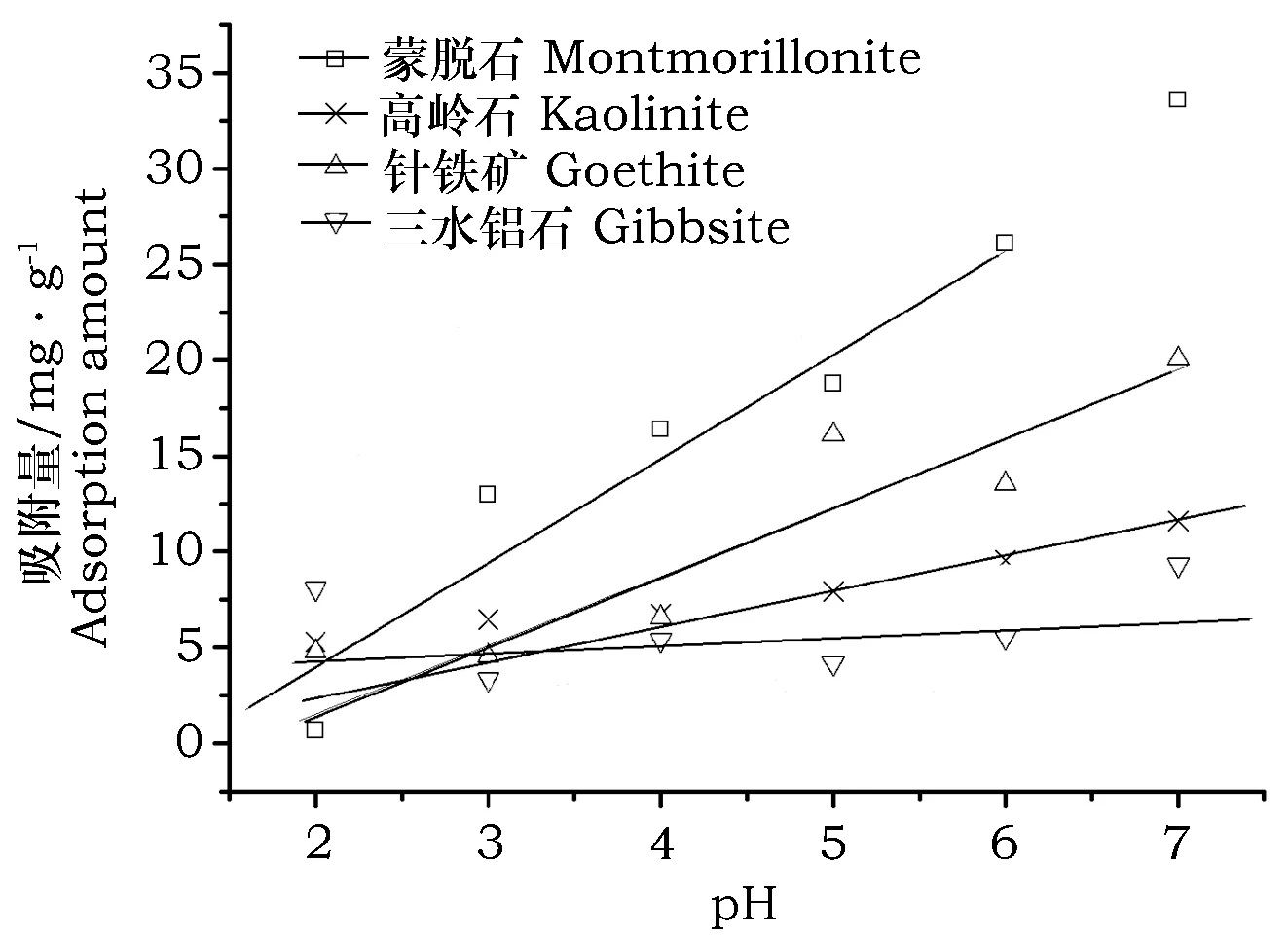
图4 pH对Cd(Ⅱ)吸附量的影响Fig.4 Influence of pH on the adsorption capacity of Cd( Ⅱ) on minerals
2.4 矿物用量对镉吸附的影响
蒙脱石、高岭石、针铁矿和三水铝石4种矿物用量对镉吸附率及吸附量的影响如图5所示。从图中可知,随矿物用量的增加,蒙脱石、高岭石、针铁矿和三水铝石对镉吸附率均不同程度增加,这是由于矿物用量增加,矿物对镉的吸附位点增加。当矿物用量为0.2 g时,蒙脱石和针铁矿对镉的吸附率较相近,分别为:79.1%,72.8%;而高岭石、三水铝石对镉的吸附率较低,分别为:26.3%,10.3%。随矿物用量的增加,单位质量的蒙脱石对镉的吸附量逐渐减少;这可能是由于镉吸附量增加量小于矿物用量的增加,所以其吸附量呈下降趋势。
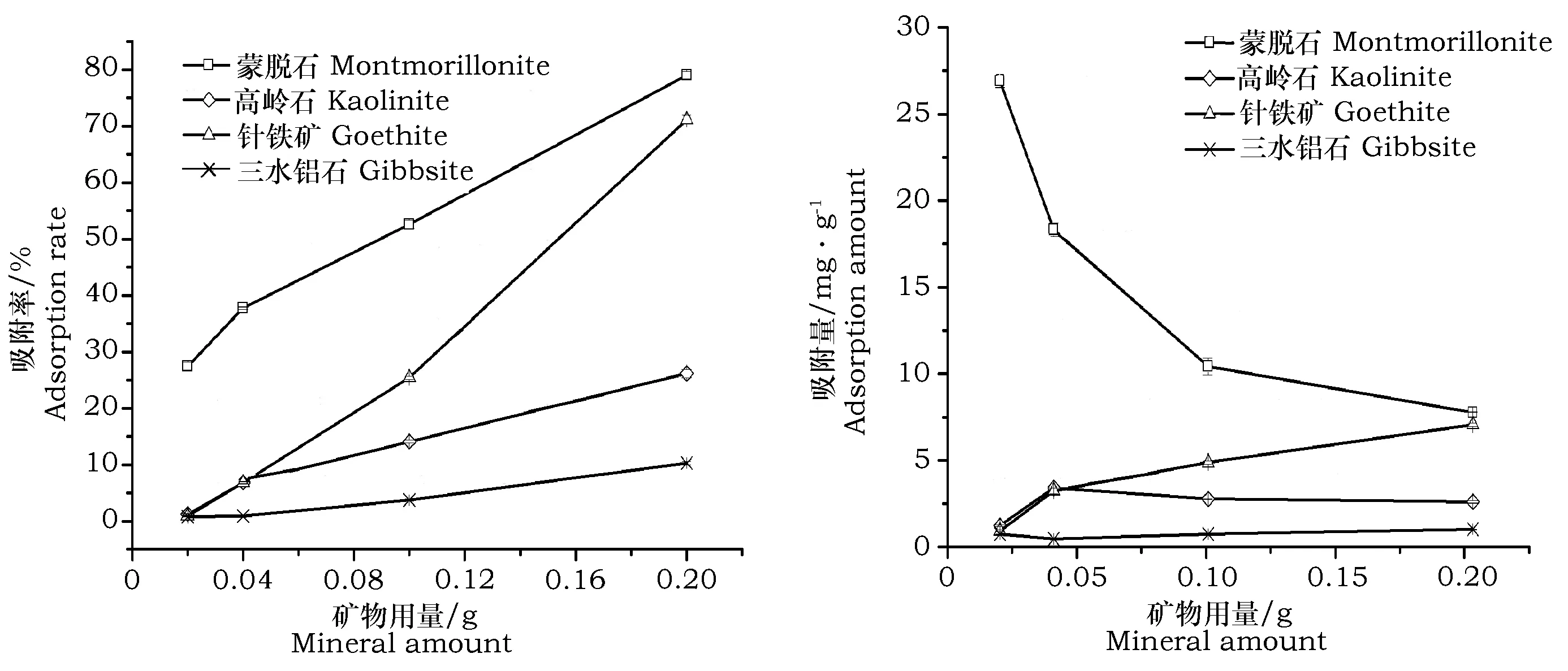
图5 矿物用量对4种矿物镉吸附量的影响Fig.5 Influence of total quantity of the added minerals on cadmium adsorptionby four minerals
3 讨论
3.1 不同粘土矿物对镉吸附行为的影响
固相物对重金属离子的吸附分为:静电吸附和专性吸附。静电吸附是由静电引力所产生的交换吸附,与矿物所带永久电荷量有关。专性吸附是由于土壤胶体表面与重金属离子之间的某种化学作用发生吸附,受可变电荷表面电量控制[23]。蒙脱石是2∶1型层状硅酸盐粘土矿物,以永久电荷表面为主,其晶体结构中广泛存在类质同象置换,与重金属离子间交换作用较强[11,13]。腾飞等[24~26]研究发现,蒙脱石的层间存在阳离子,溶液中的重金属离子与蒙脱石层间的阳离子间可发生交换反应。而高岭石属于1∶1型层状硅酸盐矿物,永久性电荷量少。其晶体结构中类质同象置换较少,层与层之间靠氢键联结,层间不存在交换性阳离子。Cd2+易与其边面羟基进行配位反应,以化学吸附的方式被吸附在高岭石表面[27,28]。针铁矿、三水铝石属于水合氧化物型表面,金属离子可与其表面大量的羟基(-OH)进行配位体交换,直接通过共价键或配位键结合在矿物表面[11]。在温度25 ℃、pH 5.5、离子强度为0.01 mol·L-1条件下,4种矿物对镉的吸附量从大到小依次为:蒙脱石、针铁矿、高岭石、三水铝石,这与其表面性质及其与镉发生的吸附类型有关。该实验条件下,蒙脱石、高岭石表面带负电荷,而针铁矿和三水铝石表面带正电荷。CEC反映粘土矿物的负电荷量,CEC越高,负电荷量越高,对镉的静电作用越强,进而对镉离子的吸附量越大。4种矿物的CEC大小为:蒙脱石(133.8 cmol·kg-1)>高岭石(15.4 cmol·kg-1)>针铁矿(15 cmol·kg-1)>三水铝石(1.0 cmol·kg-1)。何宏平[11,16]研究了蒙脱石、高岭石和伊利石对Cd等重金属的吸附,结果表明矿物对镉的吸附量与CEC呈正相关。而本研究中针铁矿对镉的吸附量大于高岭石,这可能与矿物比表面积有关。一般来说,表面积越大,矿物表面吸附位点越多,从而使其吸附能力越强[29]。
3.2 不同粘土矿物对镉解吸行为的影响
本试验中蒙脱石、高岭石、针铁矿和三水铝石对镉解吸量及吸附率大小为:蒙脱石最大,高岭石次之,针铁矿和三水铝水最小,这与镉在矿物表面的吸附特性有关。Cd可通过静电作用与带负电荷的蒙脱石、高岭石发生静电吸附而形成外层络合物,为可逆反应,易解吸。高岭石外表面分布有大量羟基, 表面络合模型也被用来描述高岭石对Cd的专性吸附行为,该吸附特性与金属氧化物类似,吸附的镉离子难解吸。吴宏海[30]等的研究表明,Pb2+能与高岭石表面羟基进行配位反应。针铁矿和三水铝石表面净电荷为正,Cd只能通过专性吸附被矿物吸附,该吸附一般为不可逆吸附,难解吸。针铁矿与三水铝石之间解吸能力的微小差异,可能与针铁矿晶体形成的凹槽及铁氧键、铝氧键键能不同等有关,具体原因有待进一步研究。
3.3 pH对Cd(Ⅱ)吸附的影响
pH对Cd(Ⅱ)吸附影响的研究结果表明,4种矿物对镉的吸附量随pH的升高而增加,这可能与矿物表面等电点等有关。蒙脱石、高岭石、针铁矿和三水铝石4种矿物的等电点分别为:1.63,2.12,7.52,6.01(见表1)。pH改变会导致矿物表面电荷发生变化。当pH
Fe(Al)OOH+Cd2+→Fe(Al)OOCd++H+
pH增大有利于铁铝氧化物吸附点位Fe—OH与Al—OH与Cd2+的络合,从而增加了对Cd2+的吸附[35,36]。此外,Cd2+的吸附量增加也可能是由于Cd2+的水解反应。Cd2+水解产生CdOH+,pH增大导致CdOH+浓度迅速增加,CdOH+是单价态,接近矿物颗粒表面需克服的势垒比Cd2+小,CdOH+在土壤粘土矿物吸附点位上亲和力明显高于Cd2+,对Cd2+的吸附力加强。所以,随pH升高,羟基离子释放,有利于镉的吸附[37,38]。
4 结论
(1)在25 ℃、pH 5.5、离子强度0.01 mol·L-1,矿物用量为2 g·L-1时,4种粘土矿物对镉的吸附是单层吸附,其饱和吸附量为:蒙脱石(32.62 mg·g-1)>针铁矿(11.52 mg·g-1)>高岭石(7.99 mg·g-1)>三水铝石(6.29 mg·g-1)。
(2)与其他矿物相比,针铁矿对镉的吸附率高、解吸率低,因此,针铁矿是一种较好的吸附剂。
(3)在pH为2.0~7.0,随pH的增加,蒙脱石、高岭石、针铁矿4种矿物对镉的吸附量均增加,pH=7.0时,蒙脱石、高岭石、针铁矿对Cd的吸附分别是pH 2.0时的50倍、2倍、4倍,而三水铝石在整个pH范围内Cd吸附量变化不显著。
(4)4种矿物对镉的吸附率随矿物用量增大而呈现不同上升趋势,当矿物用量增加到0.2 g时,针铁矿对镉的吸附率达72.8%,与蒙脱石相近(79.1%)。
[1]杜丽娜,余若祯,王海燕,等.重金属镉污染及其毒性研究进展[J].环境与健康杂志,2013,30(2):167-174.
[2]环境保护部,环境保护部和国土资源部发布全国土壤污染状况调查公报[EB/OL].2014-04-17[2016-05-28].http://www.zhb.gov.cn.
[3]黄海涛,梁延鹏,魏彩春,等.水体重金属污染现状及其治理技术[J].广西轻工业,2009(5):99-100.
[4]干方群,周健民,王火焰,等.不同粘土矿物对磷污染水体的吸附净化性能比较[J].生态环境,2008,17(3):914-917.
[5]Bhattacharyya K G, Gupta S S. Adsorption of a few heavy metals on natural and modified kaolinite and montmorillonite: a review[J]. Advances in colloid and interface science,2008,140(2):114-131.
[6]Chen Y G, Ye W M, Yang X M, et al. Effect of contact time, pH, and ionic strength on Cd (II) adsorption from aqueous solution onto bentonite from Gaomiaozi, China[J]. Environmental earth sciences,2011,64(2):329-336.
[7]Chaves L H G, Tit G A. Cadmium and copper adsorption on bentonite: effects of pH and particle size[J]. Revista Ciência Agronmica,2011,42(2):278-284.
[8]Appel C, Ma L. Concentration, pH, and surface charge effects on cadmium and lead sorption in three tropical soils[J]. Journal of Environmental Quality,2002,31(2):581-589.
[9]李程峰,刘云国,曾光明,等.pH值影响Cd在红壤中吸附行为的实验研究[J].农业环境科学学报,2005,24(1):84-88.
[10]Naidu R, Bolan N S, Kookana R S, etal. Ionic-strength and pH effects on the sorption of cadmium and the surface charge of soils[J]. European Journal of Soil Science,1994,45(4):419-429.
[11]何宏平,郭九皋,朱建喜,等.蒙脱石、高岭石、伊利石对重金属离子吸附容量的实验研究[J].岩石矿物学杂志,2001,20(4):573-578.
[12]朱霞萍,德奎,李锡坤,等.镉在蒙脱石等粘土矿物上的吸附行为研究[J].岩石矿物学杂志,2015,35(6):143-148.
[13]Mustafa G,Singh B, Kookana R S. Cadmium adsorption and desorption behaviour on goethite at low equilibrium concentrations: effects of pH and index cations[J]. Chemosphere,2004,57:1325-1333
[14]Zhu J, Huang Q, Pigna M, et al. Competitive sorption of Cu and Cr on goethite and goethite-bacteria complex[J]. Chemical Engineering Journal,2012,179:26-32.
[15]Hooda P S, Alloway B J. Cadmium and lead sorption behaviour of selected English and Indian soils[J]. Geoderma,1998,84(1):121-134.
[16]曾祥峰,张凯,于晓曼,等.碱性盐化条件下蒙脱石和伊利石对镉的吸附特征研究[J].农业环境科学学报,2008,27(6):2251-2257.
[17]熊毅,陈家坊.土壤胶体(第二册)[M].北京:科学出版社,1985:335-385.
[18]Alkinson R J, Posner A M, Quirk J P. Adsorption of potential-determining ions at the ferric oxide aqueous electrolyte interface[J]. Journal of physical chemistry,1967,71:550-558.
[19]Kingston F J, Posner A M, QUIRK J P. Anion adsorption by goethite and gibbsite[J]. Journal of Soil Science,1972,23(2):177-192.
[20]李学垣.土壤化学及实验指导[M].北京:中国农业出版社,1997:195-201.
[21]吴萍萍.不同类型矿物和土壤对砷的吸附-解吸研究[D].北京:中国农业科学院,2011.
[22]方临川.重金属与细菌—土壤活性颗粒微界面互作的分子机制[D].武汉:华中农业大学,2011.
[23]邹献中,徐建民,赵安珍,等.可变电荷土壤中铜离子的解吸[J].土壤学报,2004,41(1):68-73.
[24]滕飞,李福春,吴志强,等.高岭石和蒙脱石吸附胡敏酸的对比研究[J].中国地质,2009,26(4):892-898.
[25]谭光群,李晖,彭同江.蛭石对重金属离子吸附作用的研究[J].四川大学学报(工程科学版),2001,33(3):58-61.
[26]Oubagaranadin J U K, Murthy Z V P. Isotherm modeling and batch adsorber design for the adsorption of Cu (II) on a clay containing montmorillonite[J].Applied Clay Science,2010,50(3):409-413.
[27]董伟,黄江波.水溶液体系中高岭石吸附Cu2+的研究[J].水资源保护,2006,22(2):68-83.
[28]何宏平,郭龙皋,谢先德,等.蒙脱石等粘土矿物对重金属离子吸附选择性的实验研究[J].矿物学报,1999,19(2):231-235.
[29]XIONG Y. Research method of soil colloid[M].Beijing:Science Press,1985:276-295.
[30]吴宏海,刘佩红,张秋云,等.高岭石对重金属离子的吸附机理及其溶液的pH条件[J].高校地质学报,2005,11(1):85-91.
[31]Ijagbemi C O, Baek M H, Kim D S. Montmorillonite surface properties and sorption characteristics for heavy metal removal from aqueous solutions[J].Journal of Hazardous Materials,2009,166(1):538-546.
[32]黄丽,刘畅,胡红青,等.不同pH下有机酸对针铁矿和膨润土吸附Cd2+、Pb2+的影响[J].土壤学报,2007,44(4):643-649.
[33]刘娟娟,梁东丽,吴小龙,等.Cr(Ⅵ)对两种黏土矿物在单一及复合溶液中Cu(Ⅱ)吸附的影响[J].环境科学,2014,35(1):254-262.
[34]张会民,徐明岗,吕家珑,等.pH对土壤及其组分吸附和解吸镉的影响研究进展[J].农业环境科学学报,2008,27(z1):320-324.
[35]Granados-Correa F,Corral-Capulin N G,Olguín M T,et al.Comparison of the Cd (II) adsorption processes between boehmite (γ-AlOOH) and goethite (α-FeOOH)[J].Chemical Engineering Journal,2011,171(3):1027-1034.
[36]Wang Y, Tang X, Chen Y, et al. Adsorption behavior and mechanism of Cd (II) on loess soil from China[J]. Journal of Hazardous Materials,2009,172(1):30-37.
[37]宗良纲,徐晓炎.土壤中镉的吸附解吸研究进展[J].生态环境,2003,12(3):331-335.
[38]Chaves L H G, Tit G A. Cadmium and copper adsorption on bentonite: effects of pH and particle size[J]. Revista Ciência Agronmica,2011,42(2):278-284.
(编辑:武英耀)
Study on cadmium adsorption-desorption behavior of diffrent clay minerals
Li Li1,Liu Zhong2,Ning Yang1,Li Zhaoli1*
(1.CollegeofResourcesandEnvironmentalSciences,YunnanAgriculturalUniversity,Kunming650201,China; 2.Ningboenvironmentalprotectionscientificresearchanddesigninstitute,Ningbo315012,China)
[Objective]To study on cadmium chemical behavior in soils.[Methods]A batch adsorption experiment was used to investigate the adsorption-desorption of Cd(Ⅱ) on four clay minerals,such as kaolinite, montmorillonite,goethite and gibbsite.[Results]And the quantity of the added clay mineral and the impact of solution with various pH values on the adsorption of Cd(Ⅱ) on the four target mineral clays was investigated. The results showed that Langmuir equation was more accurately than the Freundlich equation in describing adsorption behavior of cadmium the sequence of the adsorption amounts of four clay minerals:montmorillonite(32.62 mg·g-1)>goethite(11.52 mg·g-1)>kaolinite(7.99 mg·g-1)>gibbsite(6.29 mg·g-1). The range of cadmium desorption rate of montmorillonite, kaolinite, Goethite and gibbsite were 19.99%~32.77%,13.48%~19.09%, 2.02%~3.48%, 1.09%~2.43%, the adsorption amounts of Cd( Ⅱ) on the four clay minerals was increased with the rising of pH values.But gibbsite basically remain unchanged .When the amounts of the added clay mineral was 10.0 g·L-1, the cadmium adsorption rate of goethite is 72.8%,and it is close to montmorillonite.[Conclusion]Compaired with montmorillonite、kaolinite and gibbsite, goethite had relatively high, adsorption amounts, and low desorption rate, so it was a better adsorbent.
Lay mineral, Cadmium, Adsorption, Desorption, pH, Add mineral amounts
2016-05-31
2016-09-03
李丽(1988- ),女(汉),山西长治人,硕士研究生,研究方向:土壤污染化学
*通信作者:李朝丽,博士, 硕士生导师。 Tel:15096689656;E-mail: lizhaoli527@163.com
土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所)开放基金课题(0812201229 )
P619.25+9
A
1671-8151(2017)01-0060-07

