薄荷幼苗地上和地下部分对干旱胁迫的生理响应
武曦,任瑞芬,任才,杨秀云
(山西农业大学 林学院,山西 太谷 030801)
薄荷幼苗地上和地下部分对干旱胁迫的生理响应
武曦,任瑞芬,任才,杨秀云*
(山西农业大学 林学院,山西 太谷 030801)
[目的]本研究对1年生盆栽薄荷幼苗进行干旱胁迫处理,旨在探究各个梯度水分条件下薄荷幼苗的生理变化特性。[方法]本试验过程中采用称重控水法,设4个水分梯度对薄荷幼苗进行干旱胁迫,其中土壤含水量分别为田间最大持水量的 75%~85%(CK)、60%~65%(轻度干旱)、40%~50%(中度干旱)、25%~35%(重度干旱)。[结果](1)随着干旱时间的不断增加,不同水分梯度处理下薄荷幼苗的叶绿素a和类胡萝卜素含量呈先升后降的变化趋势,而叶绿素b及叶绿素总量均呈不规则波动。(2)薄荷幼苗根系和叶片的脯氨酸含量均呈“N”字型趋势,且叶片中游离脯氨酸的相对增加量小于根系,而不同部位可溶性蛋白的含量都表现出先升后降的变化形式,同时叶片中的可溶性蛋白含量整体略高于根系,分析其原因可能是因为蛋白的主要合成部位是叶片,而氨基酸的主要合成部位是根系。(3)在保护酶方面,薄荷幼苗中叶片的SOD活性随着处理程度的加强始终呈现出上升的变化趋势,根系呈现出先降后升的变化趋势,而薄荷幼苗POD的活性均呈现出先升后降的变化,这种通过不同酶之间相互协调以保证内环境的稳定,也是植物自身抵抗逆境的一种表现。(4)干旱胁迫使薄荷幼苗叶片中MDA的积累量增加,而根系呈先升后降趋势,这表明干旱胁迫处理下根系对膜脂过氧化反应较叶片更为敏感。[结论]研究表明,在各个干旱胁迫处理下,薄荷幼苗在生长过程中会遭受到相应的负面影响,却可以经过各种保护酶以及渗透调节物质之间的相互协调有效抵御干旱逆境,具有一定的抗旱特性。
干旱胁迫;薄荷;地上和地下部分;生理指标
植物在生长发育的过程中均受众多环境因子的共同作用[1]。其中,干旱作为影响植物生存、生长和分布的主要环境因子之一[2,3],对植物的存活及繁衍具有决定性作用。随着全球气候变化,气温升高、降水量下降等问题的频繁出现,干旱胁迫对植物生长的影响越发的明显[4]。而目前关于干旱胁迫对植物生长影响方面的研究主要局限于单个器官或组织以及单个耐旱环节[5],本试验将根系与叶片相结合,研究不同干旱时期植物的生理响应规律,对于深入了解植物的抗旱机制有一定的理论指导意义。
薄荷(MenthahaplocalyxBriq.)为唇形科薄荷属多年生香草植物[6,7]。因其对生态环境的适应能力较强,多数生长在北半球的温带地区,在我国南北各省也均有分布[8],所以我国被称为薄荷精油生产大国[9]。而薄荷精油因其性味凉、香气强烈而新鲜,被广泛应用于食品、医药卫生、香料等领域[10,11],极具有开发推广价值。近年来,关于薄荷的研究主要集中在生产应用、精油成分及功能性研究方面[12~14],关于栽培育种方面的研究鲜有报道。因此,本研究在不同干旱胁迫强度下对薄荷幼苗地下和地上部分的生理指标进行测定,进而了解干旱对其伤害的内在规律和本质,为芳香地被植物的选育、栽培和推广提供基础性的理论依据。
1 材料与方法
1.1 试验材料
本试验于2015年10-11月在山西农业大学林学院苗圃的温室中展开,以1年生薄荷幼苗为研究对象。选取生长均匀一致的健壮植株,将其幼苗移栽于直径为15×15 cm的花盆里,栽培基质为(园土∶细沙=2∶1)沙壤土,土壤取回后过筛,去除杂质后与细沙混合拌匀,确保每盆重量相同、栽培条件一致。在薄荷幼苗均达到15 cm时,开始对其进行干旱处理,在此期间每7 d取一次样,并将薄荷幼苗用水冲洗干净后带回实验室,取叶片和根部,并测定其生理指标。
1.2 试验方法
1.2.1 试验方法
试验过程中采用称重控水法,设4个水分梯度对薄荷幼苗进行干旱胁迫,其中土壤含水量分别为田间最大持水量的 75%~85%(CK)、60%~65%(轻度干旱)、40%~50%(中度干旱)、25%~35%(重度干旱)。样本容量为30盆,设3次重复,采用完全随机排列的方式。试验期间,每天用电子秤(载量30 Kg,感量5 g)称重来补足蒸腾和植物生长消耗的水分,使各个处理的土壤含水量控制在设定范围内,分别于试验第0 d、7 d、14 d、21 d取样并测定各项生理指标。
1.2.2 生理指标的测定
分别取成熟的叶组织(植株顶端向下3~4节上的功能叶片)和根组织(根颈2 cm以下的部分)测定各项生理指标。其中,叶绿素采用丙酮浸提法,游离脯氨酸采用茚三酮显色法测定,可溶性蛋白采用考马斯亮蓝G-250染色法测定,超氧化物歧化酶(SOD)活性采用核黄素-NBT还原法测定,过氧化物酶(POD)活性采用愈创木酚还原法测定,丙二醛(MDA)采用硫代巴比妥酸比色法测定[15]。
1.2.3 数据分析
数据采用SPSS 19.0软件进行方差分析和显著性检验,Excel 2016进行统计和制图。
2 结果与分析
2.1 干旱胁迫对薄荷幼苗叶片光合色素的影响
2.1.1 干旱胁迫对薄荷幼苗叶绿素a含量的影响
随着干旱胁迫程度的增强,叶绿素a含量呈先升后降的变化趋势(表1)。胁迫7 d时,中度和重度胁迫达到峰值,比同期对照增加26%、22%。在胁迫14 d和21d时,各个处理间差异显著(P<0.05),轻度和中度胁迫分别比同期对照增加15.31%、25.51%,20.88%、48.35%,表明一定程度的干旱胁迫可以促进叶绿素a的合成。

表1 干旱胁迫对薄荷叶绿素a含量的影响/mg·g-1
注:同一列中不同字母表示差异的显著水平,小写字母P<0.05。表2~表4同。
Note: Different letters in the same column indicate the significant difference among different treatments at 0.05 level. The same as in table 2~table 4.
2.1.2 干旱胁迫对薄荷幼苗叶绿素b含量的影响
如表2所示,对照组中叶绿素b含量呈先降后升的趋势,轻度、中度和重度干旱分别比对照降低31.34%、20.90%、5.97%。胁迫7 d、14 d和21 d时,叶绿素b的含量均呈先升后降的趋势,7d时中度和重度胁迫均达到峰值,分别比对照增加28.36%、39.01%、12.04%,14 d时轻度、中度和重度胁迫下叶绿素b含量较对照分别增加30.16%、61.90%、20.63%,21 d时分别比对照增加49.18%、88.52%、21.31%,各个处理间的差异显著(P<0.05)。在不同程度干旱胁迫下,薄荷幼苗叶绿素b含量的相对增加量叶绿素a相比较高,表明干旱胁迫对叶绿素a合成的影响程度大于叶绿素b。

表2 干旱胁迫对薄荷叶绿素b含量的影响/mg·g-1
2.1.3 干旱胁迫对薄荷幼苗叶绿素总含量的影响
干旱胁迫下叶绿素总含量的变化趋势与叶绿素b相似(见表3)。叶绿素总含量在7 d、14 d和21 d时呈先升后降趋势,干旱处理7 d时,叶绿素总含量在轻度、中度、重度干旱胁迫下分别比同期对照增加24.55%、31.14%、25.15%,14 d时分别比同期对照增加18.54%、42.38%、7.9%,21 d时分别比同期对照增加38.24%、65.44%、13.97%,各个处理间差异显著。而在对照组中,叶绿素总含量随胁迫程度增强呈先降后升趋势,轻度、中度、重度干旱胁迫下分别比同期对照低11.34%、15.46%、6.19%,由此可初步推断,干旱对薄荷幼苗中叶绿素总含量的合成具有促进作用,对干旱的适应性强。
2.1.4 干旱胁迫对薄荷幼苗类胡萝卜素含量的影响
如表4所示,胁迫初期,类胡萝卜素含量随干旱程度的加强呈上升趋势,在对照组中,轻度、中度、重度干旱胁迫下的类胡萝卜素含量分别比同期对照高10.22%、12.93%、24.57%;胁迫第7 d时,各干旱处理下类胡萝卜素含量分别同期对照增加16.46%、24.36%、31.92%,说明类胡萝卜素合成速度在胁迫初期并未受到显著影响;14 d和21 d时,薄荷叶片类胡萝卜素含量随胁迫程度的增强呈先升后降趋势,轻度、中度和重度干旱处理的含量分别比同期对照增加17.95%、39.74%、6.41%,21 d时比同期对照增加34.33%、82.09%、17.91%,各处理间的差异变得显著(P<0.05)。

表3 干旱胁迫对薄荷叶绿素总含量的影响/mg·g-1
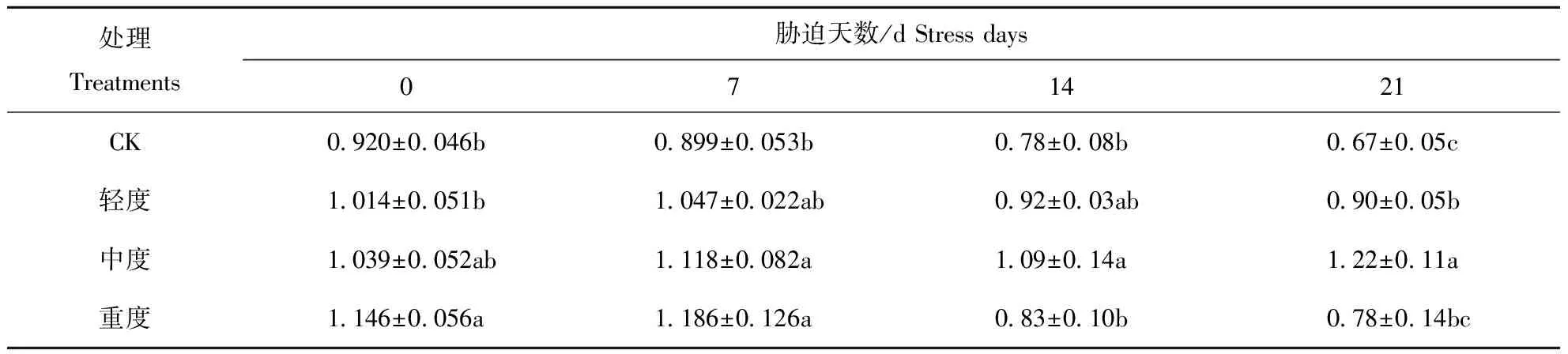
表4 干旱胁迫对薄荷类胡萝卜素含量的影响/mg·g-1
2.2 干旱胁迫对薄荷幼苗渗透调节物质的影响
2.2.1 干旱胁迫对薄荷幼苗游离脯氨酸含量的影响
不同程度干旱胁迫下薄荷幼苗叶组织的脯氨酸含量呈“N”字型的变化趋势(见图1-A)。胁迫0 d时,薄荷叶组织中游离脯氨酸含量较低,且各处理下的含量均高于对照处理。处理第7 d时,各个干旱处理均达到峰值,轻度、中度以及重度处理下的含量分别为57.53、69.56、67.47 mmol·g-1。胁迫14 d时,各个干旱处理下的脯氨酸含量均大幅度下降,且各个处理间的差异显著;胁迫21 d时,叶组织中游离脯氨酸含量开始呈现增加趋势,轻度、中度和重度干旱处理分别较同期对照增加了14.21%、6.84%、53.53%。
薄荷幼苗根组织中的游离脯氨酸含量变化趋势与叶组织大致相同(见图1-B)。在胁迫0 d~7 d时,薄荷根中的脯氨酸含量随时间延长呈现上升趋势,且各处理间的差异显著增大。胁迫14 d时,脯氨酸含量随胁迫程度的增强显著上升,轻度、中度和重度干旱胁迫下脯氨酸含量分别为同期对照的1.81倍、2.24倍、3.18倍。在胁迫21 d时,薄荷的脯氨酸含量在轻度、中度和重度胁迫下达到峰值,分别为同期对照的2.12倍、2.22倍、2.25倍。

图1 干旱胁迫对薄荷幼苗植株内脯氨酸含量的影响Fig.1 Effect of different drought stress on proline content of Mentha haplocalyx Briq. seedling
2.2.2 干旱胁迫对薄荷幼苗可溶性蛋白含量的影响
随着干旱胁迫时间的延长,薄荷幼苗叶部可溶性蛋白的含量呈先降后升的变化趋势(见图2-A),薄荷在0 d胁迫处理下,叶片中可溶性蛋白含量随着处理程度的增强而升高,不同处理间的差异较显著,轻度、中度和重度胁迫分别较对照增加了6.39%、11.19%、18.88%。在胁迫7 d时,可溶性蛋白含量分别比对照降低了20.66%、1.9%、13.83%,且各处理间的差异显著。胁迫14 d时,呈现先降后升的变化趋势,各个处理下可溶性蛋白含量分别较对照降低了26.85%、16.67%、1.12%。胁迫第21d时,叶片可溶性蛋白含量呈先升后降再升的变化趋势,分别比对照增加了16.8%、0.65%、29.57%,且各处理间的差异显著。
薄荷幼苗根部可溶性蛋白含量的变化随胁迫程度的增强整体呈先降后升趋势(见图2-B)。在胁迫0 d~7 d时,在中度干旱胁迫下的可溶性蛋白含量达到峰值,分别为同期对照的37.66%、14.42%。在胁迫14 d和21 d时,可溶性蛋白含量变化趋势与0 d~7 d时相似,但在轻度干旱胁迫下达到峰值,分别为同期对照的4.18%、11.99%。

图2 干旱胁迫对薄荷幼苗植株内可溶性蛋白含量的影响Fig.2 Effect of different drought stress on soluble protein content of Mentha haplocalyx Briq. seedling
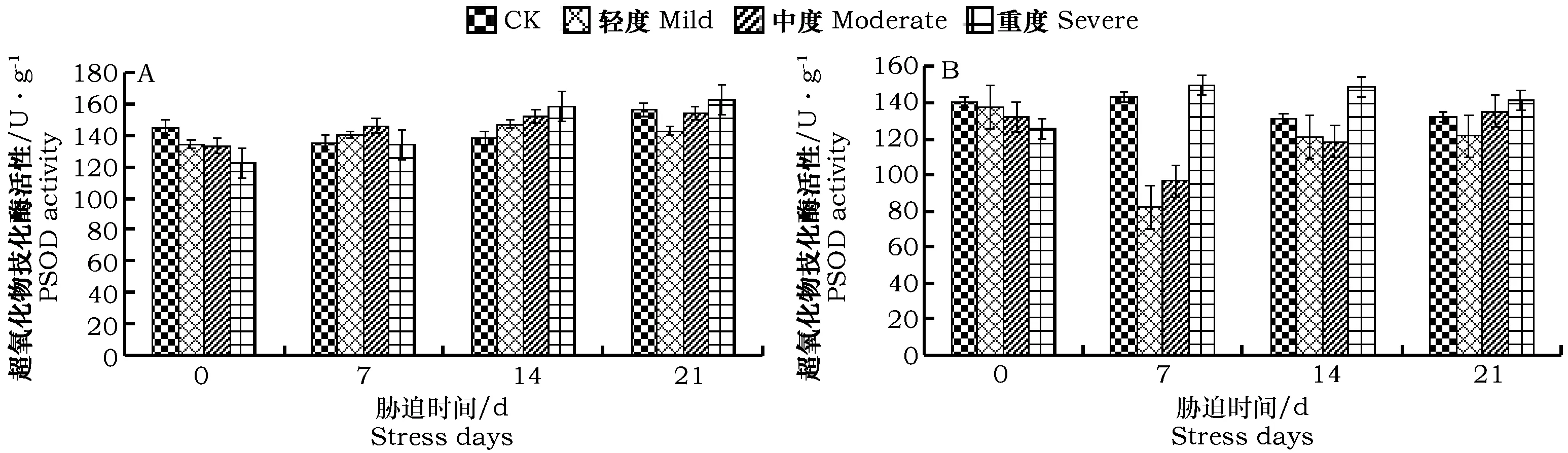
图3 干旱胁迫对薄荷幼苗植株内超氧化物岐化酶活性的影响Fig.3 Effect of different drought stress on SOD activities of Mentha haplocalyx Briq. seedling
2.3 干旱胁迫对薄荷幼苗抗氧化酶活性的影响
2.3.1 干旱胁迫对薄荷幼苗SOD活性的影响
薄荷叶片中SOD的活性随着干旱胁迫程度的增强呈上升趋势(如图3-A)。在胁迫初期(0 d和7 d),薄荷叶片的SOD活性在各个处理下均有下降趋势,但变化幅度较小,各处理间的差异均不显著。在胁迫14 d时,SOD活性随胁迫程度的增强而增加,且各处理下的SOD活性均高于对照处理,其中,重度胁迫下较同期对照增加14.28%。第21 d时,CK、中度和重度胁迫下的SOD活性达到峰值,表明一定程度的干旱胁迫可激活薄荷叶片中SOD的活性,使其清除活性氧和自由基的能力得到提高。
随着干旱胁迫时间的延长,各处理下薄荷根部SOD活性呈先降后升的变化趋势(见图3-B)。在胁迫0 d时,各梯度处理间的差异显著,且均低于对照处理。胁迫7 d~21 d时,SOD活性随胁迫程度的加强均呈先下降后上升的趋势,且重度胁迫显著促进了SOD的合成,分别较同期对照增加4.6%、13.37%、7.28%。表明随着胁迫时间的延长,薄荷根系中产生大量氧化自由基,导致消耗过多的SOD,从而降低了其活性。
2.3.2 干旱胁迫对薄荷幼苗POD活性的影响
随着胁迫时间的延长,薄荷叶片的POD活性呈先升后降的变化趋势(见图4-A)。在胁迫0 d~14 d时,POD活性随着胁迫程度的加剧整体呈下降趋势,且各处理间的差异较显著,重度胁迫分别较同期对照下降34.04%、28.46%、42.20%。其中,在胁迫第7 d时,各个干旱胁迫处理下的POD活性达到峰值。肋迫21 d时,中度胁迫比同期对照增加11.75%。
薄荷根部的POD活性变化趋势类同于叶组织的变化趋势(见图4-B)。各个干旱处理均在7 d时达到峰值,且各处理间的差异显著,重度胁迫下POD活性比同期对照升高14.80%。在胁迫14 d时,中度干旱处理比同期对照增加24.45%,胁迫21 d时,薄荷根中POD活性变化不大,各处理间的差异不显著,轻度干旱处理比同期对照增加36.18%。

图4 干旱胁迫对薄荷幼苗植株内过氧化物酶活性的影响Fig.4 Effect of different drought stress on POD activities of Mentha haplocalyx Briq. seedling
2.4 干旱胁迫对薄荷幼苗丙二醛含量的影响
不同干旱处理梯度下MDA 的含量均随着胁迫时间的延长呈上升趋势,且各个处理下MDA含量的积累速度有很大差异(图5-A)。在0 d~14 d时MDA积累的速度较缓慢,随干旱时间的延长,积累的速度变快,各处理间的差异变得显著,且均高于同期对照处理。在胁迫第21 d时,各个处理的MDA含量显著高于CK,尤其是中度处理下较同期对照增加了52.94%,达到了峰值。结果表明,随着干旱胁迫程度的增强,MDA的积累使膜脂过氧化程度加剧,严重时可导致细胞死亡。
干旱胁迫下薄荷根中MDA含量变化呈先升后降的趋势,0 d~7 d时积累速度相对较缓慢;在7~14 d时,MDA积累速度加快,各个处理下的MDA含量在14 d时达到峰值,分别较同期对照的增加18.75%、25%、18.75%。在胁迫第21 d时,各个处理下MDA含量呈下降的变化趋势,而中度干旱处理的降幅较缓,较同期对照增加58.33%。叶片中MDA含量与根系部分相比相对较低,这表明同一程度干旱胁迫下薄荷幼苗叶片膜脂过氧化程度略低于根系部分。
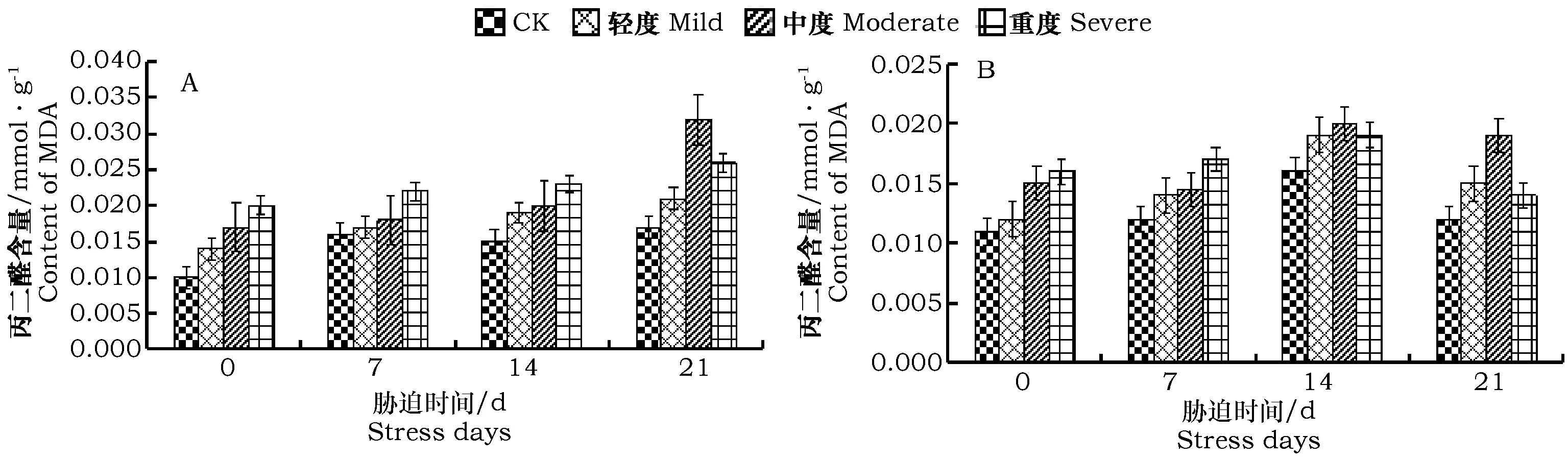
图5 干旱胁迫对薄荷幼苗植株内丙二醛含量的影响Fig.5 Effect of different drought stress on MDA content of Mentha haplocalyx Briq. seedling
3 讨论
3.1 干旱胁迫对薄荷幼苗光合色素含量的影响
在植物光合作用过程中,光合色素具有吸收、传递和转化光能的重要功能[16]。其中,叶绿素将光能进行合理调配和耗散,确保光合系统能够稳定运行,以此缓解外界干旱胁迫对其造成的伤害[17,18]。结果表明,随着干旱程度的不断加剧以及干旱时间的增加,薄荷幼苗中叶绿素a以及类胡萝卜素的含量均表现出先升后降的变化趋势,在重度干旱处理下虽有所下降,但其含量仍高于CK。孙景宽等[18]认为在干旱胁迫处理条件下,类胡萝卜素对幼苗仍具有一定的保护能力。研究发现,叶绿素b以及叶绿素总量在胁迫0 d时呈先降后升的变化趋势,在胁迫7 d、14 d以及21 d时成先升后降的变化趋势,说明干旱胁迫可能使合成叶绿素所需要的酶受到抑制,不仅导致其合成速度减缓,同时还加速了叶绿素的分解[19],以适应干旱处理下幼苗正常的光合速率。
3.2 干旱胁迫对薄荷幼苗渗透调节物质含量的影响
不断积累渗透调节物质,是植物御旱的关键生理机制,在干旱胁迫处理条件下植物通过不断增加细胞的溶质含量,促使细胞的渗透势持续下降,从而维持一定的膨压以保证植株正常的生理过程[17,20,21]。可溶性蛋白以及游离脯氨酸作为植物体内最为关键的两种渗透调节物质,其自身含量的增加和积累对逆境条件下植物细胞水势和吸水能力都有一定程度的影响[22,23]。在干旱胁迫处理14 d时,薄荷幼苗根、叶组织中可溶性蛋白的含量出现最低值,表明细胞质膜受到严重损伤,植物细胞保水和主动吸水能力显著下降。随着干旱时间的增加,在21 d时,薄荷幼苗中可溶性蛋白和游离脯氨酸的积累量增加,这可能由于薄荷在干旱胁迫初期体内正常蛋白质合成受到抑制,而后大量抗逆性蛋白的产生使得体内渗透调节物质的含量增加[24]。说明薄荷幼苗在在各个程度的干旱胁迫处理下,可溶性蛋白以及脯氨酸的渗透调节能力较强,具有一定的抗旱特性。
3.3 干旱胁迫对薄荷幼苗酶活性的影响
干旱胁迫打破了植物体内抗氧化酶系统的稳定,致使活性氧和自由基累积量增加,从而引发了膜脂过氧化水平的加重,使膜系统损伤,保护酶活性降低,植物御旱能力也随之减弱[25]。超氧化物歧化酶(SOD)以及过氧化物酶(POD)能清除植物体内的活性氧和自由基来维持系统平衡,是细胞免受伤害的主要原因之一[26]。本研究表明,伴随干旱时间的不断增加,薄荷幼苗叶片中SOD的活性表现出上升的变化趋势,根中SOD的活性则表现出先降后升的变化趋势,说明在干旱胁迫下SOD清除活性氧自由基的能力增强[25]。相反,其POD活性均呈先升后降的变化趋势,说明长时间的重度干旱胁迫对薄荷幼苗POD活性的影响均比较明显。正如卓礼丰[27]对桂花的研究,保证保护酶体系的正常运转,必须依靠这几种酶相互协调和相互作用,干旱胁迫下薄荷幼苗的SOD和POD活性变化基本处于互补的趋势,这种通过不同酶之间相互协调以维持体内活性氧代谢的平衡,也是植物共同抵抗干旱逆境的一种重要表现。
3.4 干旱胁迫对薄荷幼苗丙二醛含量的影响
学者们普遍认为,干旱胁迫导致植物体内产生大量的自由基,从而引发植物的膜脂过氧化作用,而丙二醛(MDA)作为植物膜脂过氧化反应的重要产物,其积累程度直接体现了脂膜过氧化作用水平和膜结构的受害程度[28,29]。随着干旱程度加重以及干旱时间的增加,薄荷幼苗叶片中MDA的含量整体呈上升的趋势,根部MDA的含量呈先升后降。李文娆等[30]对紫花苜蓿的研究,在胁迫初期,地上及地下部分MDA 含量未发生显著变化,但随着干旱时间的增加以及胁迫程度的加重,其含量不断累积,地下部分MDA的含量变化程度明显大于地上部分,表明干旱胁迫处理条件下地下部分对膜脂的过氧化反应较地上部分更为敏感。
4 结论
本次试验结果表明,随着干旱处理时间的延长,各个处理梯度下的叶绿素a、叶绿素b、叶绿素总量以及类胡萝卜素的含量均呈先升后降的变化趋势。薄荷叶片和根系脯氨酸含量呈“N”字变化趋势,可溶性蛋白的含量呈先降后升的变化趋势,表明在干旱胁迫处理下薄荷具有一定的渗透调节能力。伴随干旱处理时间的不断增加,薄荷幼苗中叶片的SOD活性呈上升的变化趋势,根系呈先降后升趋势,表明在干旱处理下,薄荷幼苗经过提高保护酶的活性,清除植物体内有害自由基并修复受损细胞来降低干旱胁迫对其带来的损伤,从而使其表现出较强的抗旱能力。相反,薄荷幼苗在胁迫初期,POD活性增大,说明薄荷幼苗通过调节自身不同保护酶的活性,以避免受到由于活性氧的不断累积所带来的伤害;伴随干旱处理时间的不断增加,薄荷叶片和根系POD活性有所下降,但其活性普遍高于对照,这可能是由于薄荷幼苗已经对干旱逆境形成了一定的耐旱机制[31]。随着干旱胁迫程度的加剧和时间的延长,薄荷叶片和根系的MDA积累量逐渐增大。其中,叶片的MDA积累量大于根系,表明叶片中细胞膜质过氧化程度高,细胞膜受到的伤害较严重。
综上所述,薄荷幼苗在干旱胁迫末期生长受到一定的抑制,但部分仍能保持正常的生长存活,在轻、中度干旱胁迫下薄荷幼苗能够通过调节光合色素、丙二醛、渗透调节物质的含量以及保护酶之间的相互协调来提高其抗旱机能,表现出一定的抗旱潜力。因此,薄荷可以作为耐旱性的芳香地被植物被推广运用。
[1]董蕾,李吉跃.植物干旱胁迫下水分代谢、碳饥饿与死亡机理[J].生态学报,2013,33(18):5477-5483.
[2]Chaves MM,Pereira JS,Maroco J,et al.How plants cope with water stress in the field on photosynthesis and growth[J].Annals of Botany,2002,89:907-916.
[3]Verslues PE,Agarwal M,Katiyar-Agarwal S,et al.Methods and concepts in quantifying resistance to drought,salt and freezing,abiotic stresses that affect plant water status[J].The Plant Journal,2006,45(4):523-539.
[4]安玉艳,梁宗锁.植物应对干旱胁迫的阶段性策略[J].应用生态学报,2012,23(10):2907-2915.
[5]季杨,张新全,彭燕,等.干旱胁迫对鸭茅幼苗根系生长及光合特性的影响[J].应用生态学报,2013,24(10):2763-2769.
[6]吕爽,田呈瑞,王虎,等.不同薄荷多酚、总黄酮及体外抗氧化性比较[J].食品工业科技,2011,32(8):160-163.
[7]徐凌玉,李振麟,蔡芷辰,等.薄荷化学成分的研究[J].中草药,2013,40(20):2798-2802.
[8]沈梅芳,李小萌,单琪媛.薄荷化学成分与药理作用研究新进展[J].中华中医药学刊,2012,30(7):1484-1486.
[9]陈硕.薄荷属精油食品级微乳体系的构建及其抑菌研究[D].上海:上海应用技术学院,2015.
[10]李慧,白红彤,王晓,等.椒样薄荷、薄荷和苏格兰留兰香精油与抗生素的协同抑菌功能[J].植物学报,2011,46(1):37-43.
[11]梁呈元,刘艳,李维林,等.薄荷属植物遗传多样性的ISSR分析[J].中药材,2011,34(8):1190-1193.
[14]沈梅芳,李小萌,单琪媛.薄荷化学成分与药理作用研究新进展[J].中华中医药学刊,2012,7(30):1484-1487.
[15]李合生,孙群.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000,164-169.
[16]姜卫,高光林,俞开锦,等.水分胁迫对果树光合作用及同化代谢的影响研究进展[J].果树学报,2002,19(6):416-420.
[17]潘昕,邱权,李吉跃,等.干旱胁迫对两种速生树种叶绿素含量的影响[J].桉树科技,2013,30(3):17-22.
[18]孙景宽,李田,夏江宝,等.干旱胁迫对沙枣幼苗根茎叶生长及光合色素的影响[J].水土保持通报,2011,31(1):68-71.
[19]桑子阳,马履一,陈发菊.干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J].西北植物学报,2011,31(1):109-115.
[20]刘艳,陈贵林,蔡贵芳,等.干旱胁迫对甘草幼苗生长和渗透调节物质含量的影响[J].西北植物学报,2011,31(11):2259-2264.
[21]孙彩霞,沈秀英,刘志刚.作物抗旱生理生化机制的研究现状和进展[J].杂粮作物,2001,22(5):285.
[22]王晓冬,李蕴峰,刘宇明.干旱胁迫对真桦光合特性及渗透调节物质含量的影响[J].防护林科技,2012,(1):25-27.
[23]孙继亮,李六林,陶书田,等.干旱胁迫和复水对梨幼树生理特性的影响[J].应用与环境生物学报,2012,18(2):218-223.
[24]黄承建,赵思毅,王龙昌,等.干旱胁迫对苎麻叶绿素含量的影响[J].中国麻业科学,2012,34(5):208-212.
[25]王飒,周琦,祝遵凌.干旱胁迫对欧洲鹅耳枥幼苗生理生化特征的影响[J].西北植物学报,2013,33(12):2459-2466.
[26]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.
[27]卓礼丰.干旱胁迫对桂花生长及生理生态的影响[D].浙江:浙江农林大学,2011.
[28]Wang Z L, Huang B R.Physiological recovery of Kentucky bluegrass from simultaneous drought and heat stress[J].Crop Science,2004,44(5):1729-1736.
[29]田魏龙,蒋志荣.不同沙棘品种对干旱胁迫的生理生化响应[J].中国沙漠,2011,31(5):1215-1230.
[30]李文娆,张岁歧,山仑.苜蓿叶片及根系对水分亏缺的生理生化响应[J].草地学报,2007,15(4):299-305.
[31]季杨,张新全,彭燕,等.干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响[J].草业学报,2014,23(3):144-151.
(编辑:梁文俊)
Effects of drought stress on physiological characteristic of above and below ground parts ofMenthahaplocalyxBriqseedling
Wu Xi, Ren Ruifen, Ren Cai, Yang Xiuyun*
(CollegeofForestryShanxiAgricultureUniversity,Taigu030801,China)
[Objective]Using theMenthahaplocalyxBriqannual seedlings as experimental material,we investigated the physiological and biochemical responses ofMenthahaplocalyxBriqunder soil drought stress with four different soil content levels.[Methods]The soil moisture was 75%~85% for the normal level,60%~65% for mild drought,40%~45% for moderate drought,25%~35% for severe drought.[Results]The results showed that:(1)Along with the period of drought stress continued,the contents of chlorophyll-a,chlorophyll-b,total chlorophyll contents and carotenoids showed a trend of increasing firstly decreasing then under the different treatments.(2)Contents of proline of roots and leaves showed N trend,the relative increase of free amino acids were greater in roots than in leaves. While the soluble protein contents of different parts were decreased firstly and then increased, and they were higher in leaves. This might be because the main area for protein production is blade, whereas the root system is the synthesis of amino acids.(3)In protective enzyme, the variation trend in SOD activities were increased in leaves and decreased firstly and then increased in roots, while POD activities were increased firstly and then decreased. To ensure the stability of internal environment by different enzyme coordinate with each other is a manifestation of stress resistance. (4)The contents of MDA were increased gradually in leaves and increased firstly and then decreased in roots. It reveals that the root is more sensitive to lipid peroxidation than blade under drought stress.[Conclusion]We can concluded that the growth ofMenthahaplocalyxBriqseedlings were negatively influenced by different degree of drought stress, but the protective enzyme system and osmatic adjustment substance could adjust themselves to avoid water drought harms, which led to some drought resistant properties ofMenthahaplocalyxBriqof to drought conditions.
Drought stress,MenthahaplocalyxBriq, Above and below ground parts, Physical index
2016-07-10
2016-09-06
武曦(1992-),女(汉),山西临汾人,硕士研究生,研究方向:园林植物育种
*通信作者:杨秀云,教授,硕士生导师,Tel:13935415071;E-mail:xyyang2002@yeah.net
山西省科技攻关项目(20140311013-4),山西省科技攻关项目(20140311027-1)
S789.7
A
1671-8151(2017)01-0040-08

