低温处理黄粉虫蛹对管氏肿腿蜂寄生效能的影响
胡尊瑞,吴晓云,迟全元,赵梅婷,王增霞
(1.北京农业职业学院园艺系,北京 102442;2.中国农业科学院植物保护研究所,北京 100193)
低温处理黄粉虫蛹对管氏肿腿蜂寄生效能的影响
胡尊瑞1,2,吴晓云1,迟全元1,赵梅婷2,王增霞2
(1.北京农业职业学院园艺系,北京 102442;2.中国农业科学院植物保护研究所,北京 100193)
中间寄主的营养状况是影响寄生蜂繁育效果的主要因素。对中间寄主进行处理以抑制其发育,保证其有充足的营养满足子代寄生蜂发育所需。本文研究了在0℃和2℃条件下中间寄主黄粉虫蛹体内营养物质蛋白质、总糖、海藻糖、糖原含量等随处理时间的先升高后下降的变化趋势,表皮硬化程度以及肿腿蜂的寄生率之间的关系。结果表明:寄生蜂寄生率与中间寄主体内营养物质含量呈正相关变化,与表皮硬化程度呈负相关变化。推荐2℃作为中间寄主处理的适宜温度,处理时间为24 h。
管氏肿腿蜂;黄粉虫蛹;低温冷藏;生理生化;寄生率
在人工大量扩繁管氏肿腿蜂Sclerodermaguani的工作中,需要对中间寄主黄粉虫Tenebriomolitor采取一定的处理措施来解决种蜂能够成功寄生中间寄主的问题(田慎鹏和徐志强,2003;贺凯等,2006;陈倩等,2008)。若不对中间寄主进行低温冷藏、酒精麻醉等处理,种蜂就不能成功地寄生中间寄主或者寄生率很低,达不到商品化生产的要求(陈倩等,2006;杨华等,2007;姚万军,杨忠岐,2008)。因此中间寄主的处理是商品蜂繁育工作中的关键问题。
对中间寄主黄粉虫蛹的处理时间过长,会造成部分中间寄主的死亡,浪费原材料,虚占空间;处理时间过短则不能抑制住中间寄主的发育速度,初化蛹在常温下2 h后其表皮便会迅速老化,7-10 d内蛹就会羽化为成虫了。如管氏肿腿蜂不能迅速对初化蛹蜇刺麻痹的话,极容易出现寄生不成功。因此需要准确地确定对中间寄主进行处理的时间,提高对中间寄主的处理效率,获得适于接蜂繁育的中间寄主从而节省原材料和能源,保持繁育的高效性。因此,采用对中间寄主进行低温处理以降低中间寄主的生理活动,抑制其继续发育,测定这一期间黄粉虫蛹体内营养物质变化情况与寄生蜂寄生率之间的关系,以期为实现肿腿蜂商品化生产提供理论依据和技术支持。
1 材料与方法
1.1 试验材料
黄粉虫蛹:为市场售黄粉虫幼虫,购买后在室内饲养,直至老熟幼虫化蛹。管氏肿腿蜂为野外采集,实验室繁育。
试验仪器:匀浆器、离心机(legend MicRo 17R)、HPG-280 B型恒温控湿光照培养箱、容声BCD-233YM型冰箱、紫外分光光度计:UNIC(尤尼柯UV-28D2 H型紫外可见分光光度计)、电热恒温水槽:DR-8型、Nikon双筒解剖镜、搪瓷盘、接蜂用毛笔、指形管(12×50 mm)等小型器具。
试剂:葡萄糖分析纯、蒽酮试剂分析纯、牛血清蛋白分析纯、酒精分析纯、海藻糖分析纯、糖原分析纯、考马斯亮蓝G-250、三氯乙酸分析纯、PBS缓冲液10×贮存液:称79 g NaCl,2 g KCl,14.4 g Na2HPO4和18 g K2HPO4,溶于800 mL 蒸馏水中,HCl调节溶液的pH值7.4,最后加蒸馏水定容至1 L,室温保存,用时稀释10倍。
1.2 试验方法
1.2.1 挑选中间寄主及处理
选择黄粉虫蛹(以下简称中间寄主),将同一时间内挑出的蛹集中放于培养皿,将不同时间段蛹用记号笔分别标记,分别在0℃和2℃下,连续处理72 h,每隔12 h取样一次进行生化分析,不同处理重复9次,取平均值,以常温下处理的黄粉虫蛹为对照。
1.2.2 试验方法
1.2.2.1 中间寄主体内蛋白质含量的测定
采用考马斯亮蓝G-250法测定虫体内的游离蛋白质含量。取中间寄主蛹10头,加入2.0 mL磷酸盐缓冲液,冰浴匀浆后,移至10.0 mL离心管中,用8.0 mL缓冲液冲洗匀浆器3次,在高速离心机上10000 rpm,离心15 min,除去膜组织,取上清液,过滤,再次离心10 min,取上清液,于595 nm处测OD值。重复9次,计算出平均值,利用标准曲线上查出OD值所对应的蛋白质含量。
1.2.2.2 中间寄主体内糖类含量的测定
a. 总糖含量的测定:采用蒽酮法测定虫体内的可溶性糖原含量(王思忠等,2008)。取同批次处理的中间寄主蛹10头,加入三氯乙酸(TCA)2.0 mL,充分研磨,移入离心管,用6.0 mL三氯乙酸冲洗匀浆器3次,一并转入离心管,于5000 rpm下离心15 min,除去蛋白质,取上清液,再在沉淀中加入2.0 mL三氯乙酸,剧烈震荡5 min后,再次离心5000 rpm下15 min,合并上清液,于620 nm处测定OD值,重复9次,计算出平均值,利用标准曲线上查出OD值所对应的总糖含量。
b.海藻糖含量测定:测定方法参照仵均祥等(2004)报道方法。取a提取液l.0 mL于带塞玻璃试管中,加0.075 mol/L H2SO42.0 mL,水浴10 min。冷却后加300 g/L KOH 2.0 mL,煮沸10 min,用于破坏还原糖。采用蒽酮法于 620 nm 处测OD值,重复9次,计算出平均值,利用标准曲线上查出OD值所对应的海藻糖含量。
c.糖原含量测定:测定方法参照仵均祥报道方法(仵均祥等,2004)。取a提取液2.0 mL于离心管中,加入6.0 mL 95%乙醇,再加2-3滴饱和Na2SO4溶液,置于4℃冰箱中,3 d后取出4000 rpm离心15 min,弃上清夜,70℃短时加热去乙醇得沉淀,加蒸馏水溶解沉淀并定容至10 mL。采用蒽酮法于620 nm处测OD值,重复9次,计算出平均值,利用标准曲线上查出OD值所对应的糖原含量。
d.黄粉虫蛹表皮随时间硬化测定:检测各处理组黄粉虫蛹表皮硬化程度,每组测定20头蛹,重复4次。以“+”表示表皮硬化程度,一个“+”表示表皮稍微有点硬化,“+++”表示表皮中等程度的硬化,“+++++”表示表皮高度硬化。
1.2.3 接蜂试验
将不同温度处理的黄粉虫蛹放入玻璃指形管(12×50 mm)中,每管放一头处理蛹,按照蜂虫比为3 ∶1进行接蜂试验,接完蜂后用棉球堵住指形管管口,防止管氏肿腿蜂逃逸。每个处理接蜂60管,重复3次。将接种好的黄粉虫蛹放在温度为26℃,相对湿度为75%的恒湿恒温培养箱中进行培养,试验过程中统计各处理组的寄生成功率。
应用SPSS 17.0软件对上述数据进行单因素方差分析。
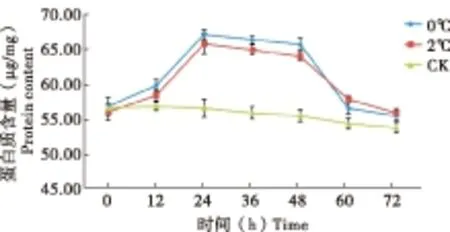
图1 黄粉虫蛹经处理后体内蛋白质含量变化曲线Fig.1 The curves of body protein content after treatment to Tenebrio molitor pupa
2 结果与分析
2.1 蛋白质含量变化
处理温度和时间对中间寄主体内蛋白质含量变化均存在一定的影响(图1)。试验组的变化规律是先升高后降低,对照组蛋白质变化则比较平稳。蛋白质含量从0-12 h时间段缓慢上升,12-24 h为急剧上升时期,24-48 h阶段时蛋白质含量变化趋于平稳;在48-72 h阶段蛋白质含量下降。在0℃处理条件下,蛋白质含量由最初的56.73 μg/mg,到24 h时含量最大值达到67.07 μg/mg,增幅为18.23%;而在2℃处理条件下,增幅为17.52%。蛋白质含量升高是因在低温处理条件下机体产生了抗冻蛋白(AFP)或抗冻肽(Graether等,2000;Liou等,2000),提高中间寄主的抗冻性,所以表现为在一定的时间段内体内蛋白质含量的增加。随着处理时间的延长,中间寄主体内营养物质消耗,其体内的蛋白质含量逐渐下降。
2.2 糖类含量变化
2.2.1 总糖含量变化
处理温度和时间对中间寄主体内总糖含量变化均存在一定的影响(图2)。在各处理温度下,试验组总糖含量随处理时间的延长呈现出先升高后下降的趋势,对照组总糖含量比较平稳。试验组在0℃处理条件下,总糖含量升高速率最快,在12 h时总糖含量比2℃处理条件下总糖含量高出5.80 μg/mg,到达最高点的时间是在24 h处,总糖含量为28.93 μg/mg比CK高6.81 μg/mg;在2℃处理条件下到达最高点的时间也是在24 h处,总糖含量为31.00 μg/mg比CK高8.53 μg/mg;在48-72 h时段之间,中间寄主在2℃处理条件下的总糖含量比0℃处理条件下的总糖含量下降的更快。

图2 黄粉虫蛹经处理后体内总糖含量变化曲线Fig.2 The curves of body total sugar content after treatment to Tenebrio molitor pupa
总糖含量逐渐升高的原因是在处理条件下体内的非糖物质成为糖类物质,从而降低过冷却点增加中间寄主的抗冻性。在0℃和2℃处理条件下的中间寄主都在24 h处体内总糖含量达到最大值,分别为29.60 μg/mg和31.00 μg/mg;24-72 h随着处理时间的延长体内营养物质逐渐消耗,总糖含量逐渐下降并且在2℃处理条件下中间寄主体内的总糖含量消耗的更快(图2)。72 h时,在2℃条件下总糖含量比0℃下低0.94 μg/mg。
2.2.2 海藻糖含量变化
在不同处理温度下,试验组中间寄主体内海藻糖含量随着保藏时间的延长均表现出先升高后降低的趋势,对照组海藻糖曲线相对平稳(图3)。在0℃处理条件下海藻糖含量上升最快,最高值出现在24 h,含量为6.00 μg/mg,2℃条件下最大值为5.87 μg/mg。海藻糖作为昆虫体内的血糖,可直接供昆虫使用,维持昆虫的生命活动。海藻糖是昆虫抗寒性主要物质,与昆虫体内的过冷却点有直接的关系。海藻糖含量的提高增加昆虫的抗冻性,这点与海藻糖在大斑芫菁Mylabrisphalerate代谢规律是一致的(朱芬等,2008)。随着时间延长,中间寄主体内海藻糖逐渐消耗,且0℃条件下黄粉虫蛹体内海藻糖消耗的较快。

图3 黄粉虫蛹经处理后体内海藻糖变化曲线Fig.3 The curves of body trehalose content after pretreatment to Tenebrio molitor pupa
2.2.3 糖原含量变化
处理温度和时间对中间寄主体内糖原含量均存在一定的影响,试验组在各处理温度下糖原含量均呈现出先升高后下降的趋势,在0℃和2℃处理条件下的中间寄主糖原含量都在12 h处含量达到最大值(图4)。0℃处理条件下在12 h处糖原含量达到最大值为3.36 μg/mg比CK含量多0.81 μg/mg;在72 h处糖原含量比CK含量少1.00 μg/mg;2℃处理条件下在12 h处含量达到最大值3.16 μg/mg比CK含量多0.62 μg/mg;在72 h处糖原含量比CK含量少1.28 μg/mg。分析
为糖原含量逐渐升高是试验组黄粉虫体内的非糖物质转化为糖原物质,降低中间寄主的过冷却点从而增加中间寄主的抗冻性,生成的糖原又进一步转化为海藻糖等抗冻性更强的物质,导致糖原含量下降。大斑芫菁滞育幼虫在准备滞育时储备了大量糖原,这些糖原可能为滞育期间海藻糖、山梨醇和甘油的代谢提供了原料积累,转化为如海藻糖、蔗糖、果糖、葡萄糖等,从而提高昆虫的抗寒能力。棉铃虫Helicoverpaarmigera在滞育进入期大量合成海藻糖、山梨醇等贮存在体液中,这些物质既是能源物质又是很好的抗冻剂防止低温伤害(徐卫华,2008)。

图4 黄粉虫蛹经处理后体内糖原含量变化曲线Fig.4 The curves of body glycogen content after pretreatment to Tenebrio molitor pupa
2.2.4 黄粉虫蛹表皮变化
随着保藏时间的延长,中间寄主黄粉虫蛹表皮不断进行硬化,新化蛹表皮是最嫩的,12 h对照组CK黄粉虫蛹表皮即达到“++”硬化,24-36 h时为“+++”;48 h硬化度“++++”;60-72 h为“+++++”(表1)。如果表皮不及时进行硬化,新化蛹易受到外部物理攻击和损伤;试验组在相同保藏时间下,低温条件有效抑

表1 中间寄主黄粉虫蛹表皮老化程度
注:“+”表示中间寄主黄粉虫蛹表皮老化程度,“+”越多,老化程度越厉害。Note:“+” express harden degree of intermediate hosts’ cuticular layer,the more“+”,the harden degree is.
制试验组黄粉虫蛹表皮硬化,12-36 h期间,黄粉虫蛹表皮硬化程度弱,为“+”;随着时间的延长,这种硬化程度逐渐加剧,48-60 h为“++”;72 h硬化为“+++”。表皮硬化越弱越有利于肿腿蜂的寄生。所以,低温条件更有利于管氏肿腿蜂的寄生。
2.2.5 肿腿蜂对黄粉虫蛹寄生率
试验组管氏肿腿蜂寄生率曲线都是先升高后降低,而CK的寄生率曲线则一直呈下降趋势(图5)。因为肿腿蜂寄生分为识别—蜇刺—取食—产卵等一系列过程,所以寄生率是先升高的(贺凯等,2006);随着表皮硬化程度加剧,寄生率逐渐降低。0℃和2℃试验组,在24 h处,两处理组寄生率达到最大值,分别为91.0%和94.6%;管氏肿腿蜂寄生趋势与中间寄主体内总糖含量相关性极为显著,相关系数为K=0.929(P<0.01)、蛋白质和海藻糖相关性稍差,相关系数分别为K=0.786和K=0.783(P<0.05)。这可能是管氏肿腿蜂在寄生中间寄主时,需要取食中间寄主,进行补充营养物质,促进毒液产生和卵巢的发育(贺凯等,2006),特别是补充蛋白质和糖类能有效提高寄生蜂寄生能力和寿命(郑许松,2003;伍和平和李保平,2007)。而对照组中间寄主营养物质含量稳定,且在常温状态下一直处于发育状态,表皮硬化快,肿腿蜂不能很好补充营养,毒刺不能穿过黄粉虫蛹表皮而进行有效蛰刺,导致寄生率很低。分析发现肿腿蜂寄生率与中间寄主表皮硬化程度呈负相关(K=-0.880;P<0.01显著相关)。依据肿腿蜂寄生效果,推荐在2℃、24 h作为黄粉虫蛹最佳处理组合。

图5 不同处理条件下肿腿蜂对黄粉虫蛹寄生率曲线Fig. 5 Parasite rate of Tenebrio molitor pupa on different treatment
3 结论与讨论
有研究表明昆虫在越冬或经受低温时,体内的蛋白质会发生变化。据报道,在北美的阿拉斯加有33种昆虫含抗冻蛋白(Duman等,2004),而且这种蛋白的作用是阻止昆虫的血淋巴在低温下结冻;在滞育的马铃薯叶甲Leptinotarsadecem及西南玉米杆草螟Diatraeagrandiosella的血淋巴中均发现了滞育蛋白;在棉铃虫的血淋巴蛋白图谱分析过程中,分辨出20多条谱带,其中有许多谱带随着发育阶段的不同,其含量往往发生明显的变化。
对接蜂前中间寄主黄粉虫蛹进行处理,导致其体内营养物质含量、表皮硬化程度发生改变,从而影响管氏肿腿蜂寄生率。综合考虑黄粉虫蛹体内营养物质含量、表皮硬化程度和肿腿蜂寄生率之间的关系。中间寄主经过一定时间的处理后能够获得更好的营养状态,有利于寄生蜂对其产生寄生行为——雌蜂在中间寄主体上取食补充营养并进行寄生、产卵(贺凯等,2006)。寄生蜂寄生率与中间寄主黄粉虫蛹体内营养物质含量情况是一致的。蛋白质、糖类物质含量丰富,肿腿蜂可以有效地补充营养,卵巢、毒腺得到发育(贺凯等,2006),肿腿蜂寄生率高;低温条件抑制了黄粉虫蛹表皮硬化程度,表皮硬化弱,中间寄主的营养物质含量高,寄生蜂寄生效果好;中间寄主的营养物质含量低,表皮硬化程度强,肿腿蜂的寄生率就低。
综上所述,肿腿蜂寄生率与低温处理中间寄主体内营养物质含量成正相关,与表皮硬化程度成负相关。经低温处理后中间寄主营养丰富,寄生蜂在取食寄主补充营养后,可以有效对寄主进行蛰刺,并且补充营养能够有效延长寄生蜂寿命,提高寄生蜂寄生率高。低温处理抑制黄粉虫蛹表皮硬化程度,肿腿蜂对黄粉虫蛹能取食方便、蜇刺有效。处理时间过短,肿腿蜂不识别、蜇刺,处理时间过长,黄粉虫蛹表皮硬化严重,虽然识别但蜇刺无效导致寄生失败。所以推荐使用2℃作为中间寄主黄粉虫蛹处理温度,低温处理黄粉虫蛹时间为24 h。
关于肿腿蜂识别中间寄主与黄粉虫蛹体内营养物质之间关系还有待进一步研究。
References)
Chen Q, Liang HZ, Zhang QS.Effect of cold storage ofTenebriomolitorpupae onSclerodermusguani(Hymenoptera: Bethylidae)breeding[J].ChineseJournalofBiologicalControl, 2006, 1: 7. [陈倩,梁洪柱,张秋双.低温贮存黄粉虫蛹对管氏硬皮肿腿蜂繁育的影响[J]. 中国生物防治, 2006, 1: 7]
Chen Q,Liang HZ,Gao LW,etal.Influence of host storage temperature and duration on the reproduction ofSclerodermaguani[J].ChineseJournalofBiologicalControl,2008,24(1):7-11. [陈倩,梁洪柱,高灵旺,等.中间寄主贮存温度和时间对管氏肿腿蜂繁殖的影响[J].中国生物防治,2008,24(1):7-11]
Duman JG, Bennett V, Sformo T,etal. Antifreeze proteins in Alaskan insects and spiders[J].JournalofInsectPhysiology,2004,50(4): 259-266.
Graether SP, Kuiper MJ, Gagne SM. β-Helix structure and ice-binding pro-perties of a hyperactive antifreeze protein from an insect[J].Nature,2000,406:325-328.
He K, Xv ZQ, Dai PL. The parasitizing behavior ofSclerodermaguaniXiao et Wu (Hymenoptera: Bethylidae)wasps onTenebriomolitorpupae[J].ActaEntomologicaSinica,2006,49(3):454-460.[贺凯,徐志强,代平礼.管氏肿腿蜂对黄粉甲的寄生行为[J].昆虫学报,2006,49(3):454-460]
Liou YC, Tocilj A, Davies PL,etal. Mimicry of ice structure by surface hydroxyls and water of α,β-helix antifreeze protein[J].Nature,2000,406:322-324.
Tian SP, Xv ZQ. Effects of different temperatures on the development ofSclerodermaguanireared withTenebriomolitor[J].EntomologicalKnowledge,2003,40(4):356-359. [田慎鹏,徐志强.不同温度条件对利用黄粉甲繁育管氏肿腿蜂的影响[J].昆虫知识,2003,40(4):356-359]
Yang H, Yang W, Zhou ZJ,etal.Parasitization capacity, fecundity and life table of laboratory population ofSclerodermasichuanensisXiao on the pupae ofTenebriomolitorLinne[J].ChineseJournalofBiologicalControl,2007,23(2):110-114.[杨华,杨伟,周祖基,等. 川硬皮肿腿蜂在黄粉虫蛹上的寄生、繁殖能力及实验种群生命表[J].中国生物防治,2007,23(2):110-114]
Wang SZ, Li Q, Feng CH,etal. Cold-hardiness ofLocustamigratoriatibetensisin each developmental stage[J].ChineseBulletinofEntomology,2008,44(6):896-897.[王思忠,李庆,封传红,等.西藏飞蝗各发育阶段的耐寒性[J].昆虫知识,2008,44(6):896-897]
Wu JX, Yuan F, Su L.Change of carbohydrate contents in larvae of the wheat midge,Sitodiplosismosellana(Gehin)during mature and diapause stage[J].ActaEntomologicaSinica, 2004, 47(2):178-183.[仵均祥,袁锋,苏丽.麦红吸浆虫幼虫滞育期间糖类物质变化[J].昆虫学报,2004,47(2):178-183]
Wu HP, Li BP. Influence of supplementary food on longevity and feeding behavior ofMeteoruspulchricornis(Hymenoptera:Braconidae)[J].ChineseJournalofBiologicalControl,2007,23(2):184-187.[伍和平, 李保平. 补充营养对斑痣悬茧蜂寿命和取食行为的影响[J]. 中国生物防治,2007,23(2):184-187]
Xv WH.Advances in insect diapauses[J].ChineseBulletinofEntomology,2008,45(4):512-527. [徐卫华.昆虫滞育研究进展[J]. 昆虫知识,2008,45(4):512-527]
Yao WJ, Yang ZQ. Mass-rearing ofSclerodermusguani(Hymenoptera: Bethylidae)with substitute host[J].ChineseJournalofBiologicalControl,2008,24(3):220-226.[姚万军,杨忠岐.人工繁殖管氏肿腿蜂的替代寄主研究[J].中国生物防治,2008,24(3):220-226]
Zheng XS, Yu XP, Lv ZX,etal. Effects of different nutritional resource on the longevity and parasitic ability of egg parasitoidAnagrusnilaparvatae[J].ChineseJournalofAppliedEcology,2003,14(10):1751-1755. [郑许松,俞晓平,吕仲贤,等. 不同营养源对稻虱缨小蜂寿命及寄生能力的影响[J]. 应用生态学报,2003,14(10):1751-1755]
Zhu F,Li H,Wang Y,etal.Change of glycogen and polyol contents of the diapausing larve ofMylabrisphalerata(Palla)(Coleoptera:Meoidae)at different diapausing stage[J].ActaEntomologicaSinica,2008,51(1):9-13.[朱芬,李红,王永等.大斑芜菁滞育幼虫在滞育不同阶段体内糖类和醇类含量的变化[J].昆虫学报,2008,51(1):9-13]
Pupae ofTenebriomolitortreatment in low temperature to the effect ofSclerodermaguaniparasitism
HU Zun-Rui1,2,WU Xiao-Yun1,CHI Quan-Yuan1,ZHAO Mei-Ting2,WANG Zeng-Xia2
(1. Department of Horticulture,Beijing Vocation College of Agriculture,Beijing 102442, China;2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The nutrition status of intermediate hosts is the main factor affecting the breeding effect of parasitic wasps.It is necessary to process the intermediate hosts in order to block the development,and to ensure that it meets the development of the offspring. Therefore, it is special significance to explore the suitable treatment temperature and time. Under the condition of 0℃ and 2℃ studying the relationship among nutrient substance ofTenebriomolitorpupae changes with time,such as protein,total sugar,trehalose,glycogen increased first and then decreased, harden degree of intermediate hosts’ cuticular layer and parasite rate ofSclerodermaguani. It is clearly that the parasite rate ofSclerodermaguanihas a positive correlation with the content of intermediate hosts’ nutrient substance, and has a negative correlation with harden degree of intermediate hosts’ cuticular layer. In the end, it is advised that 2℃ as the suitable temperature to treat intermediate host, and the time for treatment is 24 h.
Sclerodermaguani;pupae ofTenebriomolitor;cold storage;physiology and biochemistry;parasite rate
北京市农业基金科技项目(20140144);北京农业职业学院科研项目(XY-DKC-14-06)
胡尊瑞,男,1985年生,山东临沂人,讲师,博士,主要从事有害生物防治研究,E-mail:huzunrui001@163.com
Received:2016-02-04;接受日期Accepted:2016-04-12
Q965;S476
A
1674-0858(2017)01-0187-06
胡尊瑞,吴晓云,迟全元,等.低温处理黄粉虫蛹对管氏肿腿蜂寄生效能的影响[J].环境昆虫学报,2017,39(1):187-192.
——黄粉虫

