阿司匹林丁香酚酯的一代繁殖毒性研究
赵晓乐,孔晓军,杨亚军,刘希望,李世宏,秦哲,焦增华,李剑勇(中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,兰州 730050)
阿司匹林丁香酚酯的一代繁殖毒性研究
赵晓乐,孔晓军,杨亚军,刘希望,李世宏,秦哲,焦增华,李剑勇*
(中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,兰州 730050)
为了初步评价阿司匹林丁香酚酯(AEE)对亲代大鼠的生殖功能和子代早期发育的影响,将360只Wistar大鼠随机分成6组,分别为受试药物AEE高、中、低剂量组(剂量分别为498.0、124.5和31.1 mg·kg-1·d-1),阿司匹林组(剂量为68.4 mg·kg-1·d-1),丁香酚组(剂量为246.0 mg·kg-1·d-1),空白对照组(给予常规维持饲料)。各实验组均按设定剂量连续给药10周后,测定亲代大鼠主要的脏器系数、繁殖指数和生产指标以及子代(F1)仔鼠的出生指标和生长指标。结果显示,与空白对照组相比,高剂量的AEE影响胎鼠的生长(P<0.05),并且高剂量AEE组大鼠的妊娠率、窝产仔数、出生活仔率和出生存活率都偏低,其中雄性仔鼠比例偏高;阿司匹林组妊娠大鼠和哺乳期胎鼠生长缓慢(P<0.05);高剂量组AEE亲代大鼠的睾丸和附睾系数偏高(P<0.05),阿司匹林和丁香酚组子代大鼠的附睾系数偏高(P<0.05)。结果表明,在本试验条件下,AEE对大鼠繁殖毒性的最大无损害作用剂量为31.1 mg·kg-1·d-1,对大鼠的最小有损害作用剂量为124.5 mg·kg-1·d-1。
阿司匹林丁香酚酯;生殖毒性;发育毒性;繁殖指标
阿司匹林丁香酚酯(Aspirin eugenol ester, AEE)由阿司匹林(Aspirin)与丁香酚(Eugenol)经过酰氯反应合成的一种新型的无色透明药用化合物。前期研究表明AEE一方面可降低Aspirin对胃肠道的刺激性,另一方面又可增强Eugenol的稳定性,同时临床作用的结构部位不会发生改变[1]。药理学研究表明,等剂量的AEE对二甲苯致大鼠耳廓肿胀模型的抗炎效果与Aspirin相当,在酵母菌致大鼠发热模型中,AEE的解热效果与等剂量的Aspirin无显著差异,但AEE的药效更持久。此外,AEE还具有镇痛、抗氧化、抑制血小板聚集、降低血脂等生物活性[2-4]。药代动力学研究发现,AEE在体内首先分解代谢为水杨酸和Eugenol,进而水杨酸和Eugenol均进行二相代谢转化生成水杨酸的葡萄糖醛酸结合物、水杨酸的甘氨酸结合产物和Eugenol的葡萄糖醛酸结合物和Eugenol的硫酸结合产物,并且这些代谢产物在血浆和尿液中都可以检测到[5]。毒理学研究表明,AEE对小鼠经口急性毒性的半数致死量(LD50)为10.39 mg/kg,大鼠经口急性毒性的LD50是5.98 mg/kg,而前药Aspirin和Eugenol的大鼠急性经口毒性分别为1.93 mg/kg和1.5 mg/kg[6],说明AEE相比前体药物毒性更低。由于合成AEE的前药Aspirin是研究药物致畸作用的阳性对照药物,而AEE在体内分解为Aspirin和Eugenol,因此,AEE是否具有繁殖毒性值得研究。目前未见AEE的繁殖毒性研究报道,因此本实验就AEE对妊娠大鼠、胚胎及子代发育是否有影响进行了研究。
1 材料与方法1.1 药物与试剂 AEE(纯度>99%,HPLC方法检测),中国农业科学院兰州畜牧与兽药研究所制备;Aspirin,武汉合中化工制造有限公司,纯度>99.9%;Eugenol,江西汇通药用香料油有限公司,纯度>99%;吐温-80,国药集团化学试剂有限公司。
1.2 试验动物 6周龄、未经产的Wistar大鼠360只,体重200 g±20 g,随机分为6组,每组60只,雌雄各半。饲养温度为22±3 ℃[7],相对湿度60%±10%,光暗周期12 h。
1.3 实验方法 将AEE设为低、中、高三个剂量组(剂量分别为31.1、124.5和498.0 mg/kg),即L(AEE)、M(AEE)和H(AEE)。Eugenol组的给药剂量为246.0 mg/kg,与H(AEE)组的剂量等摩尔。Aspirin给药组的剂量为68.4 mg/kg,与M(AEE)组的剂量等摩尔。AEE和Aspirin研磨后过100目筛,按剂量比例将其加入到饲料中(福贝世亨生物医药(上海)有限公司成)饲喂大鼠。Eugenol与吐温-80按1∶2质量比配制成混悬液,以饮水方式给予大鼠。
亲代大鼠饲喂10周后,雌雄比按1∶1进行同笼交配。计算繁殖指数:受孕率(受孕率=怀孕大鼠数/交配雌性大鼠数×100%)、妊娠率(妊娠率=分娩有活体幼仔的大鼠数/怀孕大鼠数×100%)、出生活仔率(出生活仔率=出生时活的仔鼠数/出生时仔鼠总数×100%)、出生存活率(出生存活率=产后4 d仔鼠存活数/出生时活仔数×100%)、哺乳存活率(哺乳存活率=21 d断乳时仔鼠存活数/出生4 d后仔鼠存活数×100%)、性别比(性别比=仔鼠成熟时雄鼠数/雌鼠数)。
测定生产指标:每窝产仔数,仔鼠出生后第0、4、7和21天的生长变化。实验结束时解剖实验动物,测定亲代和子代大鼠睾丸和附睾(或子宫和卵巢)的脏器系数[8-10]。
脏器系数=脏器重量/体重×1000
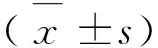
2 结 果2.1 临床表现 除H(AEE)和Aspirin组大鼠的活动和进食略减,被毛疏松外,其余亲代和F1代对照组大鼠在整个试验期间精神状态良好,活动正常,进食、饮水和皮毛均无明显的异常变化。
2.2 妊娠大鼠体重变化 与空白对照组比较,Eugenol组、M(AEE)组和L(AEE)组的孕鼠体重增长无差别(P>0.05);H(AEE)组和Aspirin组的孕鼠体重增长缓慢,有统计学意义(P<0.05),结果见图1。
与空白对照组比较,*P<0.05,**P<0.01图1 各剂量组妊娠大鼠体重增长曲线
2.3 繁殖指数 如表1所示,Eugenol组大鼠的受孕率偏低,H(AEE)组大鼠的妊娠率、出生活仔率和出生存活率偏低,其中性别比例很异常,雄性仔鼠比例偏高。

表1 各剂量组大鼠的繁殖指标
与空白对照组比较,*P<0.05, 差异显著
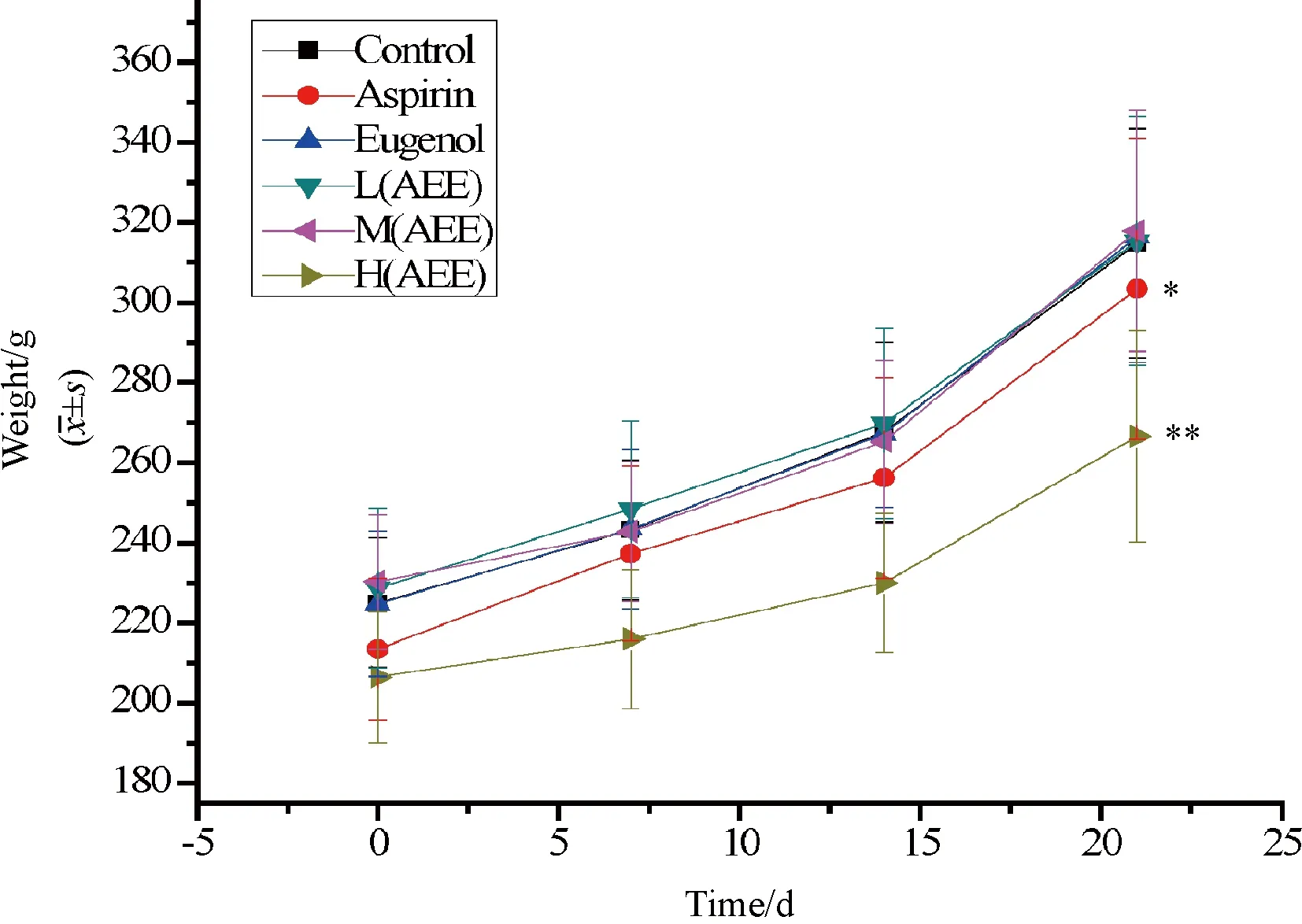
2.4 生长指标 各剂量组的窝产仔数和死亡数如图2所示。窝产仔数是大鼠分娩后第一天平均窝产仔鼠,可见H(AEE)组和Aspirin组大鼠的窝产仔鼠明显偏低(P<0.05)。F1代哺乳期时体重生长见图3,与对照组对比,H(AEE)、M(AEE)和Aspirin组子代大鼠生长缓慢,具有统计学意义(P<0.05)。H(AEE)组子代体重增长最为缓慢,但M(AEE)组子代生长状况明显好于Aspirin组。
2.5 脏器系数 F1代断乳20 d后,亲代大鼠用戊巴比妥钠麻醉,心脏采血后脱臼处死,雌性大鼠分离子宫和卵巢,雄性大鼠分离睾丸和附睾,分别进行称重计算脏器指数,结果见表2。与空白对照组相比,H(AEE)组亲代大鼠的附睾和睾丸的脏器系数偏高(P<0.05)。F1代断乳后给空白饲料饲喂三个月后,Aspirin和Eugenol处理组大鼠的子代附睾的系数偏高(P<0.05)。
3 讨论与小结
AEE的剂型研究还正在进行当中,本试验中将AEE作为原料药直接添加到大鼠饲料中,通过饲喂的方式给予大鼠。各剂量组妊娠大鼠体重增长与空白对照组比较,H(AEE)组和Aspirin组妊娠大鼠的体重增长缓慢,与溶剂对照组相比差异显著(P<0.05)。这表明高剂量的AEE和Aspirin对胎鼠生长发育有一定影响,这与AEE在体内分解为水杨酸和丁香酚有关。与Aspirin组等摩尔的M(AEE)组与空白对照组相比差异不显著,表明AEE对妊娠大鼠产生的毒性比Aspirin小。

与空白对照组比较,*P <0.05,**P <0.01图2 各剂量组亲代大鼠的每窝产仔数
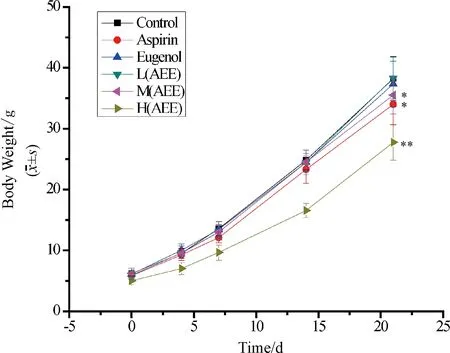
与空白对照组比较,*P <0.05,**P <0.01图3 各剂量组F1代大鼠哺乳期的体重增长
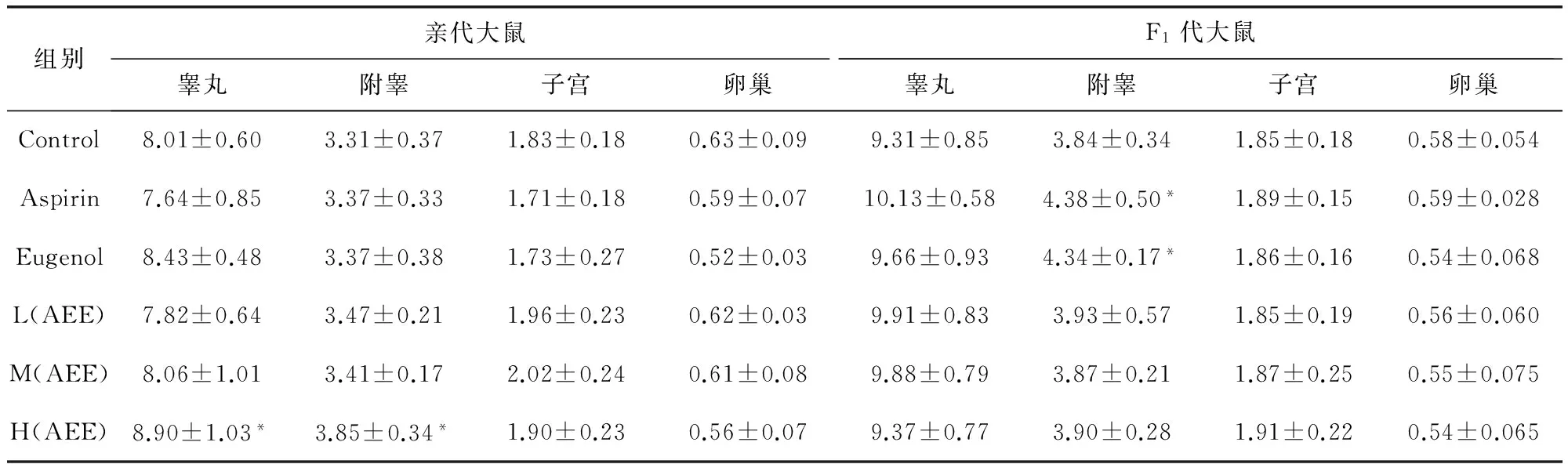
表2 各剂量组亲代和F1代大鼠的主要生殖脏器系数
与空白对照组比较,*P<0.05, 差异显著
各受试药物组大鼠的妊娠率、窝产数、出生活仔率、出生存活率、哺乳存活率、性别比、仔鼠的哺乳期生长等指标与空白对照组比较,结果得出:与溶剂对照组相比,H(AEE)组大鼠妊娠率、窝产数、出生活仔率、出生存活率、哺乳存活率和哺乳期仔鼠的体重增长都偏低,而雄/雌性别比偏高,这表明当AEE为498.0 mg/kg时,会对大鼠的生殖和发育产生影响,导致大鼠的繁殖能力和哺乳能力较弱。Eugenol的剂量为246.0 mg/kg时会降低大鼠的受孕率,说明Eugenol可能影响合子形成或着床[11]。M(AEE)组和L(AEE)组的繁殖指标与空白对照组相比差异不明显。
试验结束时,对雌性大鼠子宫和卵巢,雄性大鼠睾丸和附睾的脏器指数进行统计分析,H(AEE)组亲代大鼠的睾丸和附睾脏器系数偏高,与空白对照组比较差异显著(P<0.05),可见长期接触高剂量的AEE,会对大鼠的睾丸和附睾产生影响[12]。F1代大鼠饲喂空白饲料三个月后,对其睾丸、附睾、子宫和卵巢进行统计学分析,只有Aspirin组和Eugenol组F1代大鼠的附睾的脏器指数偏高(P<0.05),说明Aspirin和Eugenol可能会对子代雄性大鼠的生殖系统产生不良影响,这需要进一步探讨。
以上分析结果表明,498.0 mg·kg-1·d-1剂量的AEE会造成大鼠繁殖指数异常,影响胚胎的发生及胎儿的发育,导致自然流产和胎儿发育迟缓。因此,在本实验的条件下,AEE对大鼠繁殖毒性的最大无损害作用剂量为31.1 mg·kg-1·d-1,对大鼠的最小有损害作用剂量为124.5 mg·kg-1·d-1,并且Aspirin繁殖毒性最大,AEE次之,Eugenol的繁殖毒性最小。此外Aspirin和Eugenol有可能影响后代的生殖系统。
[1] 李剑勇. 阿司匹林丁香酚酯药用化合物制剂及其制备方法[P]. 中国专利: 200810017950.X, 2008-10-01.
[2] 于远光. 阿司匹林丁香酚酯药理学与毒理学研究及其栓剂的研制[D]. 兰州:甘肃农业大学,2011.
[3] Ma N, Liu X W, Yang Y J,etal. Preventive effect of aspirin eugenol ester on thrombosis in κ-carrageenan-induced rat tail thrombosis model [J]. PLoS One, 2015,10(7): 1-14.
[4] Karam I, Ma N, Liu X,etal. Regulation effect of aspirin eugenol ester on blood lipids in Wistar rats with hyperlipidemia [J]. BMC Vet Res, 2015,11: 217.
[5] Li J Y, Yu Y G, Yang Y J,etal. A 15-day oral dose toxicity study of aspirin eugenol ester in Wistar rats [J]. Food and Chemical Toxicology, 2012, 50(6): 1980-1985.
[6] Shen Y M, Liu X W, Yang Y J,etal.Invivoandinvitrometabolism of aspirin eugenol ester in dog by liquid chromato-graphy tandem mass spectrometry [J]. Biomedical Chromato-graphy, 2015, 29: 129-137.
[7] Herbicide Risk Assessment: Clove Oil (Eugenol)[M].Marin: Municipal Water District Vegetation Management Plan, 2008.
[8] 何桂林,孙周莉,闫晗,等. 如何成功开展药物非临床生殖毒性试验 [J]. 中国新药杂志, 2011, 20(22): 2195-2204.
[9] 冯忠武. 兽药研究技术指导原则汇编[M]. 北京:化学工业出版社,2012:119-122.
[10]Mesfin Yimam, Y-C L, Eu-Jin Hyun,etal. reproductive and developmental toxicity of orally administered botanical composition, UP446-part II: effects on prenatal and postnatal development, including maternal function in Sprague-Dawley rats[J]. Birth Defects Research, 2015, 104: 153-165.
[11]董竞武,杨隽,洪新宇,等. 三唑磷原药的大鼠两代繁殖毒性研究[J]. 癌变畸变突变,2012,24(6): 448-451.
[12]孙祖越,周莉,闫晗,等. 药物非临床生殖发育毒性试验中逐案原则的建议[J]. 中国新药杂志, 2012,21(8): 836-843.
[13]董延生,尹纪业,陈长,等. SD 大鼠脏器重量及脏器系数正常参考值的确立与应用[J]. 军事医学,2012,36(5): 351-353.
(编辑:李文平)
Reproductive Toxicity in Parental Generation of Aspirin Eugenol Ester on Rats
ZHAO Xiao-le, KONG Xiao-jun, YANG Ya-jun, LIU Xi-wang, LI Shi-hong, QIN Zhe, JIAO Zeng-hua, LI Jian-yong*
(KeyLabofNewAnimalDrugProject,GansuProvince;KeyLabofVeterinaryPharmaceuticalDevelopment,MinistryofAgriculture;LanzhouInstituteofHusbandryandPharmaceuticalSciencesofCAAS,Lanzhou730050,China)
The reproductive and developmental toxicity of aspirin eugenol ester (AEE) in rats were investigated. Parental generation were exposed to AEE at doses of 498.0、124.5 and 31.1 mg·kg-1·d-1and aspirin at dose of 68.4 mg·kg-1·d-1and eugenol at dose of 246.0 mg·kg-1·d-1for 10 weeks before breeding. The weights of main organs and breeding indexes were observed in P and first filial generation (F1). Results showed that the body weights of P and F1were decreased (P<0.05), and pregnancy rate, litter size, live birth index and viability index on day 4 in high AEE dose group were also lower than those of control group. In addition, high male proportion in sex ratio of F1was very abnormal. Pregnant rats and weaning index in aspirin group grew slowly (P<0.05). Compared to control group,testis and epididymis indexes of P rats in high dose AEE group were high (P<0.05), and epididymis indexes of F1rats in aspirin and eugenol groups were also high (P<0.05). Under the experimental condition, AEE had reproductive toxicity in rats. No observed adverse effect level was 31.1 mg·kg-1·d-1. Low observed adverse effect leve was 124.5 mg·kg-1·d-1.
aspirin eugenol ester;reproductive toxicity;developmental toxicity;reproductive indexes
2016-09-25
A
1002-1280 (2017) 02-0054-05
S859.81
国家自然基金项目(31572573)
赵晓乐,硕士研究生,从事药物繁殖毒性研究。
李剑勇。E-mail: lijy1971@163.com

