不同免疫程序对猪瘟活疫苗免疫效果的研究
卫选智,张付华,王新平,欧阳红生,郭昌明,*(.吉林大学动物科学学院,长春 006;.九江市畜牧兽医局,江西九江000;.吉林大学动物医学学院,长春 006)
不同免疫程序对猪瘟活疫苗免疫效果的研究
卫选智1,张付华2,王新平3,欧阳红生1,郭昌明1,3*
(1.吉林大学动物科学学院,长春 130061;2.九江市畜牧兽医局,江西九江332000;3.吉林大学动物医学学院,长春 130061)
为了解规模化猪场猪瘟疫苗免疫情况和猪瘟病毒感染情况,采用商业化ELISA试剂盒,对大庆市某规模化猪场530份血清样品分别进行猪瘟抗体水平和猪瘟病毒抗原检测。试验结果表明:经过二次免疫的猪群,猪瘟抗体阳性率为95.0%(115/121),比一次免疫的抗体阳性率66.1%(74/112)提高了28.9%,而且抗体水平整齐度较一次免疫显著提高。在530份受检猪只中,利用ELISA试剂盒检测血清中的猪瘟抗原,阳性检出率为0%,表明该猪场猪瘟病毒感染风险较低,对18份可疑样品用RT-PCR检测,没有检测出猪瘟病毒。研究表明,对当前的猪场仅仅实施一次免疫是不够的,只有实施二次免疫,才能获得较高的免疫抗体水平,有效地防控猪瘟疫病的发生。
猪瘟病毒;猪瘟病毒活疫苗;猪瘟抗原;猪瘟抗体;免疫程序
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种高度传染性疫病,以急性、热性以及高度接触性为特征[1]。猪瘟曾在世界各国广泛流行,世界动物卫生组织将其列为必须通报A类传染病[2-4]。在我国临床诊断中,猪瘟的发生率平均可占门诊总量的30%,有时可高达50%,是影响养猪业最严重的传染病之一。历史上,猪瘟给我国养猪业造成了巨大损失。1954年后,我国采用猪瘟活疫苗对猪进行免疫接种,有效地控制了猪瘟的流行,但是目前仍有零星病例的发生[5]。近些年出现的非典型温和型猪瘟与传统猪瘟相比,在病原学、流行病学及临床表现诸多方面均发生变化,对养猪业的发展和本病防控都带来了诸多困难[5-6]。应用ELISA方法定期对疫苗免疫猪群猪瘟抗体进行检测来评估猪瘟活疫苗对猪群免疫效果[7],可为生产实践提供科学证据,能有效地指导猪瘟的防控。
1 材 料
1.1 疫苗 猪瘟活疫苗(细胞源),批准文号:兽药生字(2013)060131084,生产批号:201426,有效期二年,储存于-20 ℃冰箱备用,由某生物股份有限公司提供。
1.2 试验猪 来自黑龙江省大庆市某规模化猪场。临床健康仔猪在产房哺乳至25~35日龄断奶,进行第一次接种免疫,于颈后部肌肉注射猪瘟活疫苗每只2头份/只。然后母猪转到种母舍饲养,仔猪转入保育舍,在育仔栏中饲养至70日龄,每个育仔栏饲养仔猪约30~40头,在60~70日龄时进行第二次免疫,免疫间隔期为35 d,于颈后部肌肉注射猪瘟活疫苗2头份/只,然后转入育肥舍。从 71日龄入舍分别在育肥舍饲养至180日龄出栏。初进猪圈的猪可划分15~20头为一个单元,饲养后期可根据生长情况逐渐分栏,每栏可饲养5~6头至出栏。各组试验猪,在免疫分组前均精神状态良好、饮食欲正常,抽查体温无明显升高,无明显腹泻、拉稀状态。
1.3 血清样品 来自上述试验猪,用一次性无菌采血器以无菌方式前腔静脉采血,3000 r/min 离心10 min,取上清保存于无菌的1.5 mL离心管中,储存于-20 ℃冰箱备用。共收集有效血清530份。
1.4 试剂盒 猪瘟抗原ELISA检测试剂盒(美国IDEXX公司, 批号: C841);猪瘟抗体ELISA检测试剂盒(美国IDEXX公司, 批号: D631);猪瘟病毒通用型RT-PCR 检测试剂盒(批号:CSF20150812P),购于北京世纪元享动物防疫技术有限公司。
1.5 主要仪器与试剂 全波长酶标仪M200 PRO,瑞士TECAN公司;37 ℃恒温箱,10 μL、50 μL、200 μL及1000 μL的单道移液器,200 μL和300 μL的8道移液器,分析天平、离心机、PCR扩增仪、电泳仪、电泳槽、紫外凝胶成像仪、DEPC处理的无菌1.5 mL离心管、吸头及湿盒等,购自长春市美迪斯达医疗器械有限公司。
2 方 法
2.1 试验分组 试验A组:随机选取临床健康猪只145头猪,分别于25~35日龄进行猪瘟活疫苗的第一次免疫接种(简称“一免(A1组)”)和60~70日龄,免疫间隔期为35 d,进行猪瘟活疫苗第二次免疫接种(简称“二免(A2组)”),一、二次免疫均为每头猪于颈后部肌肉注射猪瘟活疫苗2头份;B、C、D组则为与A组不同时间同年内不同批次的仔猪,免疫方法同上,每组150头左右。A组采集一免后和二免后血清样品,B、C、D组则采集二免后血清样品,所有样品均为免疫后第28天,以无菌方式前腔静脉采血分离的血清进行抗体水平检测。
2.2 样品检测方法
2.2.1 血清中猪瘟抗体水平的ELISA检测方法 按照试剂盒使用说明书进行操作。结果判定:以阻断率为标准,阻断率=(阴性对照孔平均OD值-样品孔平均OD值)/阴性对照孔平均OD值×100%。若阴性对照均值>0.500且阳性对照的阻断率>50%,则说明结果有效,可对样品进行判定;样品阻断率≥40%判定为阳性,即有CSFV抗体存在;样品阻断率≤30%判定为阴性,即无CSFV抗体存在;样品阻断率在30%~40%之间,判定为可疑。
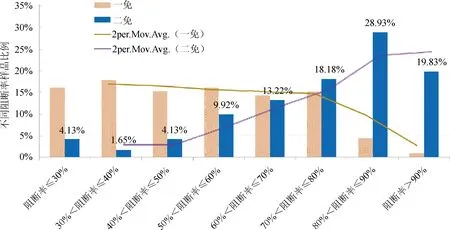
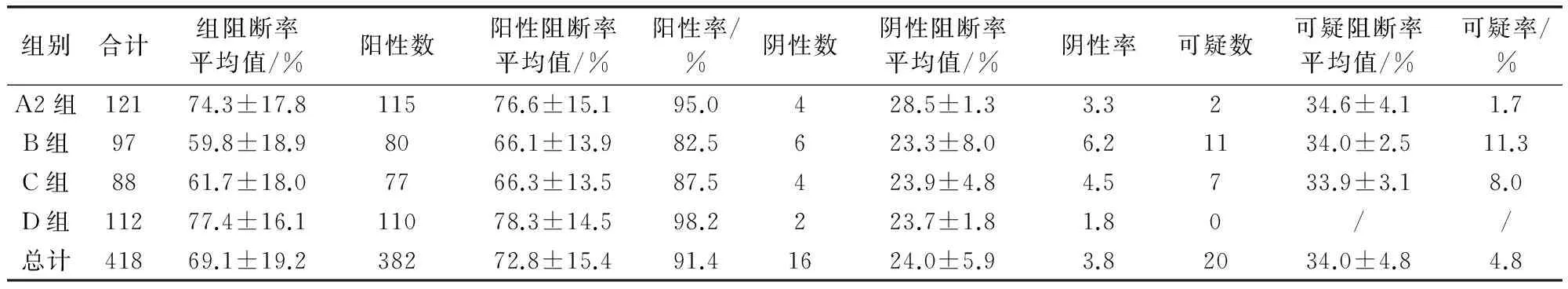
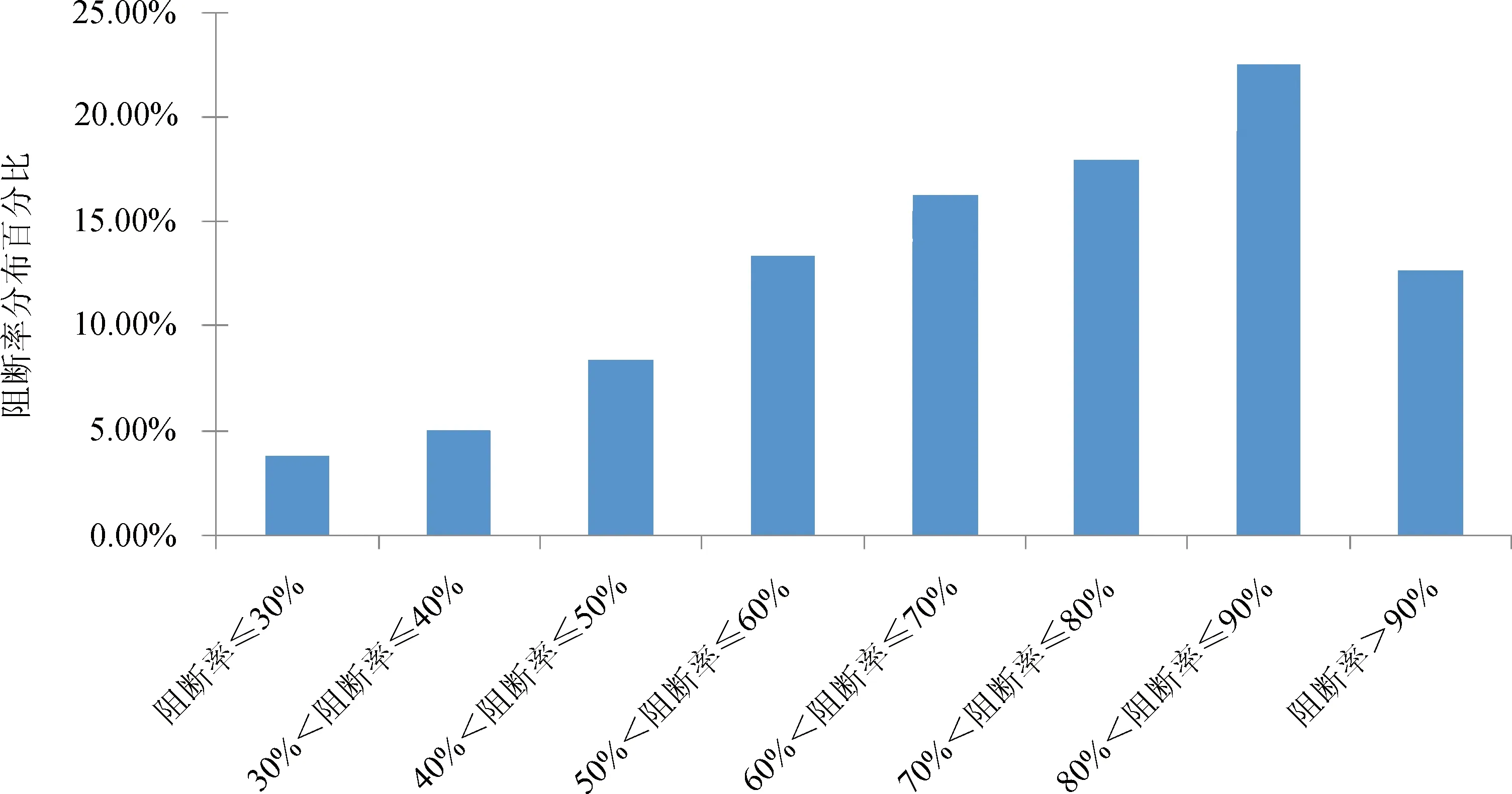
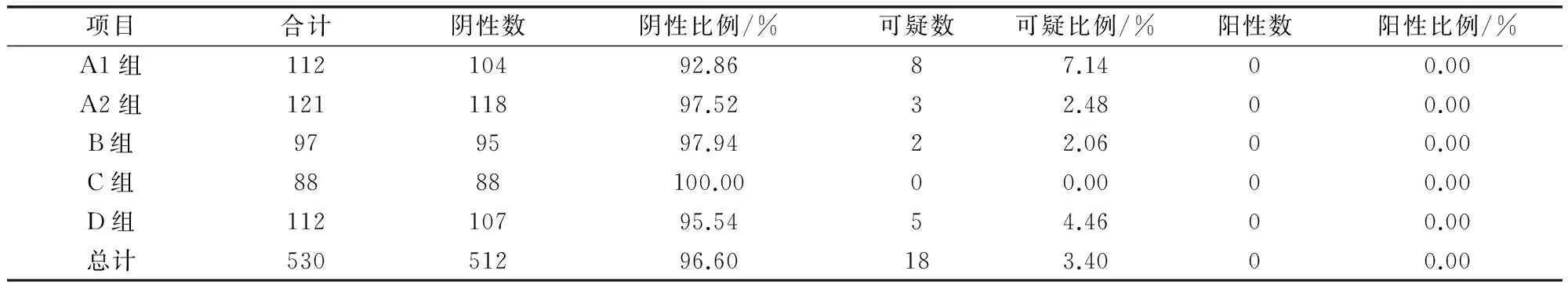
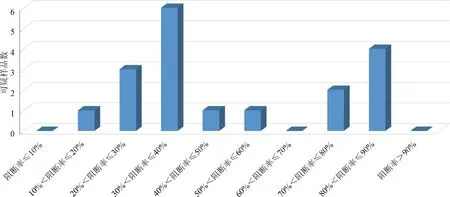
2.2.2 血清中猪瘟抗原水平的ELISA检测方法 按照试剂盒使用说明书进行操作。结果判定:阳性对照孔OD的平均值为P,阴性对照OD的平均值为N,样品的OD平均值为S;仅当P-N≥0.15且N≤0.25时说明结果有效,可对样品进行判定。S-N>0.300时,判为猪瘟病毒抗原阳性;S-N≤0.100时,判为猪瘟病毒抗原阴性;0.100 2.2.3 猪瘟病毒RT-PCR 检测 根据文献[8-9]及试剂盒使用建议,对前述ELISA法检测的猪瘟抗原中18份可疑血清样品及随机选取的3份检测阴性样品,选择商品化试剂盒按其使用说明书进行猪瘟病毒RT-PCR 检测。 2.2.3.1 样品采集与处理 对采集的每份样品和阳性对照、阴性对照分别处理后,各取100 μL,置1.5 mL 灭菌离心管中。 2.2.3.2 病毒RNA 的提取 取已处理的样品、阴性对照和阳性对照,分别加入裂解液600 μL,充分颠倒混匀,室温静置3~5 min。将液体吸入吸附柱中,13000 r/min离心30 s。弃去收集管中液体,加入600 μL 洗液,13000 r/min离心30 s。收集管中液体,加入600 μL 洗液,13000 r/min离心30 s。弃去收集管中液体,13000 r/min空柱离心2 min,以除去残留的洗涤液。将吸附柱移入新的1.5 mL 离心管中,向柱中央加入洗脱液50 μL,室温静置1 min,13000 r/min离心30 s,离心管中液体即为模板RNA。 2.2.3.3 RT-PCR 扩增 每份总体积20 μL,含16.8 μL RT-PCR反应液(用前混匀),1.2 μL酶混合液,2 μL模板RNA。扩增程序:42 ℃ 45 min,95 ℃ 3 min;循环:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 25 s,共35 次;最后72 ℃延伸10 min。 2.2.3.4 电泳 2%琼脂糖凝胶上样电泳后观察结果。 2.2.3.5 结果判定 阳性对照出现235 bp扩增带、阴性对照无带出现(引物带除外)时,试验结果成立。被检样品出现235 bp扩增带为猪瘟病毒阳性,否则为阴性。 3.1 同一组猪一免和二免后血清抗体水平的比较 从A组145头试验猪中采得有效血清112份,受检猪只猪瘟抗体阳性检出率为66.1%(74/112),阴性为16.1%(18/112),可疑为17.9%(20/112);阳性抗体平均阻断率为61.3%,集中在30%~80%之间相对均匀分布。二免后抗体阳性率为95.0%(115/121),较一免提高了28.9%,一二免间抗体阳性率差异显著(P≤0.01);同时阻断率平均值二免(76.6%±15.1%)较一免(61.3%±13.0%)也提高了15.3%;阴性率比例由16.1%(18/112)下降到了3.3%(4/121);可疑样品的平均阻断率虽然变化不大,但比例由一免的17.9%(20/112)下降到二免的1.7%(4/112),见表1和图1。一免和二免抗体水平差异显著(P≤0.01)。 表1 第一次和第二次免疫猪瘟抗体阻断率分析 第一次免疫组为A1组,第二次免疫组为A2组 3.2 不同组猪二免后血清抗体水平的分析 为了进一步分析第二次免疫后猪只血清的抗体水平,选择了同年内不同批次的饲养猪A2、B、C、D组共418份分血清样品,进行抗体水平的分析。其中检出抗体阳性382份,占受检猪只的91.4%(382/418),符合国家农业部要求的70%阳性标准;抗体阻断率水平相对较高,主要分布在50%~100%之间,尤其是分布在60%~90%之间的样品占总检测样品的56.7%(表2、图2)。仅有16份样品抗体水平为阴性,占受检猪只的3.8%(16/418);20份为可疑,占受检猪只的4.8%(20/418)。 图1 第一次和第二次免疫猪瘟抗体阻断率分析 表2 不同组二次免疫后各组猪瘟抗体水平分析 A2组为A组试验猪第二次免疫血清样品 图2 二免后阻断率区间分布 3.3 猪瘟病毒抗原检测结果 在530份受检猪只中,血清中猪瘟抗原阳性检出率为0,可疑检出率为3.4%(18/530),阴性检出率为96.60%(512/530),表明该猪场猪瘟病毒感染风险较低(表3)。对抗原检测结果为可疑的18份样品及随机选择的3份检测结果为阴性的样品采用RT-PCR方进行病毒核酸检测,21份样品均为阴性。对抗原检测为可疑的样品进行分析,抗体阻断率集中在30%~40%和40%~90%两个区间范围内(图3、表4)。 表3 猪血清样品猪瘟抗原水平统计 1-18:ELISA检测可疑样品;19-21:ELISA检测阴性样品;M:DNA MarkerDL2000;“-”:阴性对照;“+”:阳性对照图3 猪血清CSFV RT-PCR结果 表4 猪瘟抗原检测为可疑的18份血清样品检测结果统计 + 阳性;- 阴性;± 可疑,其中1-18号为ELISA抗原检测可疑样品;19-21号为ELISA抗原检测阴性对照样品 图4 阻断ELISA法猪瘟病毒抗原检测可疑样品猪瘟抗体阻断率分布 本研究利用了市场上使用较多的ELISA试剂盒,通过采集某规模化猪场同年内不同时间、不同批次的猪只血清样品,研究猪瘟活疫苗一免和二免对血清抗体水平的影响,以对当前猪瘟活疫苗的免疫程序进行评价。试验中共检测血清样品530份,其中A1组112份与A2组121份的血清抗体检测结果比较表明,二免后血清抗体的阳性率(95.0%)较一免后血清抗体的阳性率(66.1%)提高了28.9%,抗体平均阻断率二免(76.6%±15.1%)较一免(61.3%±13.0%)也提高了15.3%。表明只有一次免疫猪只抗体水平相对较低,未达到农业部《2013 年国家动物疫病强制免疫计划》中规定的抗体合格率在70%以上的要求[10],而二次免疫后与一次免疫相比,免疫效果有了显著的提高(P≤0.01,差异极显著)。随后对同年内不同批次的A2、B、C、D四组猪只二免后的血清进行了检测,在418份试验样品中,91.4%的血清样本(382/418)检出猪瘟抗体阳性,免疫阳性率水平远高于农业部《2013年国家动物疫病强制免疫计划》规定的抗体合格率在70%以上的要求[10],而且抗体阻断率集中在60%~90%之间的占总检测样品的56.7%,表明有很高的抗体整齐度。在RT-PCR试验的所有样品中均未检测到抗原阳性的样品,也说明该猪场猪瘟病毒感染率为0%,猪瘟疾病控制水平比较稳定。以上分析与王娟萍等[11]曾根据ELISA方法对规模化猪场的猪瘟疫苗免疫效果评估的结论相一致。 本次研究表明,对当前的猪场仅仅实施一次免疫是不够的,只有实施二次免疫,才能使猪瘟活疫苗免疫猪群获得较高和整齐的免疫抗体水平,有效地防控猪瘟疫病的发生。 [1] 杜念兴. 猪瘟的回顾与展望[J]. 中国畜禽传染病,1998,20(5): 317-319. [2] 殷震,刘景华. 动物病毒学[M]. 北京:中国科学出版社,1997. [3] 扈荣良. 现代动物病毒学[M]. 北京:中国农业出版社,2014. [4] 世界动物卫生组织. 陆生动物卫生法典[S]. 第21版. 北京:中国农业出版社,2012:725-739. [5] 宁宜宝. 兽用疫苗学[M]. 北京:中国农业出版社,2008. [6] 涂宜强,简永利,白宇,等. 浙江部分地区猪瘟流行现状的调查与分析[J]. 浙江农业学报,2013,25(4): 730-732. [7] 谢娟. 猪瘟抗原抗体检测方法及其意义的研究[D]. 广西大学,2013.[8] Yin Shuang-hui,Tian Hong,Shang You-jun,etal. Discrepancy of classical swine fever virus in different tissues by one-step RT-PCR and nested RT-PCR[J]. Animal Husbandry and Feed Science,2010,2(3): 18-20. [9] 李韦伟,江红,田东升,等. ELISA 抗原检测与荧光RT-PCR快速诊断猪瘟的比较研究[J]. 西南师范大学学报:自然科学版,2014,39(11): 108-111. [10]刘志勇,韩庆安,刘乃强,等. 规模养猪场主要疫病免疫效果评估模型的建立[J]. 中国兽医杂志,2011,47(7): 88-90. [11]王娟萍, 姚敬明, 吴忻, 等. 规模化种猪场猪瘟免疫情况调研[J]. 中国畜牧兽医,2012,39(1): 184-187. (编辑:李文平) Research about Different Immunization Procedures on the Immune Effect of CSFV Live Vaccine WEI Xuan-zhi1, ZHANG Fu-hua2, WANG Xin-ping3,OUYANG Hong-sheng1,GUO Chang-ming1,3* To get better understanding of the immunization and infection status of CSFV,a total of 530 serum samples from a industrialized pig farm were collected,and ELISA method was used to detect carry out the CSFV antibody and antigen serology survey,respectively. The result showed that the positive rate of CSFV antibody after twice inoculation reached 95.0%(115/121),which was 28.9% higher than it after the first inoculation. And high uniformity was found in twice inoculation than in one inoculation. No positive serum for CSFV antigen were detected (0/530),indicating that the risk of CSFV remained low in this farm. Eighteen ambiguous samples were also analyzed,and no CSFV antigen was found by RT-PCR. The result indicated that one time of vaccination is not sufficient,and only the implementation of twice inoculation induced higher titre antibodies,which could effectively prevent and control the occurrence of swine plague. CSFV;CSFV live vaccine; CSFV antigen; CSFV antibody; immune procedure 卫选智,在读硕士,从事猪病毒与宿主相互作用研究。 郭昌明。E-mail:guochm1980@163.com 2017-01-03 A 1002-1280 (2017) 02-0007-06 S852.6513 结 果



4 小结与讨论
(1.CollegeofAnimalScience,JilinUniversity,Changchun130061,China;2.JiujiangAnimalHusbandryandVeterinaryBureau,Jiujiang,Jiangxi332000,China;3.CollegeofVeterinaryMedicine,JilinUniversity,Changchun130061,China)

