射干麻黄汤对哮喘小鼠气道重塑及Th17/CD4+CD25+Treg细胞的影响及机制研究*
隋博文王 达翟平平李明虎王 浩
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
·研究报告·
射干麻黄汤对哮喘小鼠气道重塑及Th17/CD4+CD25+Treg细胞的影响及机制研究*
隋博文1王 达2翟平平2李明虎2王 浩2
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江哈尔滨 150040)
目的 探讨射干麻黄汤干预哮喘小鼠后Th17/CD4+CD25+调节性T细胞(CD4+CD25+Treg),TGF-β1蛋白表达的变化及其与气道重塑之间的关系。方法 24只Balb/c小鼠随机分为3组,空白组(A组)、模型组(B组)、射干麻黄汤组(C组),每组8只。建立慢性哮喘小鼠模型后,分别给予不同干预方式,观察雾化8周后肺组织气道重塑程度并检测TGF-β1蛋白表达、Th17细胞及CD4+CD25+Treg细胞占CD4+T细胞百分比。结果B、C组激发8周小鼠支气管管壁厚度、平滑肌厚度均较A组厚(P<0.05),但C组较B组薄(P<0.05)。B、C组相较于A组,Th17细胞占CD4+T细胞的百分比增高,CD4+CD25+Treg细胞占CD4+T细胞的百分比降低(P<0.05);C组较B组Th17细胞占CD4+T细胞的百分比增高程度减少 (P<0.05),CD4+CD25+Treg细胞占CD4+T细胞百分比降低程度减小(P<0.05)。B组TGF-β1蛋白表达与A组比较均增加(P<0.05),而C组TGF-β1蛋白表达与A组比较差别无统计学意义(P>0.05)。C组TGF-β1蛋白表达较B组TGF-β1蛋白降低(P<0.01)。结论 射干麻黄汤可能通过抑制TGF-β1蛋白表达,减少哮喘小鼠Th17细胞数,增加CD4+CD25+Treg细胞数,进而调节Th17/CD4+CD25+Treg的免疫紊乱从而延缓气道重塑。
射干麻黄汤 哮喘小鼠 气道重塑 Thl7细胞/CD4+CD25+Treg细胞 TGF-β1
哮喘主要表现为不同程度的喘息、气急、胸闷、咳嗽等[1]。近年来随着家庭装修等过敏原越来越多,哮喘发病率越来越高,在许多地区近10~20年哮喘患病率增高了1倍[2],并且不同国家和地区间的哮喘流行差异极大。而有研究表明近10年来,我国哮喘发病率呈现逐渐上升态势[3]。哮喘是由于免疫异常所导致的一种变态反应性疾病,气道重塑是炎症反复作用的结果,是哮喘难治的根本原因[4]。Th17细胞和CD4+CD25+Treg的相互作用成为气道重塑过程研究的热点。射干麻黄汤出自《金匮要略》,是目前中医临床治疗冷哮的常用方剂,能在一定程度上抑制气道重塑[5]。本研究旨在观察射干麻黄汤干预哮喘小鼠气道重塑的变化过程中,Th17细胞和CD4+CD25+Treg细胞及TGF-β1蛋白表达变化,并进行相关性分析,研究射干麻黄汤治疗后,哮喘小鼠气道重塑变化过程中上述指标的相互关系,为揭示射干麻黄汤治疗哮喘的机制提供新的思路和方法。现报告如下。
1 材料与方法
1.1 实验动物 24只Balb/c雌性小鼠。由黑龙江中医药大学动物实验中心提供,生产许可证号:SCXK(黑)2013-004。4~6周龄,体质量(15±2)g,SPF级环境,以不含过敏原的无菌食物及专用动物饮水喂养。
1.2 药物组成 射干、麻黄、生姜、法半夏各9 g,紫菀、款冬花各6 g,五味子、细辛各3 g,大枣3枚。由黑龙江中医药大学附属第一医院制剂室提供。
1.3 主要试剂及仪器 兔抗鼠TGF-β1多克隆抗体(产品编号sc-146)购自美国Santa Cruz Biotechnology公司;二步法免疫组化检测试剂及浓缩型DAB试剂盒均购自北京中杉金桥生物技术有限公司;鸡卵清蛋白(OVA,Ⅴ级)产于美国Sigma公司;RP-MI-1640为美国 Gibco公司产品;抗小鼠单克隆抗体anti-CD4-FITC、anti-CD25-PE为美国BD/Pharmin-gen公司产品;IL-17单克隆抗体(PE标记)购自美国Biolegend公司。超声雾化吸入器BSW-2A由鞍山贝尔思科技有限公司生产;自制玻璃雾化箱:60 cm×50 cm×40 cm。Lecia DM 3000自动化正置显微镜图像采集系统德国Leica Microsystems公司提供。光学显微镜:OLYMPUS U-LBD-2,日本生产。电子天平:Bs110型,Sartorius公司产品。FC500流式细胞仪为美国Beckman公司产品。电热恒温干燥箱,201-0A,天津市泰斯特仪器有限公司生产。
1.4 造模与给药 24只Balb/c雌性小鼠按照随机数字表法随机分为3组:空白组(A组)、模型组(B组)和射干麻黄汤组(C组),每组8只。参照夏振炜的方法制备哮喘模型[6]:在实验的第0、14日,B、C组每只小鼠腹腔注射致敏混悬液0.2 mL(含20μg OVA和100 μg氢氧化铝)致敏,A组等量0.9%氯化钠注射液腹腔注射。激发:第21日开始B、C组给2.5%OVA雾化吸入激发,约30 min,隔天1次,A组予等量0.9%氯化钠注射液雾化。灌胃:C组每次雾化前给射干麻黄汤(4.1 g/mL)灌胃,A、B组等量0.9%氯化钠注射液灌胃。射干麻黄汤灌胃剂量,以患者用量为基础,根据人单位体表面积用量换算出小鼠单位体表面积用量,参照 《实验动物学》一书中“人与动物及各类动物间药物剂量的换算方法”计算。
1.5 标本采集与检测 每组在雾化8周后颈部脱臼处死,取肺组织及脾脏进行实验检测。1)小鼠支气管管壁、平滑肌厚度测量。常规石蜡包埋肺组织,HE染色制成病理切片来观察、测量支气管基底周径(Pbm)、总管壁厚度(Wat)及平滑肌厚度(Wam),以Imagepro6.0图像分析系统分析测定。2)Th17细胞/CD4+CD25+Treg细胞占CD4+T细胞的比例检测。将取下的脾脏组织入PRMI1640培养液冲洗,剪碎,研磨,过滤,加分离液,制成单核细胞悬液,流式细胞仪检测各组Th17细胞、CD4+CD25+Treg细胞占CD4+T细胞的比例。3)TGF-β1检测。以免疫组化PV二步法染色检测,肺组织切片常规脱蜡到水,PBS冲洗,微波修复,滴加一抗,PBS冲洗。滴加二抗,37℃孵育,PBS冲洗。DAB显色,蒸馏水充分冲洗,苏木素复染,脱水透明,封片,显微镜下观察。组织切片中染成棕黄色者为阳性。每张切片于200倍光镜下采集5个具有代表性的互不重叠视野,应用上述图像分析软件测量每个视野的光密度(OD),以OD数值大小反映TGF-β1相对表达的多少。
1.6 统计学处理 应用SPSS19.0统计软件处理。计量资料以(±s)表示,数据均进行正态性检验和方差齐性检验。Pearson直线相关性对双变量间进行相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠支气管管壁、平滑肌厚度比较 见表1。结果示,B、C组激发8周小鼠支气管管壁厚度、平滑肌厚度均较A组厚(P<0.05);但C组较B组薄(P<0.05)。
表1 各组小鼠支气管管壁、平滑肌厚度比较(μm,±s)
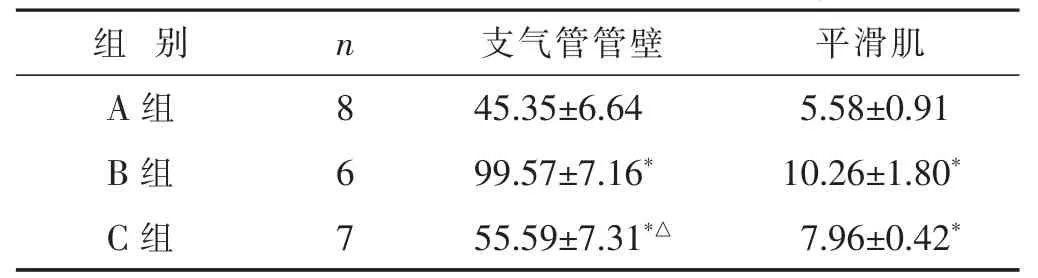
表1 各组小鼠支气管管壁、平滑肌厚度比较(μm,±s)
与A组比较,*P<0.05;与B组比较,△P<0.05。下同。
组别 n 支气管管壁 平滑肌A组 8 45.35±6.64 5.58±0.91 B组 6 99.57±7.16*10.26±1.80*C组 7 55.59±7.31*△7.96±0.42*
2.2 各组小鼠脾组织中Th17细胞/CD4+CD25+Treg占CD4+T细胞的百分比比较 见表2。结果示,B、C组相较于A组,Th17细胞占CD4+T细胞的百分比增高,CD4+CD25+Treg细胞占CD4+T细胞的百分比降低(P<0.05);C组较B组Th17细胞占CD4+T细胞的百分比增高程度减少(P<0.05);CD4+CD25+Treg细胞占CD4+T细胞百分比降低程度减小(P<0.05)。
2.3 各组小鼠肺组织中TGF-β1蛋白表达的密度值水平比较 见表3。结果示,B组TGF-β1蛋白表达与A组比较均增加 (P<0.05),C组TGF-β1蛋白表达较
表2 各组小鼠Th17细胞/CD4+CD25+Treg占CD4+T细胞百分比细胞的表达百分比比较(%,±s)

表2 各组小鼠Th17细胞/CD4+CD25+Treg占CD4+T细胞百分比细胞的表达百分比比较(%,±s)
?
表3 各组小鼠肺组织中TGF-β1蛋白表达的密度值水平比较(±s)
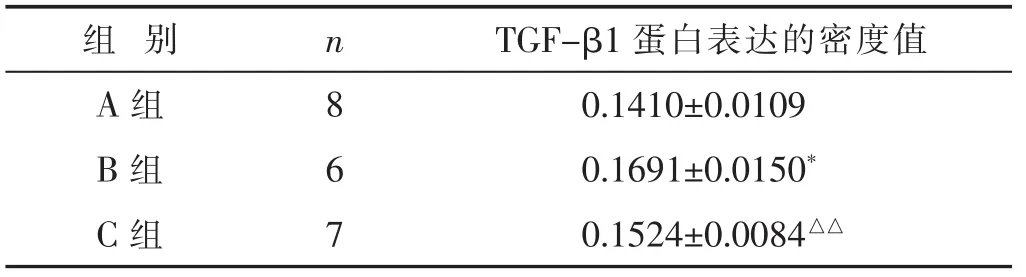
表3 各组小鼠肺组织中TGF-β1蛋白表达的密度值水平比较(±s)
B组TGF-β1降低(P<0.05)。
组别 n TGF-β1蛋白表达的密度值A组 8 0.1410±0.0109 B组 6 0.1691±0.0150*C组 7 0.1524±0.0084△△
2.4 射干麻黄汤组中各检测指标间的相关性分析
见表4,表5。结果示,组织悬液中Th17细胞数与肺组织中TGF-β1蛋白表达呈正相关,而CD4+CD25+Treg细胞数与肺组织中TGF-β1蛋白表达呈负相关。
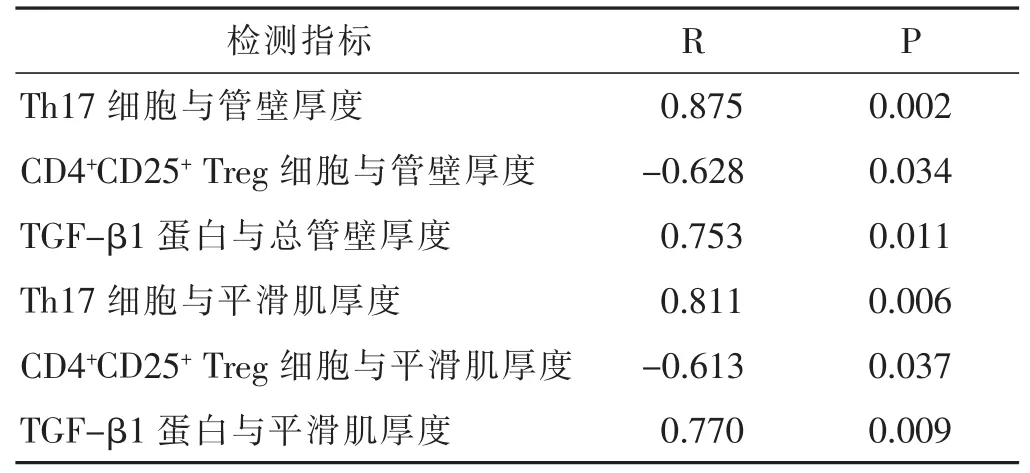
表4 Th17细胞、CD4+CD25+Treg细胞、TGF-β1蛋白表达与气道形态学改变的相关性分析
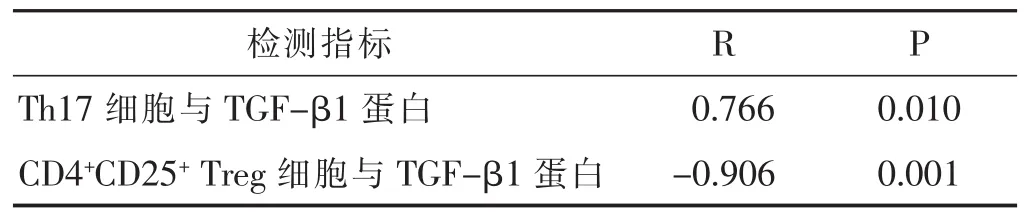
表5 Th17细胞、CD4+CD25+Treg与TGF-β1蛋白的相关性分析
3 讨 论
哮喘是一种变态反应性疾病,涉及多种炎症细胞及介质参与,其中T细胞在哮喘的炎症损伤中发挥着重要作用[7-8]。近年研究者发现Th17/CD4+CD25+Treg细胞的免疫紊乱在哮喘发生发展和疾病过程中起着重要作用,会导致气道壁增厚,上皮下纤维化等。TGF-β1蛋白是哮喘发病过程中重要细胞因子之一。研究认为TGF-β1蛋白是气道重塑的主要媒介之一,其可通过影响气道周围血管增生、上皮下纤维化等不同方式参与气道重塑的发生[9]。另有学者发现TGF-β1蛋白可直接诱导Treg细胞上Foxp3+的表达促进CD4+CD25+Treg细胞转化从而调节肺黏膜的免疫应答[10]。射干麻黄汤出自《金匮要略》,常用来治疗哮证急性发作期冷哮,临床疗效确切。有研究表明射干麻黄汤不仅能够有效缓解哮喘症状,且有减轻气道炎症,降低气道高反应性的作用[11-12]。有学者研究显示射干麻黄汤应用后可抑制炎症反应,阻止气道结构细胞增生及抑制上皮下纤维化,有效抑制气道重塑[13]。还有学者发现用射干麻黄汤干预哮喘小鼠后,其哮喘的症状有所改善,平滑肌增生面积均低于模型组[14]。以上研究结果表明射干麻黄汤确实能够改善哮喘模型小鼠气道重塑情况。张丽等研究显示在使用射干麻黄汤2周后肺组织小气道周围炎性细胞浸润较模型组减少,在使用8周后明显减少[15]。
本研究结果显示,射干麻黄汤组小鼠脾组织悬液中Th17细胞数、TGF-β1蛋白与气道管壁厚度以及气道平滑肌厚度呈正相关。CD4+CD25+Treg细胞与气道管壁厚度以及气道平滑肌厚度呈负相关。脾组织悬液中Th17细胞数与肺组织中TGF-β1蛋白表达呈正相关,而CD4+CD25+Treg细胞数与肺组织中TGF-β1蛋白表达呈负相关,提示给予射干麻黄汤干预哮喘小鼠后体内TGF-β1的变化可影响Thl7以及CD4++CD25+Treg细胞的表达变化。结果表明使用射干麻黄汤8周后哮喘小鼠气道总管壁厚度和平滑肌细胞厚度较模型组明显减轻,与之前研究结果一致,表明射干麻黄汤能够抑制哮喘小鼠气道重塑。故推测射干麻黄汤可能通过抑制TGF-β1表达来减少哮喘小鼠Th17细胞数,增加CD4+CD25+Treg细胞数,进而调节Th17/CD4+CD25+Treg的免疫紊乱从而延缓哮喘小鼠模型气道重塑。
因此,射干麻黄汤可能通过抑制TGF-β1的表达来调节Th17/CD4+CD25+Treg细胞的免疫平衡紊乱,来延缓哮喘小鼠气道重塑,但其具体作用机制错综复杂,有待进一步研究。
[1] 单世民,毛毅敏.Th17细胞在支气管哮喘小鼠发病机制中的作用研究[J].中国现代医学杂志,2015,25(25):21.
[2] 杨昆,黄绍光.支气管哮喘流行变化趋势分析[J].中华结合和呼吸杂志,2001,24(3):181-183.
[3] 杨华,赖富煌.孟鲁司特钠联合普米克在咳嗽变异性哮喘中的临床应用[J].中国现代医药杂志,2015,17(7):59.
[4] 白敏,刁晓源.支气管哮喘发病机制研究进展[J].医学综述,2009,15(15):2294-2295.
[5] 金华良,罗清莉.哮喘小鼠CD4+CD25+Foxp3+调节T细胞和Foxp3蛋白的变化及淫羊藿苷干预作用[J].中国免疫学杂志,2012,28:894-898.
[6] Xia Z.W.et al.Heme oxygenase-1-mediated CD4+CD25high regulatory T cells suppress allergic airway inflammation[J].J Immunol,177(9):5936-5945.
[7] 赵辉,张丽.射干麻黄汤加味对哮喘小鼠TGF-β1的影响[J].成都中医药大学学报,2014,37(3):26-27.
[8] 张琳,梁庆红.CD4+T细胞亚群在支气管哮喘病理机制中作用的新认识[J].中国微生态学杂志,2013,25(1):100-102.
[9] 李丽,李敏.白三烯受体拮抗剂对哮喘气道重塑及Th17细胞/CD4+CD25+调节性T细胞表达的影响[J].临床儿科杂志,2014,32(8):789-791.
[10]杨影,罗英.IL-23/Th17轴在变应性哮喘中的研究进展[J].生命科学,2011,23(3):286-289.
[11]赵欣欣,万力生.基于TGF-β1/Smads信号通路中医药防治哮喘气道重塑研究进展[J].辽宁中医药大学学报,2016,18(1):161-163.
[12]赵红,王长海.射干麻黄汤对哮喘大鼠气道炎症及外周血Th1/Th2平衡的影响[J].中国中医急症,2010,19(3):466-468.
[13]曹珲.射干麻黄汤对哮喘大鼠气道重塑及TNF-α、IL-17的影响[J].吉林中医药,2013,33(12):1258-1259.
[14]刘鑫,邹中兰.射干麻黄汤对慢性哮喘大鼠缺氧诱导因子-1α、血管内皮生长因子表达及气道重塑的影响[J].中国实验方剂学杂志,2012,18(8):190-194.
[15]张丽,刘建秋.射干麻黄汤对慢性哮喘小鼠气道重塑和TGF-β的影响[J].吉林中医药,2010,30(2):533-535.
The Research of Influence and Mechanism of Shegan Mahuang Decoction on Intervention of Th17/CD4+CD25+Treg Cell in Airway Remodeling in Asthmatic Mice
SUI Bowen,WANG Da,ZHAI Pingping,et al. The First Affiliated Hospital of Heilongjiang University of TCM,Heilongjiang,Harbin 150040,China.
Objective:To discuss protein variation of Th17 ce11s/CD4+CD25+regulatory T cells,TGF-betal and the relationship between it and airway remodeling after Shegan Mahuang decoction intervention in asthmatic mice. Methods:24 Balb/c mice were randomly divided into three groups(8 per group),the blank group(group A),asthma group(group B),and Shegan Mahuang decoction group(group C).The mice models of asthma underwent with different therapy after establishment.The airway remodeling was observed;the expression of TGF-β1 protein was measured and the percentage of Th17,CD4+CD25+regulatory T cells in CD4+T cells was detected after atomization for 8 weeks.Results:Compared with group A,the thickness of bronchial wall and smooth muscle,the number of Th17 cells and the expression of TGF-β1 protein were higher in group B and C(P<0.05),while the number of CD4+CD25+Treg cells was lower in group B and C(P<0.05).The change in group C was less than that of group B(P<0.05).The change of TGF-β1 protein was particularly significant in group B(P<0.05),but was not significant in group C(P>0.05),and lower than that of group B(P<0.01).Conclusion:Shegan Mahuang decoction can reduce the expression of TGF-β1 protein and the number of Th17 cells,increase the number of CD4+CD25+Treg cells,and improve the immunologic derangement of Th17/CD4+CD25+Treg in asthmatic mice,so it can delay the occurrence of airway remodeling.
Shegan Mahuang decoction;Asthma mice;Airway remodeling;Th17/CD4+CD25+cells regularoty T cells;TGF-β1
R285.5
A
1004-745X(2017)02-0204-04
10.3969/j.issn.1004-745X.2017.02.006
2016-10-10)
黑龙江省自然科学基金项目(H201317)

