缺血性卒中患者血清抗磷脂蛋白抗体浓度与颈动脉粥样硬化的相关性
魏守超, 刘君玲, 赵兴军, 孟 颖, 刘志辉
缺血性卒中患者血清抗磷脂蛋白抗体浓度与颈动脉粥样硬化的相关性
魏守超, 刘君玲, 赵兴军, 孟 颖, 刘志辉
目的 探究缺血性卒中患者血清抗心磷脂抗体浓度与颈动脉粥样硬化斑块及其危险因素的相关性。方法 连续纳入310例颈内动脉系统IS患者,应用血管彩色多普勒超声仪进行颈部血管超声检测,根据有无CAS斑块及颈内动脉狭窄程度将患者分为3组:其中A组(无斑块无狭窄)80例;B组(有斑块无狭窄)101例;C组(有斑块有狭窄)129例,C组中1°狭窄42例,2°狭窄36例,3°狭窄33例,4°狭窄18例。采用ELISA检测患者血清ACA浓度,同时检测常规生化指标。结果 A、B、C组患者血清ACA浓度依次为(8.21±7.86)PLU/ml、(13.57±8.04) PLU/ml、(26.54±10.35)PLU/ml;B组、C组患者血清ACA水平明显高于A组(P<0.05),C组患者血清ACA水平明显高于B组(P<0.05);血清ACA水平随CAS狭窄程度的增加而增高。Logistic回归分析显示,血清ACA是否为阳性与TG水平密切相关。结论 血清ACA参与动脉粥样硬化的形成、发展,TG是血清ACA阳性的重要危险因素,血清ACA可作为CAS的血清生化指标。
抗心磷脂蛋白抗体; 颈动脉粥样硬化; 缺血性卒中
颈动脉粥样硬化(carotid atherosclerosis,CAS)为缺血性卒中(ischemic stroke,IS)的重要原因[1,2],早期检测、诊断CAS对IS一级预防有重大意义。近年来,炎症及免疫反应在动脉硬化斑块研究中占据着独特的地位,而抗心磷脂抗体(anticardiolipin antibody,ACA)作为抗磷脂抗体中的一种,被视为连接自身免疫反应及凝血过程的关键桥梁[3]。近年来,国内外关于抗磷脂抗体参与脑血管内皮细胞损伤及IS相关性的研究正成为神经科的新热点,但鲜有血清ACA浓度与缺血性卒中患者CAS相关性研究的报道。本研究通过对310例颈内动脉系统IS患者血清ACA浓度及超声CAS检测,探讨血清ACA浓度与CAS斑块及相关危险因素之间的相关性,为早期预防和及时治疗缺血性卒中提供循证医学依据,现报道如下。
1 资料与方法
1.1 临床资料 选取2014年9月-2016年9月在潍坊医学院附属医院神经内科住院的310例颈内动脉系统缺血性卒中患者作为研究对象,所有纳入试验的患者均由神经内科医生6 h内完成个人基本信息、现病史、家族史(尤其是脑血管病史)、个人史(尤其是吸烟、饮酒史)、服药史。其中男性168例,女性142例,年龄40~86(64.23±9.37)岁。入选标准:首次发病,入选时病程24 h~72 h;符合“中国急性缺血性脑卒中诊治指南2014”诊断标准[3],并经头部MR平扫证实。排除标准:有恶性肿瘤、严重心、肝、肾功能不全等慢性病者;既往出现严重全身感染及自身免疫性疾病者;有其他脑部器质性病变者,安装心脏起搏器等金属植入物者及其他检查不合作患者。
1.2 血清ACA测定 患者于入院次晨空腹抽取2 ml肘静脉血至EDTA抗凝管中,于采血后2 h内离心,3 000 r/min离心5 min,取上清存于-20 ℃冰箱待测。所有受试标本均在采血后1 w内测定。采用ELISA定量法检测血清ACA水平,3种标准ACA浓度依次为2 PLU/ml、12 PLU/ml和120 PLU/ml,≥12 PLU/ml为阳性。以标准品浓度为横坐标,相应吸光值为纵坐标绘制标准曲线,样品的ACA含量可根据其OD值由标准曲线换算出相应浓度。选择奥地利anthos2010酶标仪进行血清ACA检测,ACA试剂盒主要由上海艾研生物技术有限公司提供。
1.3 常规生化指标检测 住院患者次日清晨空腹取肘静脉血(抽血前禁食时间不少于8 h),血样分析采用进口全自动生化仪,测定总胆固醇(total cholesterol,TC)、甘油三酯(Triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDLC)等常规生化指标。
1.4 颈动脉彩色多普勒超声检测 患者入院1~3 d内采用西门子公司西门子2000血管超声多普勒检测,检测指标:(1)颈动脉内-中膜厚度(Intima-medial thickness,IMT):颈内动脉IMT在颈总动脉分叉处1.0 cm远处测量远场血管壁的IMT厚度,取3次测量平均值;(2)斑块:颈动脉IMT不规则增厚>1.2 mm均认为有斑块形成。根据超声结果将所有入组患者分为3组:A组(无斑块且无狭窄者)、B组(有斑块但无狭窄者)、C组(斑块、狭窄均有者)。采用欧洲协作组制定标准[4]测定狭窄程度:狭窄程度(%)=1-病变部位最窄端直径/狭窄远端正常动脉管径×100%,0级:血管直径正常;1°:狭窄程度<50%; 2°:狭窄程度50%~90%;3°:狭窄程度91%~99%;4°:血管完全闭塞。

2 结 果
2.1 不同组缺血性卒中患者血清ACA浓度比较 3组IS患者血清ACA浓度(见表1),其中B组、C组血清ACA浓度明显高于A组(P<0.05);C组血清ACA浓度明显高于B组(P<0.05)。
2.2 血清ACA浓度与CAS狭窄程度的关系 在129例C组患者中,在1°~3°CAS狭窄患者血清ACA浓度(见表2),其3组浓度差异有统计学意义(P<0.05);但在3°~4°CAS狭窄患者中,血清ACA浓度无显著性差异(P>0.05)。
2.3 血清ACA阳性及各相关危险因素关系 以高血压、糖尿病、HDLC、LDLC等相关危险因素为自变量,以血清ACA是否为阳性作为因变量,依Logistic回归模型进行多因素分析,结果发现血清ACA阳性与高血压病、糖尿病、HDLC、TG、性别、年龄、饮酒无明显相关(均P>0.05),而只与HDLC相关(P<0.05)。提示TG是患者发生ACA阳性的独立危险因素(见表3)。
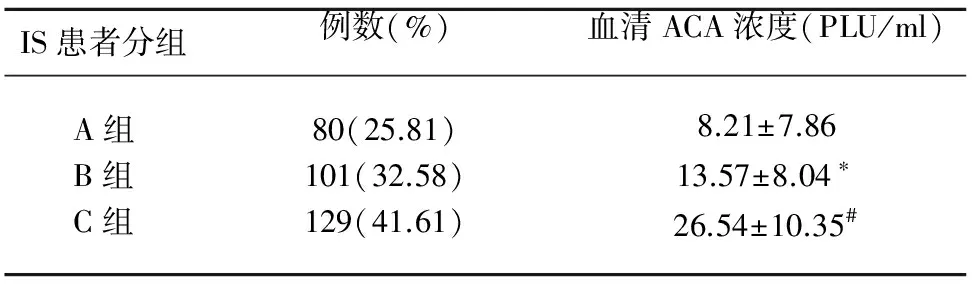
表1 不同组IS患者血清ACA浓度比较
与A组相比*P<0.05;与B组相比#P<0.05
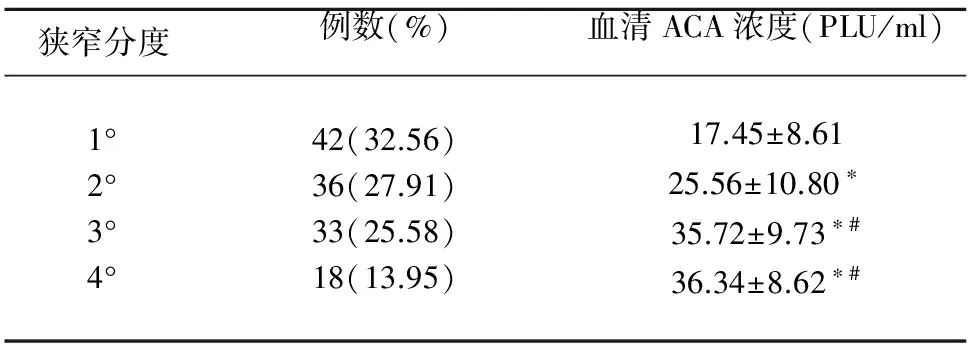
表2 不同CAS狭窄患者(C组)血清ACA浓度比较
与1°相比*P<0.05;与2°相比#P<0.05
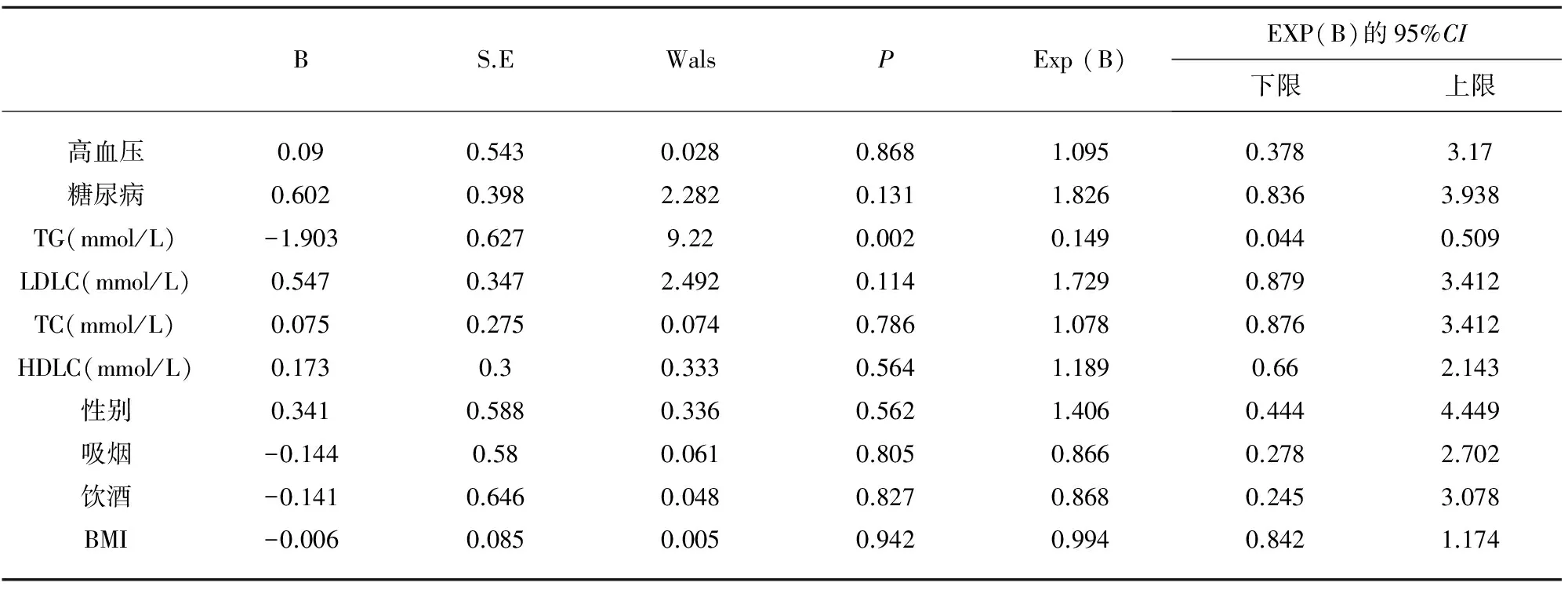
表3 血清ACA与相关危险因素的Logistic回归分析
注:B:回归系数;SE:标准误;Walds:回归系数的Wald 检验卡方值;Exp(B):优势比OR的估计值
3 讨 论
近年来,随着检验手段的进步,认为免疫、炎症反应产生的众多致病因子可参与动脉硬化过程。抗磷脂抗体在脑血管病生物标志家族中占有独特的地位,Arad A等[5]指出ACA参与血管内皮损伤,是脑血栓形成的危险因素。ACA影响动脉粥样硬化斑块形成的可能环节有[6~9]:(1)损伤内皮细胞结构致细胞防御功能减弱,诱发免疫反应的发生,继发血小板沉积;(2)ACA影响蛋白C活性,使其引发的凝血功能受阻,机体处于高凝状态,促进血栓在颈动脉形成;(3)与内皮细胞膜磷脂发生抗原-抗体反应,提高花生四烯酸水平,阻碍前列环素(PGI2)产生,加速血小板聚集;(4)激活内皮细胞,诱导产生内皮细胞E、选择素及各种黏附分子;(5)促进血小板黏附、聚集及凝血因子活化内皮细胞的损害使纤溶酶原激活物释放减少,血液纤溶活性减低,促进血栓形成。
本试验通过对A、B和C组患者血清ACA浓度检测发现,血清ACA浓度在C组中最高,B组次之,而在A组中浓度最低。进一步将C组患者按照程度分度,不难发现在1°~3°CAS狭窄患者血清ACA浓度随着狭窄程度的增加而升高,提示ACA参与了CAS的形成、发展过程。但在中3°、4°CAS狭窄患者中,血清ACA浓度并无显著性差异,尚不能认为在CAS管腔狭窄>91%时,血清ACA浓度对CAS狭窄程度有进一步的影响,但限于1°、2°CAS狭窄患者样本量较小,统计学偏倚不可避免,尚需扩大样本。高血压、糖尿病、高脂血症作为动脉粥样硬化形成的传统危险因素[10~12],对IS发生发展、转归、预后具有不可估量的作用,本文采用多元逐步回归分析发现,仅可将TG视为ACA阳性独立危险因素。由于相关性研究国内外鲜有报道,需广泛的基础和临床研究进一步探索。抗磷脂抗体综合征(antiphospholipid syndrome,APS)是一种非炎症性自身免疫性血栓性疾病,临床上以反复发作性动脉、静脉血栓形成、习惯性流产等为主要表现[13],其中,动脉血栓形成为其基本病理表现之一[14],抗磷脂抗体的不同亚群针对以ACA为代表的抗原以免疫-炎症反应形式参与动脉硬化形成及进展,可继发神经系统功能障碍[15,16]。近年研究已经检测到人和动物动脉硬化斑块处存在抗磷脂抗体[13,17],进一步对部分无明显自身免疫性疾病背景的患者进行研究,结果显示抗磷脂抗体阳性有可能导致动脉粥样硬化的亚临床状态[18]。而屈继波等[19]临床试验更是表明ACA阳性患者颈动脉颅外段狭窄程度和狭窄率高于阴性对照组,且ACA阳性组和ANCA阳性组左、右两侧IMT均大于阴性对照组,提示ACA可以影响血管狭窄程度。综上可以推断,在部分无明显高危因素的IS患者中,血清ACA检测是提前预防及明确病因的方法之一。国内外关于血清ACA参与动脉粥样硬化病理过程的确切机制研究相对较少,但就当前来看,以ACA为代表的抗磷脂抗体亚群参与了其发生发展的多个环节。重视监测血清ACA浓度变化,不仅能为动脉粥样硬化提供辅助诊断依据,对做好IS的一级预防有积极意义,同时以定性向定量的研究模式转换,也符合精准医学的国际趋势[20]。
[1]Manas G,Kaushik G,Atri C,et al.Correlation of intracranial atherosclerosis with carotid stenosis in ischemic stroke patients[J].Ann Indian Acad Neurol,2015,18(4):412-414.
[2]Devreese KM,Van Hoecke F.Anticardiolipin and anti-2glycoprotein-I antibody cut-off values in the diagnosis of antiphospholipid syndrome:more than calculating the in-house 99th percentiles,even for new automated assays[J].Thrombosis Res,2011,128(6):598-600.
[3]中华医学会神经病学分会.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[4]Christos D,Liapis Sir Peter F,Bell Dimitri P,et al.欧洲血管外科学会指南:第二部分-颈动脉狭窄患者的诊断和检查[J].国际脑血管病杂志,2011,19(7):488-497.
[5]Arad A,Proulle V,Furie RA,et al.β2-Glycoprotein-1 autoantibodies from patients with antiphospholipid syndrome are suffiISent to potentiate arterial thrombus formation in a mouse model.[J].Blood,2011,117(12):3453-3459.
[6]吴坚洪,许献文,黄敦燕,等.脑卒中患者同型半胱氨酸、抗心磷脂抗体的检测及探讨[J].吉林医学,2014,35(9):1804-1805.
[7]马 静.抗心磷脂抗体和同型半胱氨酸在脑梗塞检测的意义[J].现代预防医学,2012,39(1):143-144.
[8]孙继红,张 艳,张洵岳,等. 脑梗死患者与血清抗心磷脂抗体及β2糖蛋白Ⅰ抗体的关系研究[J].检验医学与临床,2016,13(8):1100-1101.
[9]Giannakopoulos B,Passam F,Rahgozar S,et al.Current concepts on the pathogenesis of the antiphospholipid syndrome[J].Blood,2007,109(2):422-430.
[10]Erkan D,Salmon JE.The role of complement inhibition in thrombotic angiopathies and antiphospholipid syndrome[J].Turkish Journal of Haematology Official Journal of Turkish Society of Haematology,2016,33(1):1-7.
[11]尚广芹,王志宏,姜积军.颈动脉重度狭窄或闭塞导致脑梗死发病机制的研究[J].中风与神经疾病杂志,2016,33(2):128-130.
[12]李长青,贾海玉,张 勇,等.老年人餐后高血糖与颈动脉粥样硬化的相关性[J].中国老年学杂志,2016,36(3):579-580.
[13]Meroni PL,Chighizola CB,Rovelli F,et al.Antiphospholipid syndrome in 2014:more clinical manifestations,novel pathogenic players and emerging biomarkers[J].Arth Res Therapy,2014,16(2):1-14.
[14]Harper BE,Wills R,Pierangeli SS.Pathophysiological mechanisms in antiphospholipid syndrome[J].Inter J Clinic Rheumatol,2016,6(2):157-171.
[15]Matsumoto T,Miki T,Sugimoto T,et al.A new active vitamin D analog,ED-71,increases bone mass with preferential effects on bone in osteoporotic patients[J].Cardiovasc Hematologic Dis Drug Target,2010,10(1):33-52.
[16]Ferreira I,Neves M,Alves JD,et al.Atherosclerosis risk in antiphospholipid syndrome[J].Inter J Clinic Rheumatol,2016,6(5):583-593.
[17]Tripodi A,Groot PGD,Pengo V.Antiphospholipid syndrome:laboratory detection,mechanisms of action and treatment[J].J Inter Med,2011,270(2):110-122.
[18]孙 杨,刘志辉,汪明玉,等.脑梗死患者血清抗β2-糖蛋白1抗体水平变化与颈动脉粥样硬化的相关性[J].中国动脉硬化杂志,2014,22(2):155-158.
[19]屈继波,王文敏.缺血性卒中患者抗心磷脂抗体、抗中性粒细胞胞浆抗体与IMT及颈动脉狭窄的相关性[J].中国动脉硬化杂志,2012,20(4):356-360.
[20]任思冲,周海琴,彭 萍.大数据挖掘促进精准医学发展[J].国际检验医学杂志,2015,36(23):3499-3501.
The relationship between serum level of anticardiolipin antibody and carotid atheroscleros IS in patients with acute cerebral infarction
WEIShouchao,LIUJunling,ZHAOXingjun,etal.
(DepartmentofNeurology,WeifangMedicalUniversity,Weifang261531,China)
Objective To investigate the relationship between serum levels of anticardiolipin antibody (ACA) and carotid atherosclerosis (CAS) and its risk factors in patients with acute cerebral infarction (IS).Methods A total of 310 IS patients of internal carotid artery system were recruited and carotid arteries were measured by vascular doppler ultrasound instrument.According to the presence of carotid atherosclerotic plaque and the degree of carotid stenosis,the patients were divided into three groups: group A (no plaque and stenosis) with 80 cases,group B (plaque but having no stenosis) with 101 cases,group C (plaque and stenosis) with 129 cases.Among the 129 patients of group C,case number of 1,2,3 and 4 grade of carotid stenos IS was 42,36,33 and 18 respectively.The serum levels of ACA were measured by ELISA and the routine biochemical indicators were detected at the same time.Results The serum level of ACA in patients of groups A,B,C was (8.21±7.86) PLU/ml,(13.57±8.04) PLU/ml,(26.54±10.35) PLU/ml respectively.Serum level of ACA between patients of group B and C was significantly higher than group A (P<0.05) and serum level of ACA was the highest in patients of group C.As carotid atherosclerosis stenosis progressed,serum level of ACA antibody increased.Serum level of ACA antibody was positively associated with Triglyceride (TG).Conclusion Serum levels of ACA antibody play a role in the occurrence and development of carotid stenosis and TG was the independent risk factor of increased serum levels of ACA.Serum ACA may be used as one of the serum biochemical indexes of carotid artery atherosclerosis.
Serum anticardiolipin antibody; Carotid atherosclerosis; Ischemic stroke
2016-10-12;
2016-11-29
山东省自然科学基金(联合专项,No.ZR2015HL042);潍坊市科技技术发展计划项目(No.2015WS050);潍坊市卫生局科技项目(No.2014039)
(潍坊医学院神经病学教研室,山东 潍坊 261031)
刘志辉,E-mail:lzhh1956@126.com
1003-2754(2017)02-0108-04
R743.3
A

