雷替曲塞联合奥沙利铂治疗晚期结直肠癌的疗效及对肿瘤坏死因子-α、白细胞介素-2的影响
岳 顺, 冯 永, 张大红, 周磊磊, 范瑞华
(江苏省淮安市第一人民医院 肿瘤内科, 江苏 淮安, 223300)
雷替曲塞联合奥沙利铂治疗晚期结直肠癌的疗效及对肿瘤坏死因子-α、白细胞介素-2的影响
岳 顺, 冯 永, 张大红, 周磊磊, 范瑞华
(江苏省淮安市第一人民医院 肿瘤内科, 江苏 淮安, 223300)
目的 探讨雷替曲塞联合奥沙利铂治疗晚期结直肠癌(CRC)的疗效及对肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)的影响。方法 选取晚期CRC患者69例为研究对象,随机分为治疗组35例和对照组34例,治疗组给予雷替曲塞联合奥沙利铂治疗,对照组给予卡培他滨联合奥沙利铂治疗,比较2组近远期疗效及治疗前和治疗3周期后TNF-α、IL-2水平,并记录治疗期间毒副反应的发生情况。结果 治疗组有效率、疾病控制率均略高于对照组(P>0.05); 2组疾病进展时间(TTP)、中位生存期(OS)比较无显著差异(P>0.05); 治疗3周期后, 2组TNF-α、IL-2水平均较治疗前明显升高(P<0.01), 且治疗组升高幅度更为显著(P<0.01); 治疗组腹泻、恶心呕吐、中性粒细胞减少发生率显著低于对照组,转氨酶升高显著高于对照组(P<0.05)。结论 雷替曲塞联合奥沙利铂与卡培他滨联合奥沙利铂治疗晚期CRC疗效相近,但雷替曲塞联合奥沙利铂毒副反应轻微。
雷替曲塞; 奥沙利铂; 结直肠癌; 肿瘤坏死因子-α; 白细胞介素
直肠癌(CRC)是临床常见的消化道恶性肿瘤,在中国肿瘤谱中居第4位,仅次于肺癌、胃癌和肝癌[1]。外科手术是CRC最主要的治疗手段,但因多数患者就诊时已属晚期,无法采取手术进行治疗。目前,临床上对于晚期CRC的治疗主要采用化疗手段。作为细胞毒抗癌药物,雷替曲塞通过抑制胸腺嘧啶合成酶而发挥作用,对于晚期CRC的治疗具有较好疗效,目前已有16个国家将其作为晚期CRC一线用药[2-3]。奥沙利铂是治疗CRC公认的有效药物,常与其他药物组成联合化疗方案治疗晚期CRC[4]。近年来,在一线治疗晚期CRC试验中雷替曲塞联合奥沙利铂取得了令人满意的效果。本研究分析了雷替曲塞联合奥沙利铂治疗晚期CRC的疗效、毒副反应,以及对肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2011年3月—2014年3月本院肿瘤科收治的晚期CRC患者69例为研究对象,均伴有远处转移,但拒绝外科手术治疗。纳入标准: ① 经病理组织学或细胞学检查确诊,显示有客观可测量病灶; ② 预计生存期≥3个月; ③ Karnofsky功能状态(KPS)评分≥60分; ④ 心电图、肝肾功能、外周血象等检查均无化疗禁忌; ⑤ 签署知情同意书。排除标准: ① 合并心肝肾等重要器官功能障碍; ② 有严重未控制的内科疾病或急性感染; ③ 有长期慢性腹泻史或肠梗阻史; ④ 妊娠或哺乳期妇女。将患者随机分为治疗组35例和对照组34例,治疗组男19例,女16例; 平均年龄(65.8±7.9)岁; KPS评分(71.2±7.8)分; 结肠癌15例,直肠癌20例。对照组男17例,女17例; 平均年龄(66.4±8.1)岁; KPS评分(70.7±8.3)分; 结肠癌16例,直肠癌18例。2组一般资料比较无显著差异(P>0.05), 具有可比性。
1.2 方法
治疗组:第1天,静脉滴注雷替曲塞3 mg/m2; 第1天,奥沙利铂静脉滴注130 mg/m2。对照组:第 1~14天,卡培他滨口服1 000 mg/m2, 2次/d; 第1天,静脉滴注奥沙利铂130 mg/m2。21 d为1个周期,每3个周期评估疗效,直至疾病进展(PD)或出现不可耐受的毒副反应。治疗期间,积极给予护肝和防吐处理。治疗后,每2个月随访1次,详细记录2组疾病进展时间(TTP)及总生存时间(OS)。治疗前及治疗3周期后,分别采集2组空腹静脉血5 mL, 离心分离,取上清,置冰箱保存待测。采用化学发光免疫分析法(CLIA)检测TNF-α水平,酶联免疫吸附法(ELISA)检测IL-2水平,相关操作严格按照试剂盒说明书进行。
1.3 观察指标
比较2组近远期疗效及治疗前和治疗3周期后TNF-α、IL-2水平,记录治疗期间毒副反应的发生情况。
1.4 判定标准
根据实体瘤疗效评价标准(RECIST), 分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和PD。以(CR+PR)计算有效率(RR), (CR+PR+SD)计算疾病控制率(DCR)。
1.5 统计学方法
采用SPSS 15.0统计学软件,计量资料以均数±标准差表示,采用t检验; 计数资料用率表示,采用卡方检验,生存分析用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效比较
治疗组CR 4例, PR 13例, SD 10例, PD 8例, RR为48.57%(17/35), DCR为77.14%(27/35); 对照组CR 3例, PR 10例, SD 9例, PD 12例, RR为38.24%(13/34), DCR为64.71%(22/34)。治疗组RR、DCR均略高于对照组,但差异无统计学意义(P>0.05)。
2.2 远期疗效比较
治疗组TTP为(6.8±2.1)个月,中位OS为13.0个月, 95% CI: 9.14~16.86个月; 对照组TTP为(6.2±2.4)个月,中位OS为12.0个月, 95% CI: 9.38~14.62个月, 2组TTP、OS比较差异无统计学意义(P>0.05)。
2.3 2组治疗前及治疗3周期后TNF-α、IL-2水平比较
治疗前, 2组TNF-α、IL-2水平比较无显著差异(P>0.05)。治疗3周期后, 2组TNF-α、IL-2水平均较治疗前显著升高(P<0.01), 且治疗组升高幅度更为显著(P<0.01)。见表1。
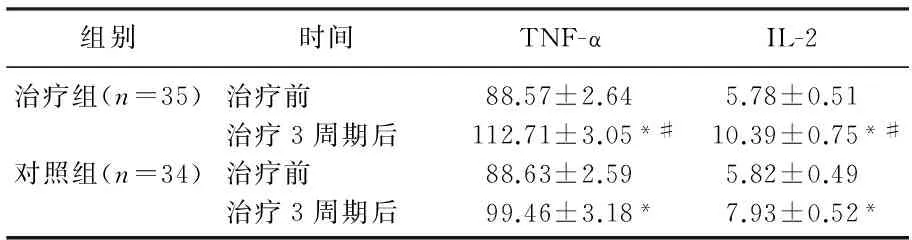
组别时间TNF-αIL-2治疗组(n=35)治疗前88.57±2.645.78±0.51治疗3周期后112.71±3.05*#10.39±0.75*#对照组(n=34)治疗前88.63±2.595.82±0.49治疗3周期后99.46±3.18*7.93±0.52*
与本组治疗前比较, *P<0.01;
与治疗3周期后对照组比较, #P<0.01。
2.4 2组毒副反应比较
治疗组腹泻、恶心呕吐、中性粒细胞减少发生率显著低于对照组,转氨酶升高显著高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组毒副反应比较[n(%)]
与对照组比较, *P<0.05。
3 讨 论
近年来, CRC的发病率及病死率均呈明显升高趋势。早期CRC主要采用以手术切除为主的综合性治疗手段,但因临床症状及体征不典型,导致患者就诊时多处晚期阶段。化疗为晚期CRC的主要治疗手段,与最佳支持治疗相比,化疗能明显延长患者生存期,提高生存质量[5]。目前,晚期大肠癌的治疗多采用5-Fu或其类似物为基础化疗方案,但因5-Fu常需持续静脉滴注,给临床应用带来一定不便。
卡培他滨是一种5-Fu前体药物,可抑制细胞分裂,干扰RNA和蛋白质合成; 通过口服可被肠道黏膜组织吸收,且经相关酶蛋白分子生理代谢后激活活化为5-Fu, 从而发挥抗肿瘤功效[6]。但此药治疗时间较长,口腔黏膜炎、恶心呕吐等毒副反应发生率较高,严重影响患者生存质量[7]。作为新型胸苷酸合成酶抑制剂,雷替曲塞可抑制肿瘤细胞DNA合成,具有较强的抗肿瘤活性。药理研究[8-9]发现,雷替曲塞可有效抑制LA1210细胞及HCT28结肠癌细胞的生长速度。在缓解晚期CRC患者病情方面,雷替曲塞与氟尿嘧啶+甲酰四氢叶酸的药理作用较为相似。奥沙利铂属于第3代铂类化合物,可抑制肿瘤细胞DNA的复制与合成,且肾脏毒性和骨髓毒性均较低,是治疗CRC的公认有效药物[10]。多项Ⅱ期临床试验[11-13]显示,雷替曲塞联合奥沙利铂化疗方案治疗晚期CRC的RR为16.0%~54.0%, 中位无进展生存期为4.0~10.3个月,中位OS为9.0~14.8个月。本研究结果显示,治疗组RR为48.57%, 与Gravalos等[13]研究结果相似,略高于对照组的38.24%, 但差异无统计学意义。2组TTP、OS比较无显著差异,表明雷替曲塞联合奥沙利铂与卡培他滨联合奥沙利铂治疗晚期CRC疗效相近。在毒副反应方面,治疗组腹泻、恶心呕吐、中性粒细胞减少发生率显著低于对照组,转氨酶升高显著高于对照组,但经及时护肝降酶治疗后,治疗组肝功能异常患者的转氨酶水平可逐渐恢复正常,不影响药物的继续使用。转氨酶升高通常与疾病无关,多是无症状、可逆的。以上结果提示治疗组的毒副反应轻微,特别是神经毒性反应,患者均可耐受。
TNF-α是一种内源性细胞因子,可促进细胞的生长与分化,且与机体炎症免疫反应密切相关,其不仅是机体免疫保护的重要介质,又参与机体的免疫病理损伤过程[14]。作为免疫调节因子, IL-2可促进T细胞增殖,增强自然杀伤细胞活性及其杀伤作用。研究[15]发现,晚期CRC患者血清IL-2水平明显降低,考虑与此类患者细胞免疫功能受抑有关。本研究结果显示, 2组治疗前TNF-α、IL-2水平比较无显著差异。治疗3周期后, 2组TNF-α、IL-2水平均较治疗前明显升高,且治疗组升高幅度更为显著,说明经治疗后,2种化疗方案均能促进TNF-α、IL-2的合成与分泌,但雷替曲塞联合奥沙利铂在促进TNF-α、IL-2合成与分泌方面效果更佳。
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] 王佳蕾, 李进, 秦叔逵, 等. 雷替曲塞或氟尿嘧啶/亚叶酸钙联合奥沙利铂治疗局部晚期或复发转移性结直肠癌的随机对照多中心Ⅲ期临床试验[J]. 临床肿瘤学杂志, 2012, 17(1): 6-11.
[3] Barni S, Ghidini A, Coinu A, et al. A systematic review of raltitrexed-based first-line chemotherapy in advanced colorectal cancer[J]. Anticancer Drugs, 2014, 25(10): 1122-1128.
[4] Kitao H, Kiyonari S, Iimori M, et al. The molecular aspect of the antitumor effect of oxaliplatin in combination with 5-FU[J]. Gan To Kagaku Ryoho, 2016, 43(6): 707-714.
[5] Caballero-Baos M, Benitez-Ribas D, Tabera J, et al. Phase II randomised trial of autologous tumour lysate dendritic cell plus best supportive care compared with best supportive care in pre-treated advanced colorectal cancer patients[J]. Eur J Cancer, 2016, 64: 167-174.
[6] Pilanci K N, Saglam S, Okyar A, et al. Chronomodulated oxaliplatin plus Capecitabine (XELOX) as a first line chemotherapy in metastatic colorectal cancer: A Phase Ⅱ Brunch regimen study[J]. Cancer Chemother Pharmacol, 2016, 78(1): 143-150.
[7] Kwakman J J, Punt C J. Oral drugs in the treatment of metastatic colorectal cancer[J]. Expert Opin Pharmacother, 2016, 17(10): 1351-1361.
[8] 谢达成, 李宁, 王静珏, 等. 雷替曲塞联合伊立替康2周方案对比FOLFIRI方案二线治疗晚期结直肠癌的疗效观察[J]. 临床肿瘤学杂志, 2013, 18(2): 140-143.
[9] Avallone A, Di Gennaro E, Silvestro L, et al. Targeting thymidylate synthase in colorectal cancer: critical re-evaluation and emerging therapeutic role of raltitrexed[J]. Expert Opin Drug Saf, 2014, 13(1): 113-129.
[10] Petrelli F, Coinu A, Ghilardi M, et al. Efficacy of oxaliplatin-based chemotherapy + bevacizumab as first-line treatment for advanced colorectal cancer: a systematic review and pooled analysis of published trials[J]. Am J Clin Oncol, 2015, 38(2): 227-333.
[11] Santini D, Massacesi C, D′Angelillo R M, et al. Raltitrexed plus weekly oxaliplatin as first-line chemotherapy in metastatic colorectal cancer: a multicenter non-randomized phase Ⅱ study[J]. Med Oncol, 2004, 21(1): 59-66.
[12] Feliu J, Castaón C, Salud A, et al. Phase ⅡI randomised trial of raltitrexed-oxaliplatin vs raltitrexed-irinotecan as first-line treatment in advancedcolorectal cancer[J]. Br J Cancer, 2005, 93(11): 1230-1235.
[13] Gravalos C, Salut A, García-Girón C, et al. A randomized phase Ⅱ study to compare oxaliplatin plus 5-fluorouracil and leucovorin (FOLFOX4) versusoxaliplatin plus raltitrexed (TOMOX) as first-line chemotherapy for advanced colorectal cancer[J]. Clin Transl Oncol, 2012, 14(8): 606-612.
[14] 黄雪松, 吕荼, 张兆毅. TNF-α对外周神经损伤继发病理性疼痛的影响[J]. 中国实用神经疾病杂志, 2015, 5: 101-102.
[15] Matikas A, Asimakopoulou N, Georgoulias V, et al. The place of targeted agents in the treatment of elderly patients with metastatic colorectal cancer[J]. Cancers (Basel), 2015, 7(1): 439-449.
Clinical efficacy of raltitrexed combined with oxaliplatin in treatment of patients with advanced colorectal cancer and its influence on tumor necrosis factor-α and interleukin-2
YUE Shun, FENG Yong, ZHANG Dahong, ZHOU Leilei, FAN Ruihua
(DepartmentofOncology,Huai′anFirstPeople′sHospital,Huai′an,Jiangsu, 223300)
Objective To explore the clinical efficacy of raltitrexed combined with oxaliplatin in the treatment of patients with advanced colorectal cancer (CRC) and its influence on tumor necrosis factor-α (TNF-α) and interleukin-2 (IL-2). Methods A total of 69 patients with advanced CRC were selected and randomly divided into treatment group (n=35) and control group (n=34). Treatment group was treated with raltitrexed combined with oxaliplatin, while control group was treated with capecitabine combined with oxaliplatin. Short- and long-term clinical efficacy as well as the changes of levels of TNF-α and IL-2 before and 3 weeks after treatment were compared, and the occurrence rates of toxic and adverse reactions were recorded during treatment. Results Treatment group was slightly higher than control group in clinical efficacy and disease control rate (P>0.05), and there was also no significant difference between two groups in time to progression (TTP) and median overall survival time (OS) (P>0.05). After treatment for 3 weeks, levels of TNF-α and IL-2 increased in both groups (P<0.01), which increased more significantly in treatment group than control group (P<0.01). Treatment group was significantly lower in the rates of diarrhea, nausea and vomiting, and neutropenia, bur was prominently higher in the increase of transaminase than control group (P<0.05). Conclusion Raltitrexed combined with oxaliplatin has similar clinical efficacy to capecitabine combined with oxaliplatin in the treatment of advanced CRC,but the former is mild in toxic and adverse reactions.
raltitrexed; oxaliplatin; colorectal cancer; tumor necrosis factor-α; interleukin-2
2016-12-02
范瑞华
R 735.3
A
1672-2353(2017)03-045-03
10.7619/jcmp.201703014

