Rh-(R,R)-Ph-BPE催化苯乙烯不对称氢甲酰化反应研究*
李星星,张一炯,吕志果,郭振美
(青岛科技大学 化工学院,山东 青岛 266042)

1 实验部分
1.1 试剂与仪器
苯乙烯:分析纯,天津市凯信化学工业公司;Rh(acac)(CO)2:质量分数99%,北京博信达科技有限公司;(-)-1,2-双((2R,5R)-2,5-二苯基磷)乙烷[(R,R)-Ph-BPE]:质量分数95%,美国Strem Chemicals公司;合成气CO/H2[V(CO)∶V(H2)=1∶1]:青岛合力气体有限公司;石油醚:沸点60~90 ℃,国药集团化学试剂有限公司;乙酸乙酯、四氢呋喃:分析纯,天津市广成化学试剂有限公司;甲苯、丙酮:分析纯,烟台三和化学试剂有限公司;1,4-二氧六环:分析纯、对苯二酚:质量分数98%,天津市博迪化工有限公司;二氯甲烷:分析纯,天津科密欧化学试剂有限公司。
数字自动旋光仪:WZZ-2S,上海申光仪器仪表有限公司;气相色谱仪:GC-7806,淄博赛科实验仪器有限公司;薄层层析硅胶板:HSGF245,青岛海洋化工有限公司;柱层析硅胶:45~75 μm,烟台江友硅胶开发有限公司。
1.2 不对称氢甲酰化反应方程式
准确称量一定量的Rh(acac)(CO)2、(R,R)-Ph-BPE、对苯二酚、苯乙烯与溶剂一起置于100 mL不锈钢高压反应釜中,放入转子封釜后,采用CO/H2进行气体置换以排净釜内空气,充压至所
需压力。设置所需反应温度,调整一定转速进行反应。反应结束后,冰浴冷却并卸压,旋蒸得粗产品,采用薄层色谱(TLC)分析[V(石油醚)∶V(乙酸乙酯)=15∶1],初步判断2-苯基丙醛,采用柱层析分析[V(石油醚)∶V(乙酸乙酯)=100∶1]得纯2-苯基丙醛进行核磁定性分析。定性分析以后可以直接进行GC分析,测定异构产物与正构产物物质的量比(以下称异正比)和ee值。苯乙烯不对称氢甲酰化反应方程式和Rh-(R,R)-Ph-BPE手性双膦配体结构式见图1。

图1 苯乙烯不对称氢甲酰化反应方程式和Rh-(R,R)-Ph-BPE手性双膦配体结构式
1.3 催化反应产物的定性和定量分析以及ee值的测定
定性分析:产物NMR谱测定结果见图2。
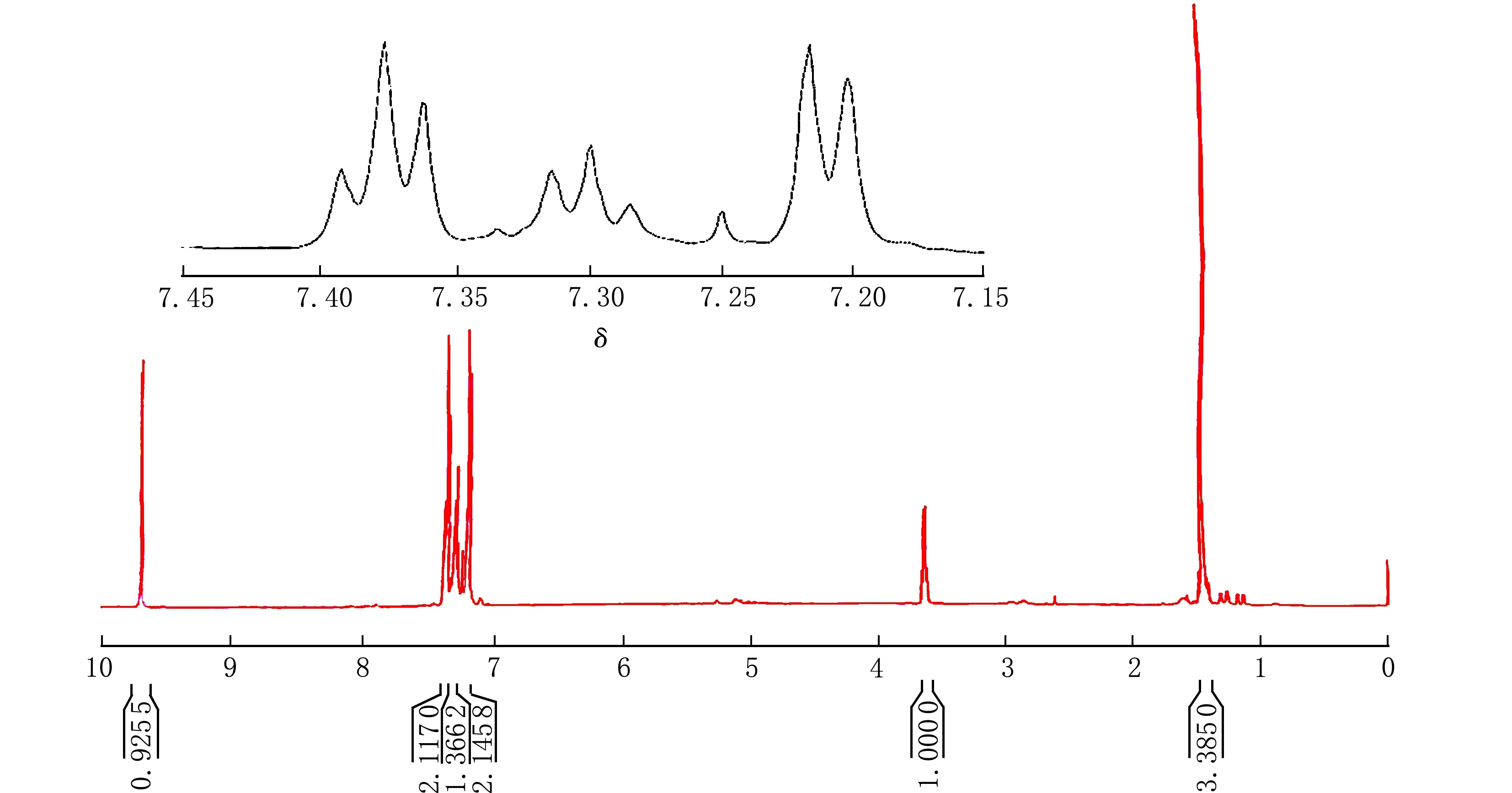
δ图2 2-苯基丙醛的核磁氢谱图
1H NMR(CDCl3,500MHZ):1.40~1.48(m,3H,CH3);3.60~3.65(m,1H,CH);7.18~7.21(d,2H,CHarom);7.28~7.31(m,1H,CHarom);7.36~7.39(m,2H,CHarom);9.68(s,1H,CHO)。
定量分析:对产物进行GC分析,手性色谱柱为β-Dexw225(30 m×0.25 mm×0.25 μm),进样器483 K,检测器513 K,程序升温:初始温度333 K,初始时间2 min,升温速率8 K/min,终止温度453 K,终止时间 5 min。
从表4可以看出,非常喜欢和喜欢学习汉语的学生占88.33%;有89.44%的学生觉得汉语非常有意思和有意思;91.67%的学生认为自己的汉语水平进步很大或有进步。可见,学生学习汉语的态度是积极的,效果也非常明显。
2 结果与讨论
2.1 反应条件考察
2.1.1 反应温度对反应结果的影响
以甲苯为溶剂,苯乙烯1.0 g(9.6 mmol),Rh(acac)(CO)21.68 mg(0.006 4 mmol ),n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶1 500;(R,R)-Ph-BPE 19.45 mg(0.038 4 mmol),n[(R,R)-Ph-BPE)]∶n[Rh(acac)(CO)2]=3;对苯二酚 5 mg,合成气3 MPa;反应时间3 h,考察反应温度对反应的影响,结果见表1。

表1 反应温度对苯乙烯不对称氢甲酰化的影响
由表1可见,在60~80 ℃内温度升高对于收率的影响不是很大,但异正比随着温度的升高明显减小,温度过高不利于异构体的生成,ee值随着温度升高而降低,是因为反应温度升高会使部分产品消旋化。综合考虑醛收率和ee值,60 ℃为最佳反应温度。
2.1.2 反应压力对反应结果的影响
反应温度设置60 ℃,n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶1 500,n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=3,对苯二酚5 mg,反应时间3 h,考察反应压力对反应的影响,结果见表2。
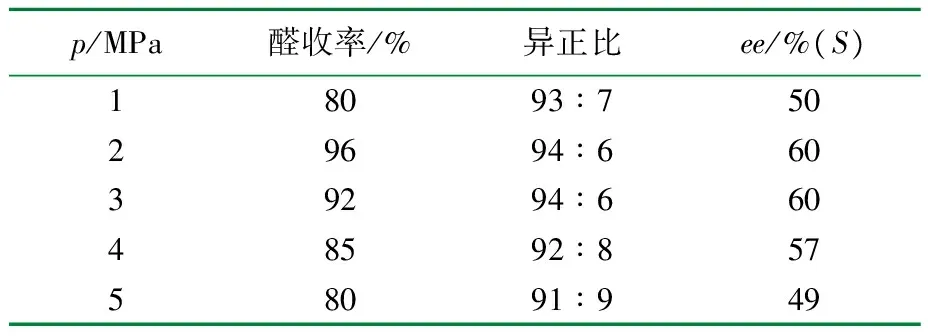
表2 合成气压力对苯乙烯不对称氢甲酰化的影响
由表2可见,随着反应压力的升高,醛的收率先提高再降低,异正比先增大再减小,光学收率也是先增大再减小。反应压力在一定范围内增大有利于合成气(CO/H2)的插入,提高反应速率,有利于克服配体的空间立体障碍,反应压力过高,则会产生较多乙苯等副产物[12]。最佳反应压力为2 MPa。
2.1.3 反应时间对反应结果的影响
反应温度为60 ℃,压力为2 MPa,n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶1 500,n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=3,对苯二酚5 mg,考察反应时间对反应的影响,结果见表3。
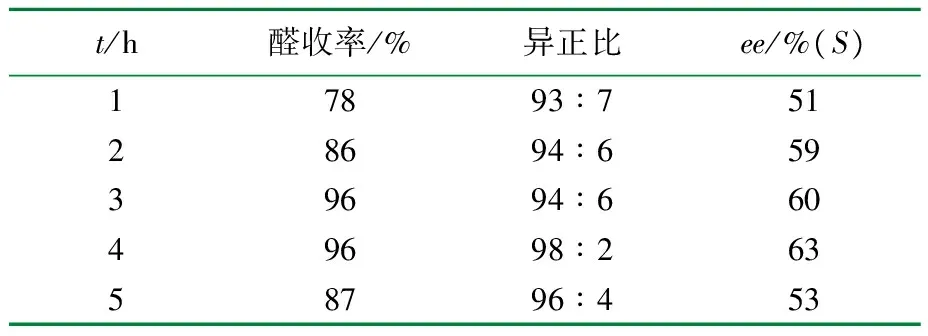
表3 反应时间对苯乙烯不对称氢甲酰化的影响
由表3可见,反应时间1~4 h内随反应时间的增加,醛收率、异正比、ee值逐渐提高,4 h以后开始下降。3~4 h时合成气吸收平衡,达到较高的收率和立体选择性,若延长时间则会破坏平衡,产品也会消旋化。因此最佳反应时间为4 h。
2.1.4 催化剂用量对反应结果的影响
反应温度为60 ℃,反应压力为2 MPa,n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=3,对苯二酚5 mg,反应时间4 h,考察催化剂用量对反应的影响,结果见表4。
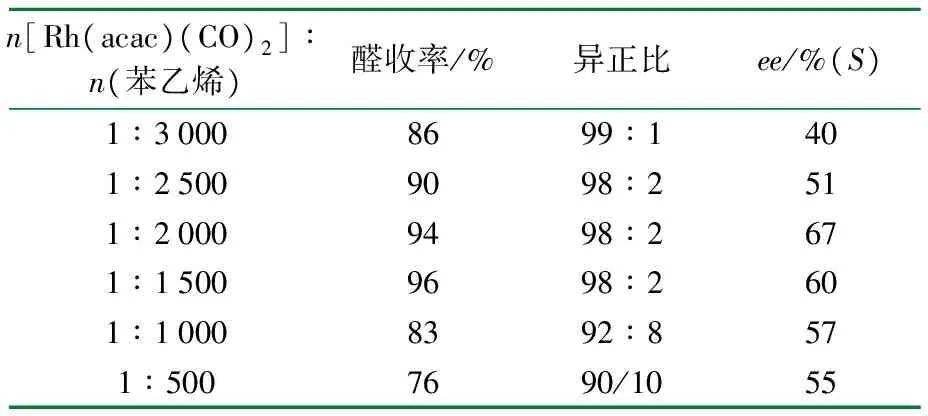
表4 催化剂用量对苯乙烯不对称氢甲酰化的影响
由表4可见,随着Rh用量的增多,醛收率先增大再减小,异正比减小,光学收率先增大后减小。这是由于在一定范围内铑的量增多会使H2加氢步骤加快,从而使催化不对称氢甲酰化循环中最后一步还原消除反应加快,导致产生较多的醛,异正比减小。在n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶2 000时,虽然醛收率比n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶1 500时低一点但是ee值较高,所以最佳催化剂用量应选择n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶2 000。
2.1.5 手性配体用量对反应结果的影响
反应温度为60 ℃,压力为2 MPa,n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶2 000,反应时间4 h,对苯二酚5 mg,考察手性配体用量对反应的影响,结果见表5。

表5 手性配体用量对苯乙烯不对称氢甲酰化的影响
由表5可见,提高手性膦配体的用量,催化剂的活性有所降低,光学收率有所降低。这是由于两个配体和一个铑组成的配合物即金属和膦之间形成的咬角有利于苯乙烯的侵入,若配体量增多则使配合物结构式增大,空间障碍作用不利于苯乙烯的插入[13]。因此最佳n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=2。
2.1.6 溶剂对反应结果的影响
反应温度为60 ℃,反应压力2 MPa,n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶2 000,n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=2,对苯二酚5 mg,反应时间4 h,考察溶剂对反应的影响,结果如表6。
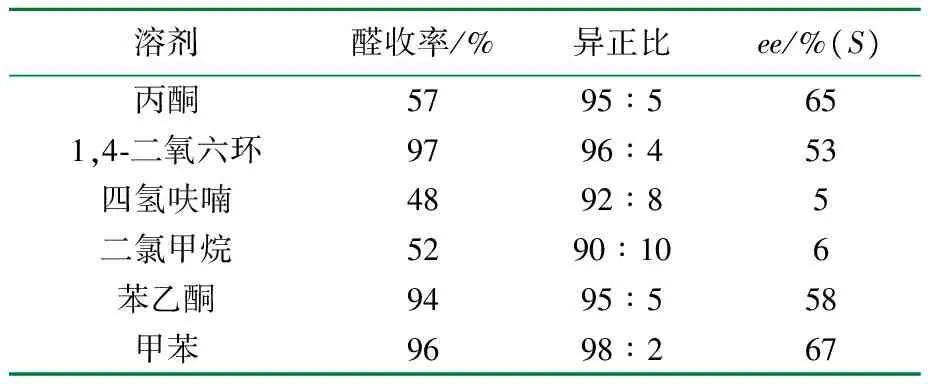
表6 溶剂对苯乙烯不对称氢甲酰化的影响
由表6可见,溶剂是影响反应快慢的重要因素,极性溶剂不利于反应进行,而且立体控制性也差。在非极性溶剂中,产物醛的生成速率加快,光学收率高。以甲苯为溶剂,醛收率为96%,异正比为98∶2,ee值为67%,虽然醛收率不是最高但是异正比和ee值都是较高的,以1,4二氧六环为溶剂,ee值相对以甲苯为溶剂要小很多,所以较佳的溶剂为甲苯。
2.2 不对称氢甲酰化反应机理探究
不对称氢甲酰化反应机理见图3。
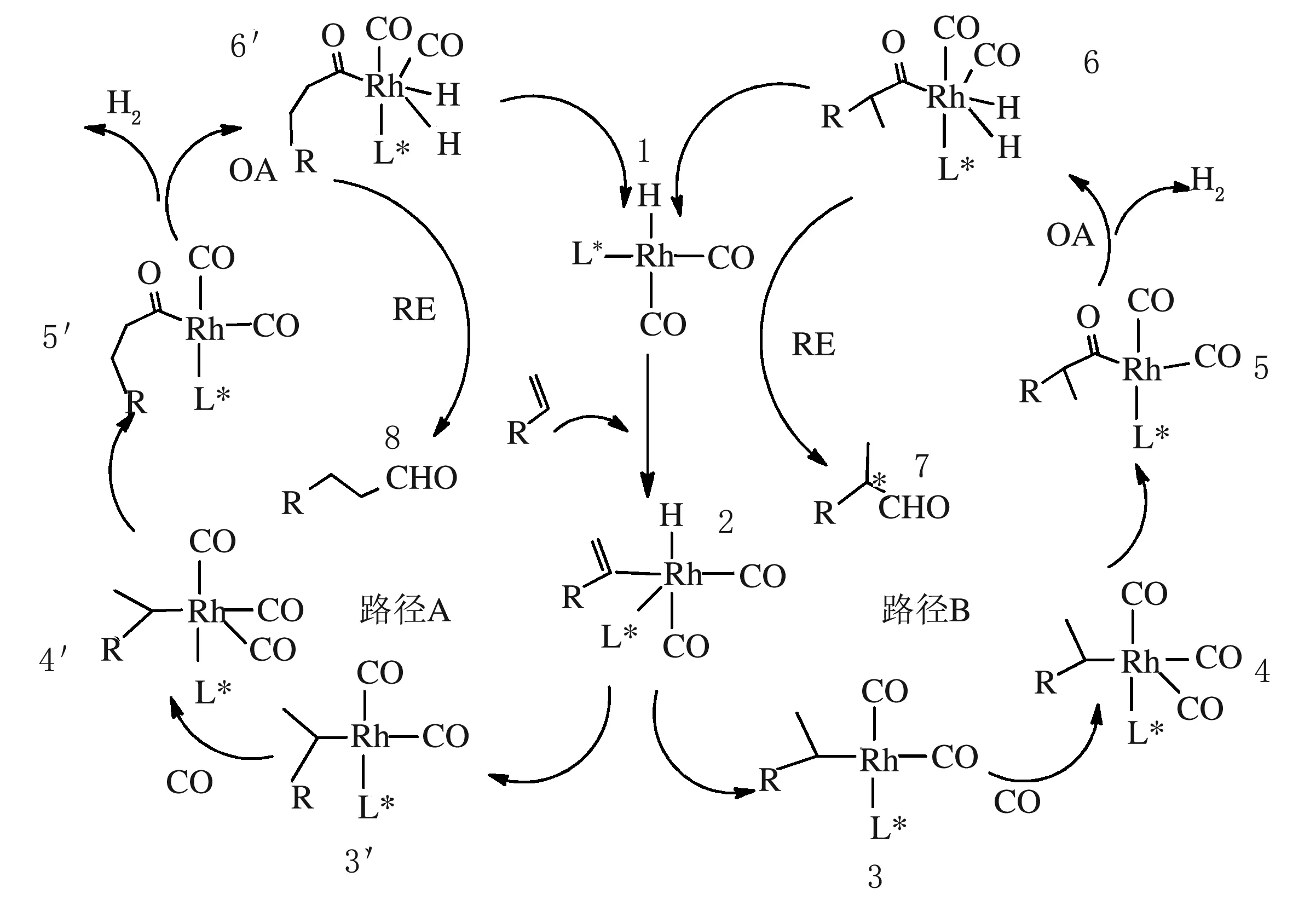
图3 铑催化不对称氢甲酰化反应机理
首先是羰基铑和手性配体形成手性膦螯合的二羰基氢化铑配合物1,末端烯烃作为η-配位基与铑的配合物进行配位,相继进行迁移插入反应或者是烯烃插入金属和氢键之中的氢金属化反应形成烷基络合物,这种烷基络合物有两种异构体即正构和异构,一种是新的碳-金属键可以连接在烯烃的末端位置(路径A)形成烷基金属络合物3′,最终生成直链醛。另一种途径是碳-金属键连接在烯烃的内部位置(路径B)形成络合物3,最终生成支链醛[14],故这一步决定了区域选择性,决定性因素是中心金属的本质。氢金属化反应之后,CO作为配合基加入到金属中心从而形成复合物4′和4,4′和4进行CO迁移到C—Rh键形成烷基铑物种5′和5。对于异构烷基反应此步骤决定了对映选择性,其决定性因素是手性膦的不对称诱导,不对称诱导能力越强,对映选择性越高。带有金属的螯合物插入到H2中,此步要使H—H键断裂,形成两个Rh—H键,因此活化能最高,也是反应中最慢的速控步骤。接着进行还原消除反应,螯合物铑上的酰基与氢结合生成产物醛离开金属中心,催化剂恢复成为手性膦螯合的二羰基氢化铑,完成催化反应并实现催化剂的循环使用。
3 结 论
以Rh(acac)(CO)2和(R,R)-Ph-BPE的配合物为催化体系催化苯乙烯的不对称氢甲酰化反应,综合考虑产物2-苯基丙醛的收率和ee值,较佳反应条件为:温度60 ℃,合成气压力2 MPa;反应时间4 h;n[Rh(acac)(CO)2]∶n(苯乙烯)=1∶2 000;n[(R,R)-Ph-BPE]∶n[Rh(acac)(CO)2]=2;溶剂为甲苯,最高收率为96%,最高ee值达67%。
[1] BIANCHI D,CESTIP,PINAC,et al.Process for the continuous biotechnological preparation of optical isomerS(+) of 2-(6-methoxy-2-naphthyl) propionic acid:US5229280[P].1993-07-20.
[2] XU K,ZHENG X,WANG Z,et al.Easily accessible and highly tunable bisphosphine ligands for asymmetric hydroformylation of terminal and internal alkenes[J].Chemistry - A European Journal,2014,20(15):4357-4362.
[3] DENG Y,WANG H,SUN Y,et al.Principles and applications of enantioselective hydroformylation of terminal disubstituted alkenes[J].Cheminform,2016,47(11):6828-6837.
[4] NOZAKI K,TAKAYA H,HIYAMA T.Enantioselective hydroformylation of olefins catalyzed by rhodium (I) complexes of chiral phosphine-phosphite ligands[J].Topics in Catalysis,1997,4(3/4):175-185.
[5] AGBOSSOU F,CARPENTIER J F,MORTREUX A.Asymmetric hydroformylation[J].Chemical Reviews,1995,95(7):35-64.
[6] SEREGIN I V,GEVORGYAN V.Direct transition metal-catalyzed functionalization of heteroaromatic compounds[J].Chemical Society Reviews,2007,36(7):1173-1193.
[7] ABRAMS M L,FOARTA F,LANDIS C R.Asymmetric hydroformylation ofZ-enamides and enol esters with rhodium-bisdiazaphos catalysts[J].ChemInform,2015,46(15):14583-14588.
[8] LV Z,JIANG Y,ZHOU C,et al.Synthesis and evaluation of stable,efficient,and recyclable carbonylation catalysts:polyether-substituted lmidazolium carbonyl cobalt lonic liquids[J].Journal of Molecular Catalysis A Chemical,2016,415:89-95.
[9] 樊保敏,谢建华,周章涛,等.手性螺环单磷配体在不对称氢甲酰化反应中的应用[J].高等学校化学学报,2006,27(10):1894-1896.
[10] RUBIO M,SUAREZ A,ALVAREZ E,et al.Asymmetric hydroformylation of olefins with Rh catalysts modified with chiral phosphine-phosphite ligands[J].Organometallics,2007,26(25):6428-6436.
[11] ARRIBAS I,VARGAS S,RUBIO M,et al.Chiral phosphine-phosphite ligands with a substituted ethane backbone.influence of conformational effects in rhodium-catalyzed asymmetric olefin hydrogenation and hydroformylation reactions[J].Organometallics,2010,29(22):5791-5804.
[12] 殷元骐,蒋耀忠.不对称催化反应进展[M].北京:科学出版社,2000:135-156.
[13] KLOSIN J,LANDIS C R.Ligands for practical rhodium-catalyzed asymmetric hydroformylation[J].Accounts of Chemical Research,2007,40(12):1251-1259.
[14] TONKS I A,FROESE R D,LANDIS C R.Very Low pressure Rh-catalyzed hydroformylation of styrene with (S,S,S-bisdiazaphos):regioselectivity inversion and mechanistic insights[J].Acs Catalysis,2013,3(12):2905-2909.

