基于免疫组化法分析肺腺癌S100A6蛋白表达与临床特征的关系
南岩东 房延凤 姜华 金发光 杨拴盈
·论著·
基于免疫组化法分析肺腺癌S100A6蛋白表达与临床特征的关系
南岩东1房延凤1姜华1金发光1杨拴盈2
目的探讨S100A6蛋白在肺腺癌中的表达及其临床意义。方法收集2007年1月至2009年1月西安交通大学第二附属医院、第四军医大学唐都医院手术切除的肺癌标本,共计98例肺腺癌及其癌旁正常肺组织,用免疫组织化学法检标本中S100A6蛋白的表达情况,分析S100A6蛋白表达与患者临床病理特征及生存预后的关系。结果S100A6蛋白在肺腺癌组织中的表达显著高于正常肺组织(P<0.001);其表达与患者性别和年龄无相关性(P>0.05),而与吸烟指数、肿瘤细胞分化、淋巴结转移、远处转移、TNM分期显著相关(P<0.05);98例患者5年随访期间77例患者死亡,10例患者存活,11例患者失访,5年生存率为11.49%。其中S100A6蛋白低表达患者5年累计生存率63.6%,中位生存时间68月;中表达患者5年累计生存率14.3%,中位生存时间45月;高表达患者5年累计生存率0%,中位生存时间29月,生存曲线显示S100A6不同表达状态患者生存率比较差异有统计学意义(P<0.05);COX回归模型分析显示,肿瘤分化、TNM分期和S100A6表达状态是影响肺腺癌患者预后的独立因素(P<0.05);S100A6蛋白表达对肺腺癌诊断灵敏度为84.69%,特异度为69.39%。结论S100A6蛋白在肺腺癌组织中显著过表达,与肿瘤分期、分化、转移及预后密切相关。
S100A6蛋白; 肺腺癌; 免疫组织化学; 预后
S100蛋白家族是一组具有EF手型的钙依赖调节蛋白,参与细胞的增殖、分化、钙稳态、蛋白质磷酸化、酶活性和转录因子调节等多种生理功能[1-2]。目前已经发现S100蛋白家族包含21个成员,其中人类S100A6蛋白含有90个氨基酸残基,其单体与钙离子结合后构象发生变化,通过与靶蛋白的相互作用,在体内发挥多种生物学作用[3-4]。Hua等[5]应用cDNA 基因芯片技术发现肝癌组织较正常肝组织S100A6表达上调超过10倍,且S100A6表达程度与肿瘤组织低分化程度显著相关。Komatsu等[6]应用免疫组织化学发现,S100A6在结肠癌肿瘤组织周边部染色较中央部染色明显加深,其表达与结肠癌Dukes分期有密切关系,提示S100A6可能涉及到结肠腺癌的侵袭与进展。我们应用鸟枪法蛋白质组学技术发现S100A6蛋白在肺腺癌中表达明显上调[7]。为了明确S100A6表达与肺腺癌发生、发展的关系,我们应用免疫组织化学法对肺腺癌组织S100A6蛋白进行检测,进一步分析了其表达与肺腺癌临床病理特征及生存预后的关系。
材料与方法
一、一般资料
收集2007年1月至2009年1月西安交通大学第二附属医院、第四军医大学唐都医院手术切除的肺癌标本,共计98例肺腺癌及其癌旁正常肺组织;男56例,女42例;年龄(54.53±16.21)岁; TNM 分期(UICC,2007):Ⅰ期11例、Ⅱ期23例、Ⅲ期26例和Ⅳ期38例。所有患者术前均未行放化疗,无其他肿瘤史,临床及病理资料完整。术后收集新鲜组织标本反复使用无菌生理盐水冲洗,去除血迹及其他坏死物,置于-80 ℃低温冰箱保存。术后随访至2014 年5月,11例患者失访, 其余患者随访资料完整。
二、主要试剂
兔抗人S100A6 多克隆抗体购于美国NeoMarkers公司,工作浓度1︰100;SP 试剂盒购于北京中山金桥生物技术有限公司。样本均经10%福尔马林固定,石蜡包埋,5 μm厚连续切片。免疫组化染色按试剂盒说明进行:石蜡切片经脱蜡、水化,3% H2O2室温孵育15 min封闭内源性过氧化物酶,PBS 漂洗、加封闭液孵育15 min后,一抗滴加后4 ℃孵育过夜,滴加二抗,DAB 显色,苏木素复染。阳性对照为已知染色阳性的人肺腺癌组织切片做标准,PBS缓冲液替代一抗做低对照。
三、结果判定
由2位病理科医师在未知患者临床资料的情况下,独立观察每张切片, 每例切片在40倍镜下随机选取5个视野进行观察,以细胞内出现清晰的黄色、棕黄色颗粒为S100A6 蛋白表达阳性。阳性细胞数分级标准:阳性细胞10%以下为0分,10%~49%为1分,50%~69%为2分,≥70%为3分;信号强弱的判断标准:低或者基本无显色为0分,弱阳性为1分,阳性为2分,强阳性为3分;两项评分相乘,≤2为低表达(+),3~4为中表达(++),6~9为高表达(+++)。
四、统计学方法
采用SPSS 13.0统计软件进行处理,计数资料采用率表示,组间比较应用χ2检验;应用Kaplan-Meier 对生存率进行比较,Cox比例风险回归模型确立患者生存时间的影响因素;检验标准为P<0.05,取双侧检验。
结 果
一、S100A6在肺腺癌组织及正常肺组织表达检测
S100A6 蛋白的免疫着色主要位于细胞质和细胞膜,肿瘤间质和细胞核未见染色,见图1。98例肺腺癌标本组织中S100A6低表达15例(15.3%),中表达26例(26.5%),高表达57例(58.2%);配对的98例正常肺组织低表达68例(69.4%),中表达23例(23.5%),高表达7例(7.1%);两组表达比较,统计具有显著性差异(P<0.001),见表1。
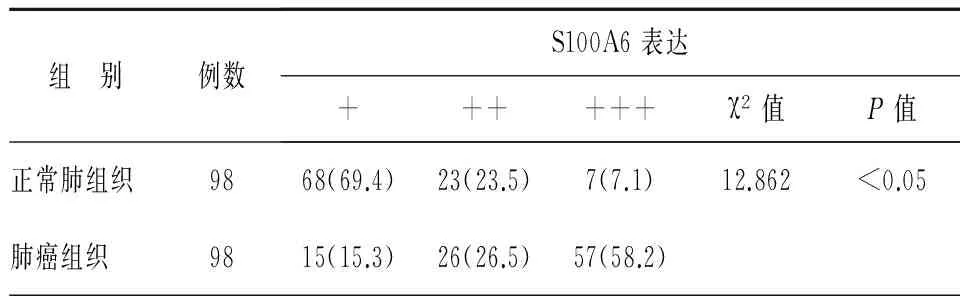
表1 S100A6在肺腺癌组织及正常肺组织的差异表达(%)
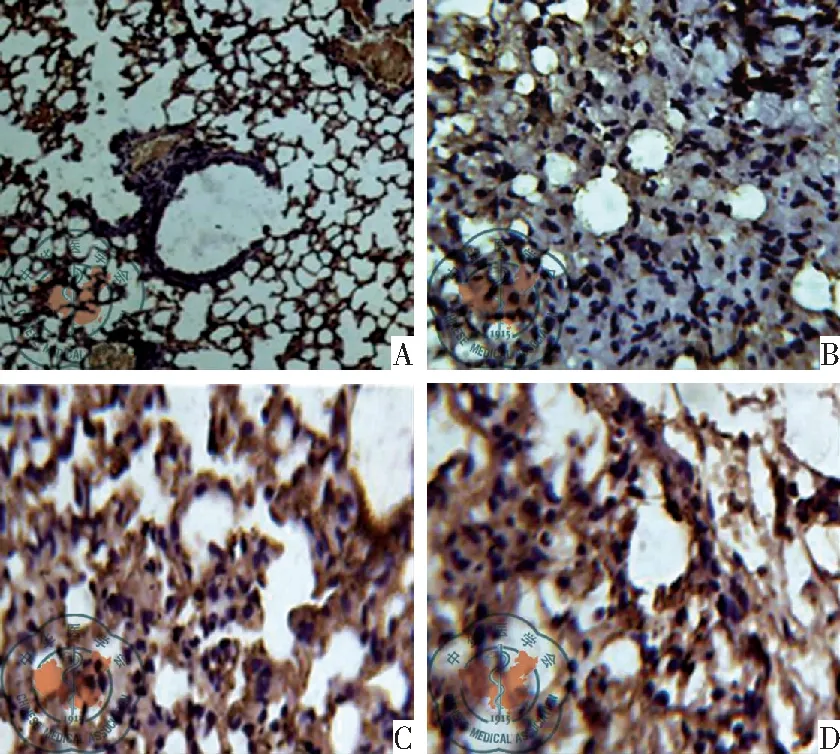
图1 S100A6蛋白在肺腺癌及其配对正常肺组织中表达;注: A:正常肺组织低表达;B:肺腺癌组织低表达(×10);C:肺腺癌组织中表达;D:肺腺癌组织高表达(×40)
二、S100A6蛋白表达与肺腺癌患者临床病理特征关系
S100A6蛋白表达与肺腺癌患者性别、年龄无相关性(P>0.05),而与患者吸烟指数、肿瘤细胞分化、淋巴结转移、远处转移、临床分期均有显著相关性能(P<0.05),见表2。
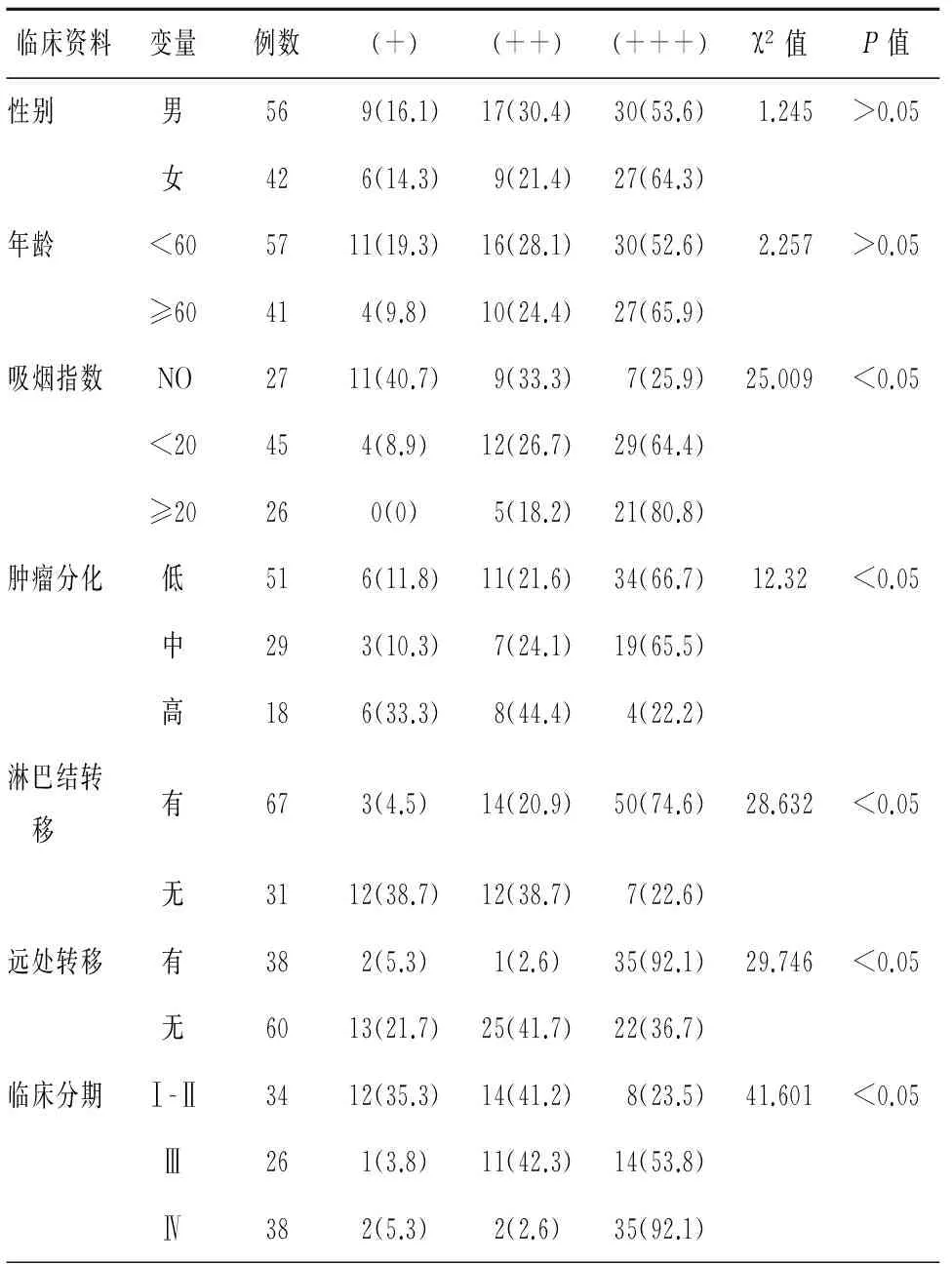
表2 S100A6蛋白表达与肺腺癌患者临床病理特征关系[n(%)]
三、S100A6蛋白不同表达患者生存分析
对98例患者进行了随访,随访时间5年,随访期间77例患者死亡,10例患者存活,11例患者失访,5年生存率为11.49%。S100A6蛋白低表达患者5年累计生存率63.6%,中位生存时间68月;中表达患者5年累计生存率14.3%,中位生存时间45月;高表达患者5年累计生存率0%,中位生存时间29月,见表3;生存曲线显示S100A6不同表达状态患者生存率比较差异有统计学意义(P<0.05),见表3和图2。
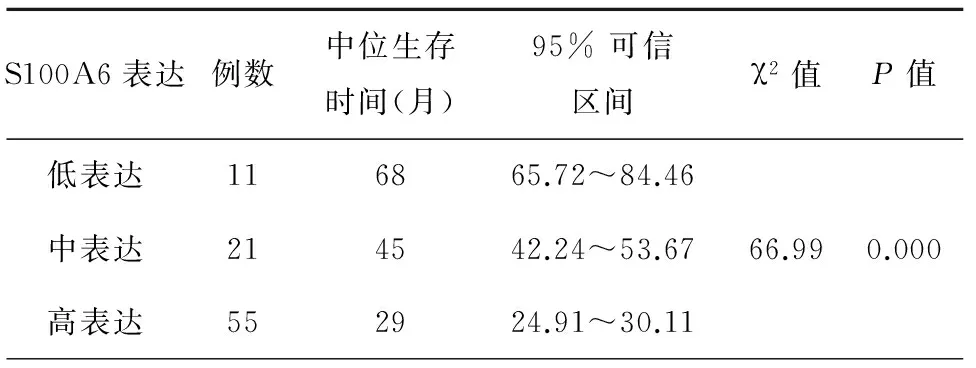
表3 S100A6不同表达状态患者平均生存期比较
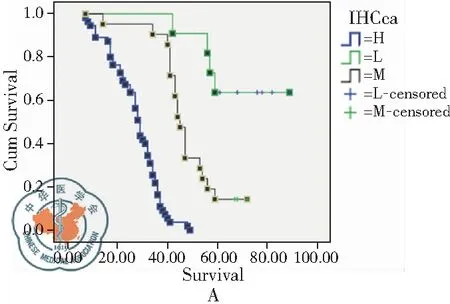
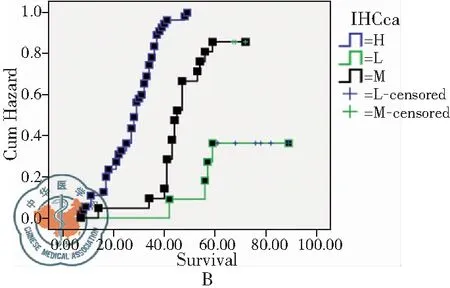
图2 S100A6不同表达状态患者生存率比较;注:A:生存函数曲线;B:危险函数曲线
四、COX回归模型分析
将患者临床病理特征因素单因素,包括性别、年龄、吸烟指数、肿瘤分化、淋巴结转移、远处转移、TNM分期、S100A6表达等选入COX多因素比例风险回归模型,采用逐步回归法多因素分析,结果显示肿瘤分化(P<0.01)、TNM分期(P<0.01)和S100A6表达状态(P<0.01)是影响肺腺癌患者预后的独立因素,见表4、图3。
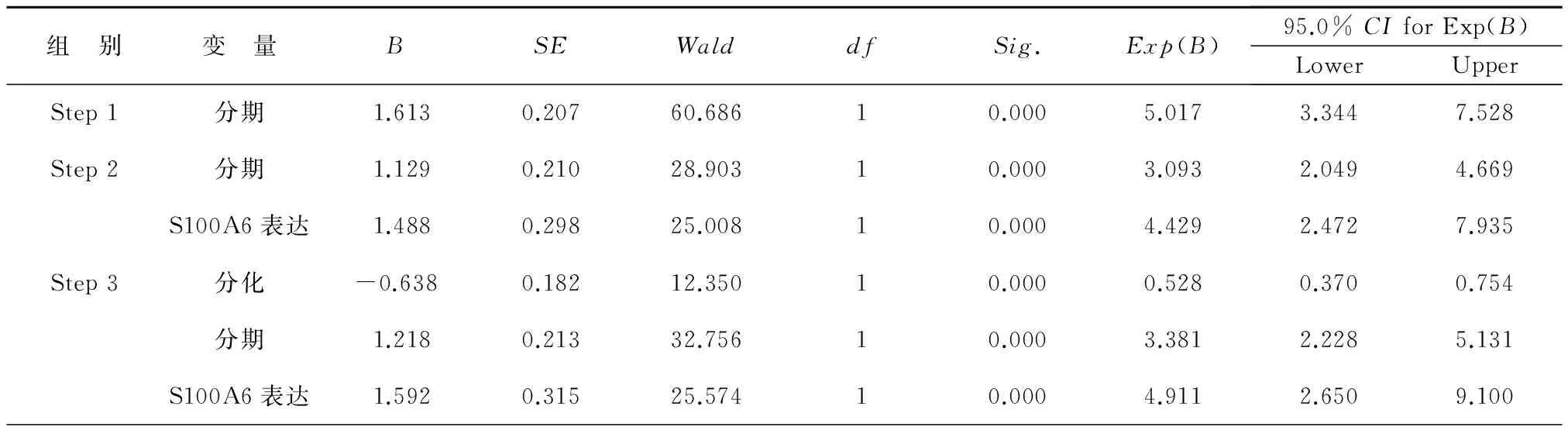
表4 87例肺腺癌患者生存预后的COX回归多因素分析
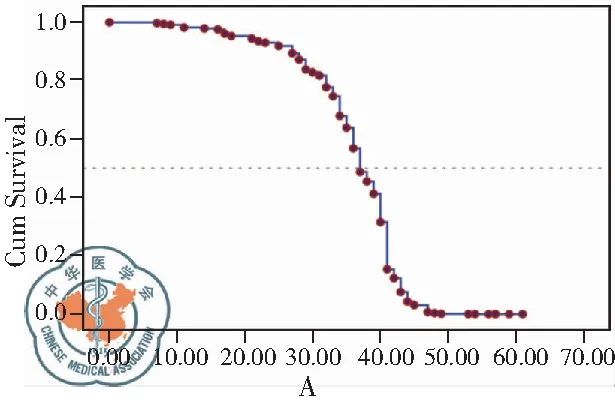
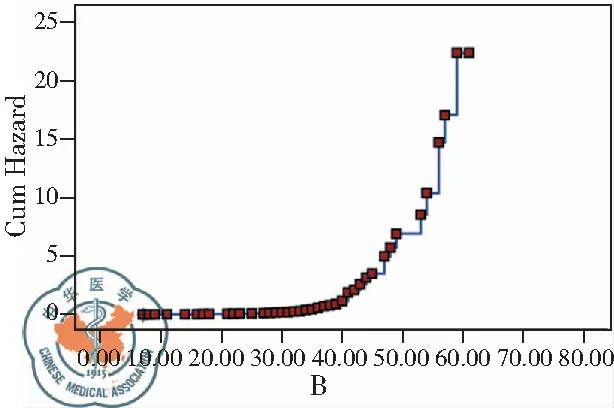
图3 基于随访患者的生存;注:(A)和死亡(B)函数曲线
五、S100A6蛋白表达对肺腺癌诊断效能评价
以S100A6 蛋白表达程度重新区分肺癌组织和正常肺组织,中、高表达定义为肺癌组织,低表达定为正常肺组织,结果113例判断为肺癌组织,83例判断为正常肺组织,见表5;经计算,其灵敏度为84.69%,特异度为69.39%,假阳性预测值为73.45%,阴性预测值81.93%。
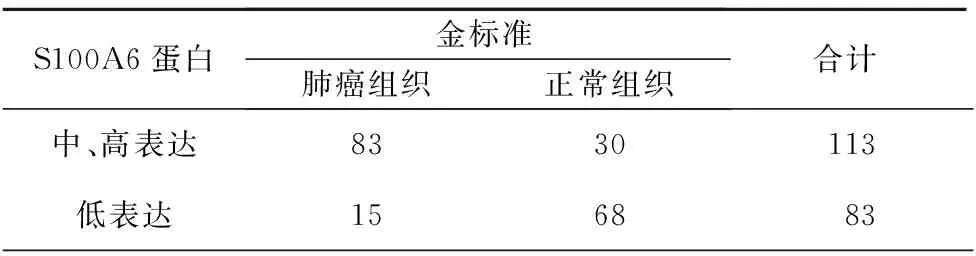
表5 S100A6蛋白表达判断肺癌及正常肺组织
讨 论
原发性支气管肺癌(简称肺癌)是目前世界范围内发病率及死亡率最高的恶性肿瘤,严重危害着人类的生命[8-10]。肺腺癌恶性程度高,早期即可出现胸膜、纵隔淋巴结、骨骼、脑等器官的转移,致使患者初诊时已处于Ⅲ-Ⅳ期,失去了手术治疗的时机,5年生存率仍然不足5%[11]。胸部低剂量CT扫描虽有可能发现早期肺癌,但是其高额花费和辐射危害使得该项检查不可能反复或重复进[12]。肺癌标记物是肺癌细胞产生和释放以及肺癌发生和发展过程中以代谢产物的形式存在于肿瘤细胞内或宿主体液中的某些异常增多的物质、酶及激素等。这些分子标记物对原发肺癌的早期诊断、高危人群的筛选、良恶性肿瘤的鉴别、肿瘤发展程度的判断、肿瘤治疗效果的评价以及肿瘤复发及预后的预测等方面有重要作用[13]。肺癌分子标记物属非损伤、低成本的检测手段,更能反应肿瘤的生物学特性,因此备受临床青睐[14]。然而,目前临床上目前尚未找到理想的肺癌肿瘤标志物。
近年来发现,S100蛋白家族是在体内发挥多种生物学作用, 参与细胞周期活动、细胞分化、肿瘤生长以及细胞外基质分泌活动等过程的一类非泛素化、EF-手型钙结合蛋白[1]。迄今为止,已经发现S100蛋白家族成员有23个,其中 S100A6与肿瘤的增殖、浸润转移和凋亡密切相关,且在多数上皮肿瘤如黑色素瘤、肝癌、结直肠癌、胰腺癌、胆管癌、卵巢癌、人急性粒细胞白血病等肿瘤中高表达[15-17]。本研究应用免疫组织化学法检测了98例肺腺癌及其癌旁正常肺组织标本中S100A6蛋白的表达,结果显示肺癌组织较正常肺组织S100A6蛋白显著高表达,其免疫着色主要位于细胞质和细胞膜,肿瘤间质和细胞核未见染色,与文献报道一致。S100A6蛋白表达与肺腺癌患者性别、年龄无相关性(P>0.05),而与吸烟指数、肿瘤细胞分化、淋巴结转移、远处转移、临床分期均有显著相关性,且随吸烟指数、分化程度、转移及分期程度加重而表达增强,进一步提示S100A6蛋白表达异常可能是肺癌发生的早期事件,并且伴随了肺癌的发展全部过程,因此临床上通过监测S100A6蛋白的表达有助于了解肿瘤的生物学特性[18]。
肿瘤标志物诊断与鉴别诊断的能力和及其对患者的预后判断是临床上关注的关键问题。本研究应用S100A6 蛋白表达高、低达程度重新界定肺癌组织和正常肺组织,获得了良好的灵敏度、特异度、阳性预测值等诊断效能指标,表明通过S100A6蛋白检测联合影像学可为肺内结节的诊断提供有效的途径。本研究数据分析示,S100A6的表达状态与患者的生存期有明显相关性,低表达患者比高表达患者生存期显著延长;结合患者的临床病理特征,应用COX多因素比例风险回归模型分析,发现肿瘤分化、TNM分期和S100A6表达状态是影响肺腺癌患者预后的独立因素,据此建立肺腺癌患者生存函数可对肺腺癌患者进行有效的预后判断。
已有的研究表明,S100A6蛋白功能包括钙传感器、释放细胞内钙信号、调控细胞周期及细胞分化,刺激Ca2+依赖的胰岛素释放、刺激催乳素分泌及胞外分泌等。S100A6通过调控肌动蛋白细胞骨架,与泛素连接酶及CacyBP/SIP蛋白相互作用导致β-连环蛋白降解,在增殖旺盛的肿瘤细胞中呈高表达[19-21]。然而,S100A6的调控可能涉及复杂的信号网络机制,尚需要进一步应用分子生物学和蛋白质组学等技术明确S100A6在肿瘤发生、发展过程中的作用机制。
1 Chen H, Xu C, Jin Q, et al. S100 protein family in human cancer[J]. Am J Cancer Res, 2014, 4(2): 89-115.
2 Donato R. S100: a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J]. Int J Biochem Cell Biol, 2001, 33(7): 637-668.
3 Salama I, Malone P, Mihaimeed F, et al. A review of the S100 proteins in cancer[J]. Eur J Surg Oncol, 2008, 34 (4): 357-364.
5 Hua Z, Chen J, Sun B, et al. Specific expression of osteopontin and S100A6 in hepatocellular carcinoma[J]. Surgery, 2011, 149 (6): 783-791.
6 Komatsu K, Andoh A, Ishiguro S, et al. Increased expression of S100A6 (Calcyclin), a calcium-binding protein of the S100 family, in human colorectal adenocarcinomas[J]. Clin Cancer Res, 2000, 6 (1): 172-177.
7 Nan Y, Jin F, Yang S, et al. Discovery of a set of biomarkers of human lung adenocarcinoma through cell-map proteomics and bioinformatics[J]. Med Oncol, 2010, 27(4): 1398-1406.
8 Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (1): 9-29.
9 钱桂生. 为提高我国呼吸系统疾病的诊治水平而努力[J/CD]. 中华肺部疾病杂志: 电子版, 2012, 5(1): 1-3.
10 李羲, 钱桂生. 肺癌临床的罕见表现[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(1): 4-7.
11 Ettinger DS. Ten years of progress in non-small cell lung cancer[J]. J Natl Compr Canc Netw, 2012, 10 (3): 292-295.
12 Kramer BS, Berg CD, Aberle DR, et al. Lung cancer screening with low-dose helical CT: results from the National Lung Screening Trial (NLST)[J]. J Med Screen, 2011, 18(3): 109-111.
13 Sawyers CL. The cancer biomarker problem[J]. Nature, 2008, 452(7187): 548-552.
14 Brower V. Biomarker studies abound for early detection of lung cancer[J]. J Natl Cancer Inst, 2009, 101(1): 11-13.
15 Ribé A, McNutt NS. S100A6 protein expression is different in Spitz nevi and melanomas[J]. Mod Pathol, 2003, 16(5): 505-511.
16 Cross S, Hamdy F, Deloulme JC, et al. Expression of S100 proteins in normal human tissues and common cancers using tissue microarrays: S100A6, S100A8, S100A9 and S100A11 are all overexpressed in common cancers[J]. Histopathology, 2005, 46(3): 256-269.
17 Luu HH, Zhou L, Haydon RC, et al. Increased expression of S100A6 is associated with decreased metastasis and inhibition of cell migration and anchorage independent growth in human osteosarcoma[J]. Cancer Lett, 2005, 229(1): 135-148.
18 南岩东, 姜华, 金发光, 等. S100A6基因干扰对A549肺腺癌细胞生物学行为的影响[J]. 国际肿瘤学杂志, 2016, 43(3): 161-166.
19 Filipek A. S100A6 and CacyBP/SIP-two proteins discovered in ehrlich ascites tumor cells that are potentially involved in the degradation of β-Catenin[J]. Chemotherapy, 2006, 52(1): 32-34.
20 Schneider G, Filipek A. S100A6 binding protein and Siah-1 interacting protein (CacyBP/SIP): spotlight on properties and cellular function[J]. Amino Acids, 2011, 41 (4): 773-780.
21 Ning X, Sun S, Zhang K, et al. S100A6 protein negatively regulates CacyBP/SIP-mediated inhibition of gastric cancer cell proliferation and tumor genesis[J]. PloS One, 2012, 7(1): 30185.
(本文编辑:王亚南)
南岩东,房延凤,姜华,等. 基于免疫组化法分析肺腺癌S100A6蛋白表达与临床特征的关系[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(1): 15-19.
Analysis of S100A6 protein expression and the clinical significance of patients with lung adenocarcinoma based on the method of immunohistochemisty
NanYandong1,FangYanfeng1,JiangHua1,JinFaguang1,YangShuangying2.
1DepartmentofRespiratoryDisease,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an710038,China;2DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofMedicalSchool,Xi′anJiaotongUniversity,Xi′an710004,China
JinFaguang,Email:jinfag@fmmu.edu.cn
Objective To explore S100A6 protein expression in lung adenocarcinoma and its clinical significance. Methods Immunohistochemisty (IHC) method was used to detect S100A6 protein expression in 98 cases of lung adenocarcinoma tissues and their paired adjacent normal lung tissues. The interrelation of S100A6 protein expression and clinical and pathological characteristics was analyzed by statistics methods. Results The expression of S100A6 protein was higher in lung adenocarcinoma tissue than that in normal lung tissue (P<0.001). The expression of S100A6 protein was not related to age and sex(P>0.05), while is significantly related to smoking index, tumor differentiation, lymph node metastasis, distant metastasis and TNM stage(P<0.05). During the 5-year follow-up period, 77 patients of 98 patients died, 10 patients survived, 11 patients were lost, and the 5-year survival rate was 11.49%. The 5-year cumulative survival rate and the median survival time are respectively 63.6% and 68 months in the patients with low expression of S100A6 protein; 14.3% and 45 months in the patients with moderate expression of S100A6 protein and 0% and 29 months in the patients with high expression of S100A6 protein. Survival curve showed that the survival rate of patients with different S100A6 expression was statistically significant (P<0.05). Cox regression model revealed that the tumor differentiation, TNM stage and S100A6 protein expression were independent hazard factors of lung adenocarcinoma prognosis (P<0.05). The diagnostic sensitivity of the S100A6 protein expression level to lung adenocarcinoma was 84.69% and the specificity was 69.39%. Conclusions S100A6 protein is over-expressed in lung adenocarcinoma tissue and is closely related to the differentiation, stage, metastasis and prognosis of lung adenocarcinoma.
S100A6 protein; Lung Adenocarcinoma; Immunohistochemisty; Prognosis
10.3877/cma.j.issn.1674-6902.2017.01.004
国家自然科学基金资助项目(81001040) 第四军医大学优秀文职人员基金(2011-01) 第四军医大学唐都医院后备人才基金(5033)
710038西安,第四军医大学唐都医院呼吸内科1710004西安,西安交通大学第二附属医院呼吸内科2
金发光,Email:jinfag@fmmu.edu.cn
R563,R734.2
A
2015-12-24)

