胰高血糖素对胰岛β细胞胰岛素分泌的调节作用及机制
石艳秋,李军,李思源,张震,孙侃,王彦文
(1石河子大学医学院第一附属医院,新疆石河子832000;2石河子大学医学院;3郑州市第一人民医院;4济南市协和医院)
胰高血糖素对胰岛β细胞胰岛素分泌的调节作用及机制
石艳秋1,李军1,李思源2,张震3,孙侃1,王彦文4
(1石河子大学医学院第一附属医院,新疆石河子832000;2石河子大学医学院;3郑州市第一人民医院;4济南市协和医院)
目的 观察胰高血糖素对胰岛β细胞(MIN6细胞株)胰岛素(INS)分泌的调节作用,并探讨其作用机制。方法 将培养好的MIN6细胞均转染对环磷酸腺苷(cAMP)敏感的荧光生物传感器DNA质粒ICUE3。转染48 h将细胞随机分为三部分,分别在无糖、低糖(葡萄糖2.8 mmol/L)、高糖(葡萄糖16.7 mmol/L)环境下培养400~600 s,之后各环境下的细胞随机分为四组:0、100、500、1 000 ng/L组,分别用不同浓度(0、100、500、1 000 ng/L)胰高血糖素处理350~600 s。采用荧光共振能量转移技术检测MIN6细胞中cAMP水平,ELISA法检测细胞INS分泌量。结果 在无糖环境下,MIN6细胞内cAMP水平及INS分泌量1 000 ng/L组>500 ng/L组>100 ng/L组,各组两两比较差异有统计学意义(P均<0.05)。在低糖、高糖环境下,MIN6细胞内cAMP水平及INS分泌量1 000 ng/L组>500 ng/L组>100 ng/L组>0 ng/L组,各组两两比较差异有统计学意义(P均<0.05);且高糖环境下以上差异更明显。结论 胰高血糖素可能以浓度梯度的形式通过升高胰岛β细胞内cAMP水平来促进INS分泌,且该作用有一定的葡萄糖依赖性。
胰高血糖素;胰岛素;胰岛β细胞;环磷酸腺苷
1、2型糖尿病发病均与胰岛素(INS)分泌密切相关[1~3],INS分泌及其功能成为研究热点[4]。INS分泌受多种因素的控制,除各种供能物质外,多种激素和神经递质可通过改变某些第二信使浓度等途径调节INS分泌[5]。胰高血糖素是由胰岛α细胞分泌的多肽类激素。有研究表明,胰高血糖素可使体外培养猪胰岛细胞内的环磷酸腺苷(cAMP)水平升高,激活蛋白激酶,继而促进INS的释放[6]。2012年1月~2015年1月,本研究体外培养小鼠胰岛β细胞MIN6,并给予不同浓度的葡萄糖及胰高血糖素干预,探讨胰高血糖素对INS分泌的作用及机制。
1 材料与方法
1.1 细胞及试剂 小鼠来源的胰岛β细胞瘤株MIN6细胞(由湘雅二院馈赠);对cAMP敏感的荧光生物传感器DNA质粒ICUE3(由美国霍普金斯大学实验室构建并馈赠),经提取扩增后储存备用;高糖DMEM培养基、无糖DMEM培养基(GIBCO),L-谷氨酰胺、胰高血糖素(sigma),胰高血糖素受体抗体(GLR ab75240,Abcam),小鼠INS ELISA试剂盒(上海西唐生物科技有限公司),cAMP-ELISA试剂盒(Biovision),质粒大提试剂盒(德国,QIAGEN)等。Krebs:119 mmol/L NaCl、4.7 mmol/L KCl、2.5 mmol/L CaCl2、1 mmol/L MgCl2、1 mmol/L KH2PO4、25 mmol/L NaHCO3,调定pH值7.40,定容1 000 mL,根据预实验分别加入0、2.8、16.7 mmol葡萄糖制备无糖、低糖、高糖环境。
1.2 MIN6细胞培养、转染及干预 MIN6细胞用含4.5 g/L葡萄糖、2%青链霉素、1% L-谷氨酰胺及1‰ β-巯基乙醇的DMEM培养基,于37 ℃、含5% CO2的培养箱中培养,传至4~15代。将MIN6细胞以4×105/孔于6孔培养板中培养,在对数生长期细胞用于实验,均转染ICUE3质粒48 h。将细胞随机分为三部分,分别在无糖、低糖、高糖环境下培养400~600 s,之后各环境下的细胞随机分为四组:0、100、500、1 000 ng/L组,分别用不同浓度(0、100、500、1 000 ng/L)胰高血糖素处理350~600 s。
1.3 MIN6细胞中cAMP水平检测 采用荧光共振能量转移(FRET)技术。取转染后MIN6细胞置于激光共聚焦显微镜下,定位单个细胞视野。处理后的细胞分别追加毛喉素(FSK)处理200 s左右。细胞处理前100 s及处理过程中用激光共聚焦显微镜每10秒采集荧光图像1次,记录波长485、535 nm处接收到的荧光强度;以无糖环境未经胰高血糖素处理的细胞作对照,将FRET发射比值青色荧光蛋白(CFP)/黄色荧光蛋白(YFP)的上升率作为cAMP水平上升率。CFP激发波长为420~440 nm,发射波长为485 nm;YFP激发波长470~490 nm,发射波长为535 nm。
1.4 MIN6细胞INS分泌量检测 取处理后的各组细胞,收集细胞上清液,用ELISA法检测上清液中INS水平。

2 结果
2.1 不同浓度胰高血糖素在无糖、低糖、高糖环境下对MIN6细胞中cAMP水平的影响 在无糖环境下,cAMP水平1 000 ng/L组>500 ng/L组>100 ng/L组,各组两两比较差异有统计学意义(P均<0.05)。在低糖、高糖环境下,cAMP水平1 000 ng/L组>500 ng/L组>100 ng/L组>0 ng/L组,各组两两比较差异有统计学意义(P均<0.05);且高糖环境下以上差异更明显。见表1。

表1 不同浓度胰高血糖素在无糖、低糖、高糖环境下对MIN6细胞中cAMP水平的影响
2.2 不同浓度胰高血糖素在无糖、低糖、高糖环境下对MIN6细胞INS分泌量的影响 在无糖环境下,INS分泌量1 000 ng/L组>500 ng/L组>100 ng/L组,各组两两比较差异有统计学意义(P均<0.05)。在低糖、高糖环境下,INS分泌量1 000 ng/L组>500 ng/L组>100 ng/L组>0 ng/L组,各组两两比较差异有统计学意义(P均<0.05);且高糖环境下以上差异更明显。见表2。
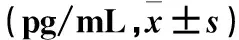
表2 不同浓度胰高血糖素在无糖、低糖、高糖环境下对MIN6细胞INS分泌量的影响
3 讨论
研究表明,胰高血糖素受体(GCGR)是由7个跨膜G蛋白偶联形成,胰高血糖素与INS之间的比例是影响血糖浓度的一个重要因素[7]。胰高血糖素对β细胞INS分泌的调节作用可能通过先与细胞膜上的GCGR相结合,引起腺苷酸环化酶活化,从而使ATP环化为cAMP,再通过cAMP-PKA第二信使信号途径实现的[8,9],此作用中第二信使cAMP可能是胰高血糖素参与调控INS分泌的桥梁[10],在INS分泌机制中扮演重要角色。
本研究预实验模拟人体低糖、高糖环境,确定葡萄糖的终浓度。FSK是一种疏水性腺苷酸环化酶(AC)激活剂,可以直接刺激升高哺乳动物细胞内AC(除去IX型所有亚型)的活性,使细胞内cAMP水平升高,增强荧光接收强度。ICUE3质粒可表达一种生物合成的对cAMP敏感的荧光生物传感器。当胞内cAMP水平增加时,除细胞外观上荧光叠加图像的颜色变化以外,CFP/YFP的FRET发射比值增加,可作为细胞内cAMP水平增加的指标。据文献[11,12]报道,低浓度少量的胰高血糖素和高浓度大量胰高血糖素对β细胞的作用机制稍有不同。少量的胰高血糖素通过使细胞去极化致电压依赖性钙通道开放,胞内游离钙离子浓度升高,直接引起INS释放;当大量胰高血糖素刺激时,cAMP水平升高,激活PKA等途径以促进INS分泌。本研究中MIN6细胞内cAMP水平检测结果显示,单纯葡萄糖环境下高糖较无糖、低糖升高;无糖环境下1 000、500 ng/L胰高血糖素高于0、100 ng/L胰高血糖素,1 000 ng/L与500 ng/L差异不明显;低糖、高糖环境下1 000 ng/L胰高血糖素高于0、100 ng/L胰高血糖素,且高糖环境时,1 000 ng/L胰高血糖素高于500 ng/L胰高血糖素。这表示胰高血糖素可能以浓度梯度增加细胞内cAMP的水平,也显示了对葡萄糖的依赖性。同时观察不同浓度胰高血糖素对INS分泌量的影响,无糖环境下,经胰高血糖素处理后INS分泌量均升高,且随着胰高血糖素浓度升高,INS分泌量依次升高。
综上所述,本研究在活细胞中测得随着胰高血糖素浓度的增加胰岛β细胞内cAMP水平增加,INS分泌增加。这说明胰高血糖素可能通过增加MIN6细胞内cAMP水平促进INS分泌,且这一作用具有一定的葡萄糖依赖性。
[1] Danaei G, Finucane MM, Lu Y, et al. Global Burden of Metabolic Risk Factors of Chronic Diseases Collaborating Group (Blood Glucose). National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9·1 million participants[J]. Lancet, 2011,377(9765):557-567.
[2] Liu F, Fu Y, Wei C, et al. The expression of GPR109A, NF-κB and IL-1β in peripheral blood leukocytes from patients with type 2 diabetesJ]. Ann Clin Lab Sci, 2014,44(4):443-448.
[3] 杨晓敏,沙敏,韩晓.胰岛β细胞特异性转基因小鼠模型在2型糖尿病研究中的应用[J].中国糖尿病杂志,2014,6(8):568-571.
[4] Du XH, Liu HL, Li L, et al. Clinical siglgificance of immunotherapy with combined three kinds of cells for operable colorectal cancer[J]. Tumo Biol, 2015,36(7):5679-5685.
[5] Madsen L, Pedersen L M, Liaset B, et al. cAMP-dependent siglgaling regulates the adipogenic effect of n-6 polyunsaturated fatty acids[J]. J Biol Chem, 2008,283(11):7196-7205.
[6] Bertuzzi F, Berra C, Socci C, et al. Glucagon improves insulin secretion from pig islets in vitro[J]. J Endocrinol, 1995,147(1):87-93.
[7] Gonzalezabuin N, Pinent M, Casanovamarti A, et al. Procyanidins and their healthy protective effects against type 2 diabetes[J]. Curr Med Chem, 2015,22(1):39-50.
[8] Kyriazis GA, Smith KR, Tyrberg B, et al. Sweet taste receptors regulate basal insulin secretion and contribute to compensatory insulin hypersecretion during the development of diabetes in male mice[J]. Endocrinology, 2014,155(6):2112-2121.
[9] 孟梅.胰高血糖素与2型糖尿病[J].临床与病理杂志,2013,33(2):160-164.
[10] Idevall-Hagren O, Barg S, Gylfe E, et al. cAMP mediators of pulsatile insulin secretion from glucose-stimulated single beta-cells[J]. J Biol Chem, 2010,285(30):23007-23018.
[11] Favre D, Niederhauser G, Fahmi D, et al. Role for inducible cAMP early repressor in promoting pancreatic beta cell dysfunction evoked by oxidative stress in human and rat islets[J]. Diabetologia, 2011, 54(9):2337-2346.
[12] 常子涛,李思源,李军,等.胰升血糖素通过环磷鸟嘌呤核苷信号通路调节MIN6细胞胰岛素分泌的作用机制研究[J].中华糖尿病杂志,2016,24(8):742-744.
Regulatory effect of glucagon on insulin secretion of pancreatic β cells
SHIYanqiu1,LIJun,LISiyuan,ZHANGZhen,SUNKan,WANGYanwen
(1TheFirstAffiliatedHospitalofMedicalCollegeofShiheziUniversity,Shihezi832000,China)
Objective To explore the regulation effect and mechanism of glucagon on insulin secretion of the pancreatic β cell-MIN6 cells. Methods The cultured MIN6 cells were transfected with ICUE3, a fluorescent biosensor DNA sensitive to cyclic adenosine monophosphate (cAMP), and then were randomly divided into three groups, respectively, which were cultivated for 400-600 s under the glucose-free, low-glucose (2.8 mmol/L glucose) and high-glucose (16.7 mmol/L glucose) conditions. Then the cells in each group were randomly divided into four groups: 0, 100, 500, and 1 000 ng/L groups which were treated with 0, 100, 500, and 1 000 ng/L glucagon for 350-600 s. Using fluorescence resonance energy transfer technology (FRET) to detect the cAMP levels in MIN6 cells, and the Ins secretion was measured by enzyme-linked immune sorbent assay (ELISA).Results Under the glucose-free condition, the levels of cAMP and Ins secretion in MIN6 cells of the 1 000 ng/L group were significantly higher than those in the 500 ng/L group, and significant difference was found between every two groups (allP<0.05). Under the low-glucose and high-glucose conditions, the levels of cAMP and Ins secretion in MIN6 cells: 1 000 ng/L group > 500 ng/L group >100 ng/L group >0 ng/L group, significant difference was found between every two groups (allP<0.05). And under the high glucose environment, the difference was more significant.Conclusion Glucagon may stimulate insulin secretion by increasing cAMP levels in the way of concentration gradient within the islet β cell line-MIN6 cells, and this trend is glucose-dependent.
glucagon; insulin; pancreatic β cells; cyclic adenosine monophosphate
兵团中青年科技创新领军人才专项(2015BC001);兵团科技援疆项目(2014AB049);兵团博士资金专项(2012BB019)。
石艳秋(1989-),女,在读硕士,主要研究方向为内分泌及代谢性疾病。E-mail:576497847@qq.com
李军(1972-),女,博士,教授,主要研究方向为内分泌及代谢性疾病。E-mail: xjlijun@163.com
10.3969/j.issn.1002-266X.2017.05.006
R458.5
A
1002-266X(2017)05-0019-03
2016-10-07)

