西南大西洋拉氏南美南极鱼脂肪酸组成及其食性研究
杨清源,王少琴、2,朱国平、2、3,宋旗
(1.上海海洋大学海洋科学学院,上海201306;2.上海海洋大学大洋渔业资源可持续开发省部共建教育部重点实验室极地海洋生态系统研究室,上海201306;3.国家远洋渔业工程技术研究中心,上海210306)
西南大西洋拉氏南美南极鱼脂肪酸组成及其食性研究
杨清源1,王少琴1、2,朱国平1、2、3,宋旗1
(1.上海海洋大学海洋科学学院,上海201306;2.上海海洋大学大洋渔业资源可持续开发省部共建教育部重点实验室极地海洋生态系统研究室,上海201306;3.国家远洋渔业工程技术研究中心,上海210306)
拉氏南美南极鱼Patagonotothen ramsayi为南极鱼科中数量最多、生态地位非常重要的次南极鱼种,为了解拉氏南美南极鱼的营养动力学与生态功能,利用脂肪酸生物标记法探究了该鱼种的脂肪酸组成及其食性。结果表明:从西南大西洋拉氏南美南极鱼肌肉中共检测出16种脂肪酸,其中含量较高的脂肪酸包括C16∶0、C18∶1n9、C20∶5n3(EPA)和C22∶6n3(DHA),DHA平均含量显著高于EPA(P<0.05);多种特征脂肪酸含量与体长存在着显著的相关性,饱和脂肪酸、多不饱和脂肪酸和7种脂肪酸含量与体长之间存在着显著的负相关关系 (P<0.05),而指示摄食对象营养级高低的DHA/EPA值与体长之间存在着显著的正相关关系 (P<0.05)。研究表明,拉氏南美南极鱼主要摄食浮游生物和底栖生物,其肉食性特性随体长的增大而增强。
拉氏南美南极鱼;脂肪酸;食性;西南大西洋
拉氏南美南极鱼 Patagonotothen ramsayi (Regan,1913)属大洋底栖性[1],为南极鱼科南美南极鱼属中数量最多的鱼种,广泛分布于西南大西洋温带次南极海域,栖息水层为50~500 m[2-3],常见于巴塔哥尼亚南部陆架和陆坡水域 (150~400 m)[4-6],主要摄食底栖或近底栖甲壳动物[7]。关于该鱼种的繁殖[6,8-9]、生长[10]和年龄[11]已有报道,但关于该鱼种的营养以及食性的研究较少。
大量研究证实了脂肪酸示踪在海洋鱼类营养相互关系上的潜在作用[12],这是因为海洋初级生产者包含的某些脂肪酸模式可守恒地转移到初级消费者,并能够被辨认出来,而脂肪酸营养标记(FATM)概念就是基于这样的考虑提出的[13]。过去30年多来,脂肪酸常被用于跟踪或确认海洋环境中捕食者与捕食对象相互关系的量化标记。最近,脂肪酸还被用于确认影响全球主要生态系统动力学的关键过程[13]。但关于高纬度冷水性海洋鱼类的脂肪酸组成研究相对较少[14],尤其是次南极水域的大洋性鱼种。考虑到丰度较高,拉氏南美南极鱼曾是前苏联底拖网渔业主要渔获之一,2001年西班牙船队的渔获率也达到了250 kg/h[15],但因当时商业价值较低,该鱼种多成为鱿鱼[7]和有鳍鱼类拖网渔业的主要丢弃对象[9]。近几年,中国南极磷虾拖网渔业在南极磷虾渔季开始之前于西南大西洋水域兼捕该鱼种,其也成为继鱿鱼之后最为重要的商业性渔获之一,2009—2011年间平均渔获率已达到1477 kg/h[16]。尽管该鱼种的商业价值在逐渐提升,且其在次南极食物网结构中也有着非常重要的作用,但关于该鱼种的脂肪酸组成及其食性研究仍非常有限[7,17]。鉴于此,本研究中利用从西南大西洋阿根廷外海采集的拉氏南美南极鱼样本,对其脂肪酸组成及其食性进行研究,旨在为进一步掌握该鱼种的营养成分以及在巴塔哥尼亚海洋生态系统中的生态地位提供基础数据。
1 材料与方法
1.1 材料
拉氏南美南极鱼样本取自在西南大西洋水域作业的大型中层拖网渔船。取样时间为2014年12月至2015年3月,取样站点如图1所示。所有海上随机采集的样本立即放入-20℃冷冻条件下保存,以便运回国内实验室进行分析。

图1 调查站位Fig.1 Sampling locations
1.2 方法
1.2.1 样本处理 在实验室中,将样本解冻后首先测定其体长 (L)和体质量 (W)等,其中体长测量使用精度为1 mm的钢尺,体质量测定使用精度为1 g的电子秤;测量完基础生物学指标后,取样本背鳍附近肌肉保存于标记好的塑料瓶中,用于后续脂肪酸的测定和处理。生物学测定方法按《海洋调查规范》进行[18]。
1.2.2 脂肪酸的提取 拉氏南美南极鱼去皮后,取躯干部上侧肌肉,清洗后进行冷冻干燥。将冷冻干燥后的肌肉磨成粉,取0.2 g粉末样品于试管中,加入15 mL三氯甲烷-甲醇溶液 (体积比为2∶1)浸泡20 h以上。离心后取上清液于具塞试管中,再加入10 mL三氯甲烷-甲醇混合溶液冲洗残渣,离心取上清液,合并两次收集的上清液加入4 mL 0.9%的氯化钠溶液,静置2 h。取下层溶液于圆底烧瓶中进行水浴蒸发,得到粗脂肪样品[19]。
1.2.3 脂肪酸甲酯化 在圆底烧瓶中加入4 mL氢氧化钾-甲醇溶液 (0.5 mol/L),混合后连接水浴回流装置 (100℃),水浴加热5~10 min,加入4 mL三氟化硼-甲醇溶液煮沸25~30 min,最后加入4 mL正己烷回流萃取2 min。冷却后加入10~15 mL氯化钠饱和溶液,摇晃均匀。将溶液倒入试管中静置分层1~2 h。用注射器吸取一定量的正己烷层 (上层)留待测量。将得到的正己烷层用5977A气相色谱质谱联用仪 (美国Agilent公司)在一定条件 (色谱柱为HP-88;控温程序,125℃保持0 min,以8℃/min升到145℃,保持26 min,再以2℃/min升至220℃,保持1 min,再以1℃/min升到227℃,保持1 min;分流比为10∶1)下进行测定。
1.2.4 指标的测定与计算 以37种脂肪酸混标及内标19烷酸甲酯标品作为标准,通过比对保留时间对脂肪酸进行定性分析,采用内标法对脂肪酸进行定量分析[20]。脂肪酸含量使用以下内标法公式得出其质量分数,并用单位干质量的拉氏南美南极鱼肌肉组织中每种脂肪酸的含量表示,即
Xi=ms×Ai×fs,i/(m×As)。
其中:Xi为待测样品中组分i的含量 (mg/g);Ai为组分i的峰面积;m为样品的质量;ms为待测样品中加入内标物的质量;As为待测样品中内标物的峰面积;fs,i为组分i与内标物的校正因子之比,称为相对校正因子。
1.3 数据处理
拉氏南美南极鱼体长-体质量关系采用幂函数表示,并采用单因子方差分析检验该关系是否显著。利用配对t检验分析不同脂肪酸含量或类型之间是否存在显著性差异,显著性水平设为0.05。
2 结果与分析
2.1 基础生物学
经测定,拉氏南美南极鱼体长范围为10.2~27.5 cm,平均体长为 (18.1±4.73)cm;体质量范围为11.1~396.8 g,平均体质量为 (117.8± 104.87)g。体长-体质量关系为W=3.0483×10-3L3.5538(R2=9.7798,n=36,P<0.001)(图2)。
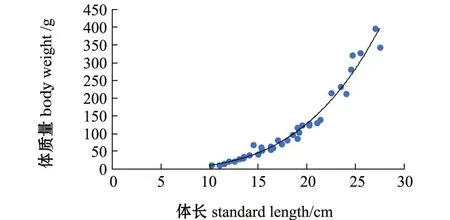
图2 西南大西洋拉氏南美南极鱼体长与体质量关系Fig.2 Weight-length relationship of the rock cod in the southwestern Atlantic Ocean
2.2 脂肪酸组成
从西南大西洋拉氏南美南极鱼体内共检测出16种脂肪酸,如表1所示。从表1可见:含量较高的脂肪酸包括C16∶0、 C18∶1n9c、 C20∶5n3和C22∶6n3, 其含量分别为(13.95±7.19)、(5.38±3.30)、(6.49± 3.54)、(14.00±5.40)mg/g;饱和脂肪酸 (SFA)包括5种,总含量为 (19.21±9.10)mg/g,单不饱和脂肪酸 (MUFA)和多不饱和脂肪酸 (PUFA)分别含5种和6种,其总含量分别为 (9.15± 5.79)mg/g和 (22.40±9.17)mg/g。拉氏南美南极鱼肌肉组织内含量最高的为多不饱和脂肪酸,其次为饱和脂肪酸,两者含量均为单不饱和脂肪酸的2倍以上,且显著高于后者 (配对t检验:SFA与MUFA,t=11.79,P<0.001;PUFA与MUFA,t= 11.49,P<0.001)。常见的多不饱和脂肪酸为n-3系列的EPA和DHA,以及n-6系列的C18∶2n6t(亚油酸)和 C20∶3n6(AA)等。DHA含量显著高于EPA(t=19.86,P<0.001)。

表1 西南大西洋拉氏南美南极鱼脂肪酸含量Tab.1 Fatty acid contents of the rock cod in the southwestern Atlantic Ocean mg/g
从质量百分比角度来看,拉氏南美南极鱼肌肉中饱和脂肪酸质量分数(∑SFA)占脂肪酸总质量分数的 37.81%,含量由高至低依次为 C16∶0(27.46%)、C18∶0(5.24%)、C14∶0(3.80%)、C17∶0(1.01%)和C23∶0(0.30%);单不饱和脂肪酸的质量分数(∑MUFA)占脂肪酸总质量分数的18.11%,含量由高至低依次为 C18∶1n9c(10.59%)、 C16∶1n7(5.66%)、C20∶1(1.13%)、C24∶1n9(0.43%)、C22∶1n9(0.31%);多不饱和脂肪酸的质量分数(∑PUFA)占脂肪酸总质量分数的44.09%,含量由高至低依次为 C22∶6n3(27.56%)、 C20∶5n3(12.77%)、 C20∶3n6(1.65%)、C18∶2n6t(1.16%)、C20∶2(0.55%)、C20∶4n6(0.37%)。不饱和脂肪酸的质量分数 (∑UFA)占脂肪酸总质量分数的62.19%,饱和脂肪酸与不饱和脂肪酸的质量分数比 (∑SFA/∑UFA)为0.608。
2.3 特征脂肪酸
表2显示了拉氏南美南极鱼肌肉组织脂肪酸含量与体长之间的相关性。从表2可见:饱和脂肪酸(F=4.606,P=0.039<0.05,n=36)及多不饱和脂肪酸 (F=6.309,P=0.017<0.05,n=36)含量(y)与体长 (x)之间也存在着较为显著的线性关系 (y=ax+b);16种脂肪酸中,仅有7种脂肪酸含量与体长之间存在着显著的线性关系,分别为C16∶0、 C16∶1n7、 C18∶0、 C18∶2n6t、C20∶5n3、C22∶6n3和 C23∶0,值得注意的是,这些脂肪酸类型或脂肪酸含量随着体长的增加而呈逐渐下降趋势。
对具有食性指示标记的脂肪酸比值进行分析后得知,PUFA/SFA(F=0.064,P=0.802>0.05, n=36)及 DHA/EPA(F=0.024,P=0.877>0.05,n=36)的比值与体长之间并无线性关系存在。针对DHA/EPA而言,考虑到其中有3个明显的异常值,当去除这3个异常值后,可以发现,其与体长之间存在着显著的正相关关系 (F=9.271, P=0.005<0.01,n=33)(表2)。
3 讨论
3.1 脂肪酸组成
本研究中,拉氏南美南极鱼的肌肉组织样品中共含有16种脂肪酸,其中饱和脂肪酸5种,分别为豆蔻酸 (C14∶0)、棕榈酸 (C16∶0)、十七碳酸(C17∶0)、 硬脂酸 (C18∶0)、 二十三碳酸 (C23∶0);不饱和脂肪酸 (UFA)11种,包括单不饱和脂肪酸 (MUFA)5种,分别为棕榈烯酸 (C16∶1n7)、油酸 (C18∶1n9c)、 二十碳烯酸 (C20∶1)、 顺芥子酸(C22∶1n9)、 神经酸 (C24∶1n9), 多不饱和脂肪酸(PUFA)6种,分别为亚油酸 (C18∶2n6t)、花生四烯酸 (C20∶2)、二十碳三烯酸 (C20∶3n6)、花生四烯酸 (C20∶4n6)、二十碳五烯酸 (C20∶5n3)、二十二碳六烯酸 (C22∶6n3)。González等[21]对拉氏南美南极鱼的脂肪酸组成进行了研究,其使用的样本平均体长为21~40 cm(154~214 g),样本个体较大。本研究中测定所得的脂肪酸含量与González等[21]测定的脂肪酸含量略有差异。共同之处是两个研究所测定的脂肪酸中,相同种类为C14∶0、C16∶0、C16∶1n7、C18∶0、 C18∶1n9c、 C18∶2n6t、 C20∶1、 C20∶4n6、 C20∶5n3、C22∶1n9和 C22∶6n3等 11 种, 且两个研究中, C16∶0、C18∶1n9c、 C20∶5n3和 C22∶6n3等 4种脂肪酸的含量均较高。不同之处是, 本研究中 C14∶0、 C16∶0C16∶1n7、C18∶0、 C18∶1n9c、 C18∶2n6t和 C22∶6n3的含量较 González 等[21]测得的数据略低, 而 C20∶1、 C20∶4n6、 C22∶1n9的含量较González等[21]测得的数据略高。但t检验显示,两个研究中共同脂肪酸含量之间不存在显著性差异 (t=0.150,P=0.884>0.05)。除此之外,两研究中仍存在一些脂肪酸种类的差异,造成这个结果的原因可能是:(1)体长差异,本研究中样品体长范围为10.2~27.5 cm,而González等[21]采用的样本平均体长范围为21~40 cm;(2)除体长外,影响鱼类生化组成的因素较多,包括鱼类的生理状况、栖息环境、主要摄食物种等。

表2 西南大西洋拉氏南美南极鱼脂肪酸含量与标准体长之间的线性关系Tab.2 Linear relationship between fatty acid content and standard length of the rock cod in the southwestern Atlantic ocean
作为必需脂肪酸 (EFA)来源,膳食脂质对于鱼类的正常生长与生存而言,有着非常重要的作用[22]。许多海洋鱼类幼体需要较高的 (n-3)类不饱和脂肪酸,如EPA和DHA[23]。拉氏南美南极鱼肌肉组织中不饱和脂肪酸含量较高,且主要是多不饱和脂肪酸,C16∶0和C18∶1n9为饱和脂肪酸和单不饱和脂肪酸中含量最高的脂肪酸[21]。拉氏南美南极鱼中的多不饱和脂肪酸含量与同科其他鱼种相当[24]。本研究中,(n-3)类多不饱和脂肪酸含量较高,尤其是EPA和DHA,共占87.51%,这也是该鱼种具潜在营养价值和商业目标的重要佐证[21]。
在 (n-6)类多不饱和脂肪酸中,C20∶4n6为含量较高的脂肪酸。一些研究认为, (n-3)/(n-6)可作为比较鱼油相对营养价值的良好指标[25]。从营养目的考虑,如 (n-3)/(n-6)=1,可认为营养达到最佳[26],尤其是EPA和DHA为饮食中的主要脂肪酸来源。基于这些考虑,拉氏南美南极鱼可认为是ω3脂肪酸的良好来源,本研究中(n-3)/(n-6)之比 (11.43±3.80)较其他热带鱼种高[21],如鲱鱼 (6.42±1.70)、狭鳕 (12.6± 3.96)和金枪鱼 (4.97±2.17)[27]。Gutierrez等[14]分析了巴西水域8种海水鱼类,尽管其发现了这些高纬度冷水鱼类仍存在有C12∶0、C14∶1、C20∶0和C22∶0等脂肪酸,但它们的含量均较低,大部分脂肪酸及其含量与本研究中拉氏南美南极鱼较为相似。
3.2 特征脂肪酸及其食性指示标记
南美南极鱼属鱼种的典型特征之一是摄食泛化,即摄食对象具有强烈的季节随机性,如夏末季节,桡足类丰度较高,此时小个体拉氏南美南极鱼以浮游生物为主要摄食对象[25],而冬季却多摄食底栖生物,此时的食物来源多含栉水母和刺铠虾Munida gregaria[7]。但最近的一项研究显示,拉氏南美南极鱼的食性较为季节单一性[7],其摄食大量的浮游生物和底栖生物,且食性能够轻易地由食浮游生物转移到食底栖生物,由主动猎食转到摄取动物尸体[1,7,28-30]。另外,有研究表明,拉氏南美南极鱼胃含物中含有渔业丢弃物[31]。Laptikhovsky[30]也曾发现,除了摄食大量的浮游生物和底栖生物 (主要摄食端足类,尤其是中上层虫戎亚目的细脚长虫戎Themisto gaudichaudi)外,拉氏南美南极鱼胃含物中还发现了该水域从事鱿钓渔业和底拖网作业的渔业丢弃物,大、小个体拉氏南美南极鱼胃含物中渔业丢弃物的比例分别达到了15.6%和22.8%,有时胃含物中甚至全部是渔业丢弃物,包括秘鲁笔管鱿Loligo gahi的触须和腕以及海胆等。
鱼类食物中的脂质特性可以影响到鱼油中脂肪酸的分布比例。由于摄食习性不同,各种鱼类由海洋植物、浮游甲壳动物和其他浮游动物中获得天然油脂的程度也不一样。海洋浮游生物作为鱼类主要的食物来源,其脂肪酸组成近年来已引起研究人员的注意[32]。已有研究指出,鱼油脂肪酸组成与浮游生物油脂肪酸组成具有相似性[33]。ω3多不饱和脂肪酸 (如EPA和DHA)是浮游植物经过海洋浮游食物链,积累在更高一级的肉食性种类中[34]。本研究中,拉氏南美南极鱼肌肉组织中的多种特征脂肪酸,如C16∶0、C16∶1、C20∶5和C22∶6等均与其体长存在显著的负相关关系,即随着体长的增加,这些脂肪酸的含量逐渐下降。由此可以推断,首先,拉氏南美南极鱼食物来源于以原核生物或真核生物、硅藻[35-36]、蓝绿藻[32]和鞭毛藻[35-36]为食的生物,或者其本身直接摄食这些藻类。这与上述关于拉氏南美南极鱼食物组成的直接观察结果是一致的,即其会摄食大量的浮游生物和底栖生物,因为,在次南极或南极水域,端足类生物如桡足类或磷虾,其主要的摄食对象为硅藻以及其他藻类,而这些浮游动物普遍存在于拉氏南美南极鱼胃含物中[7,30-31]。其次,随着体长的增加,拉氏南美南极鱼此类食物来源的比例逐渐下降,本试验中排除3个可能因试验过程中样品被杂质污染所导致的异常值外,拉氏南美南极鱼肌肉组织中DHA/EPA的值大于2,且其含量随着体长的增加而增加,这表明较大个体的拉氏南美南极鱼食物组成中含有更多的浮游动物或者更多地采取肉食性的摄食行为[37-38]。这与上述关于拉氏南美南极鱼的食物组成观察也保持一致,即大个体拉氏南美南极鱼体内通常会出现该海域捕捞渔业的丢弃物,如秘鲁笔管鱿的触须和腕、磷虾类、端足类或者南极鱼成体部分以及幼鱼等,这些被丢弃的渔获物所代表的营养级相对较高。最后,拉氏南美南极鱼的食性或食物组成呈现较为显著的个体变化[30],即小个体以摄食浮游植物或底栖生物为主,而大个体则多摄食浮游动物或渔业丢弃物。
此外,在拉氏南美南极鱼肌肉组织中还发现了其他一些类型的特征脂肪酸,如 C20∶4n6和 C18∶ln7,但这些脂肪酸与其体长之间并无显著的相关性。C20∶4n6被认为是大型藻类的特征脂肪酸,并且能够指示微型浮游动物,如纤毛虫[35]。Stowasser等[39]发现,底栖生物通常含有较高含量的 C20∶4n6和C18∶ln7,因此,这两个脂肪酸经常被用作底栖食物食性的标志物。本研究中只有少量个体含有C20∶4n6,且含量较低,表明拉氏南美南极鱼较少摄食大型藻类,这可能与该鱼种的摄食选择性或随机摄食有关。尽管C18∶ln7所占的比例较高,但考虑到其与体长之间亦无相关性,故可判断其是拉氏南美南极鱼整个生活史阶段的底栖食物来源,无个体差异性。
致谢:本研究调查过程中,中国水产总公司所属渔船 “龙腾号”船长及全体船员协助收集并提供相关样品,在此深表谢忱!
[1] Eastman J T.Antarctic Fish Biology:Evolution in a Unique Envi-ronment[M].San Diego,CA,USA:Academic Press,1993.
[2] Nakamura I,Inada T,Takeda M,et al.Important fishes trawled off Patagonia[R].Tokyo:Japan Marine Fishery Resource Research Center,1986:369.
[3] Erzini K.A compilation of data on variability in length-age in marine fishes[R].Kingston:University of Rhode Island,1991:36.
[4] Norman J R.Coast fishes.Part II.The Patagonian region[J].Discovery Reports,1937,16:1-150.
[5] Hart T J.Report on trawling surveys on the Patagonian continental shelf[J].Discovery Reports,1946,23:223-408.
[6] Brickle P,Shcherbich Z,Laptikhovsky V V,et al.Aspects of the biology of the Falkland Islands'rock cod Patagonotothen ramsayi (Regan,1913)on the southern Patagonian Shelf[R].Scientific Report.Stanley:Falkland Islands Government Fisheries Department,2005:81.
[7] Laptikhovsky V V,Arkhipkin A I.An impact of seasonal squid migrations and fishing on the feeding spectra of subantarctic notothenioids Patagonotothen ramsayi and Cottoperca gobio around the Falkland Islands[J].Journal of Applied Ichthyology,2003,19 (1):35-39.
[8] Sosiński J,Janusz J.The distribution and biology of Patagonotothen ramsayi(Regan,1913):results of Polish studies on the Patagonian Shelf,1979-1993[R].Gdynia,Poland:Sea Fisheries Research Institute,2003.
[9] 朱国平,许柳雄,陈新军.西南大西洋拉氏南美南极鱼生物学特性的初步研究[J].水产学报,2010,34(12):1877-1882.
[10] Brickle P,Arkhipkin A,Shcherbich Z.Age and growth of a sub-Antarctic notothenioid,Patagonotothen ramsayi(Regan 1913), from the Falkland Islands[J].Polar Biology,2006,29(8):633-639.
[11] Ekau W.Biological investigations on Notothenia ramsayi Regan 1913(Pisces,Notothenioidei,Nototheniidae)[J].Arch Fisch Wiss,1982,33(1-2):43-68.
[12] St John M A,Lund T.Lipid biomarkers:linking the utilization of frontal plankton biomass to enhanced condition of juvenile North Sea cod[J].Marine Ecology Progress Series,1996,131:75-85.
[13] Dalsgaard J,John M S,Kattner G,et al.Fatty acid trophic markers in the pelagic marine environment[M]//Southward A J,Tyler P A,Young C M,et al.Advances in Marine Biology.London:Academic Press,2003,46:225-340.
[14] Gutierrez L E,da Silva R C M.Fatty acid composition of commercially important fish from Brazil[J].Scientia Agricola,1993,50 (3):478-483.
[15] Portela J.A research project:rockcod[J].Productos del Mar, 2004,202:12-14.
[16] Laptikhovsky V V,Arkhipkin A I,Brickle P.From small bycatch to main commercial species:explosion of stocks of rock cod Patagonotothen ramsayi(Regan)in the Southwest Atlantic[J]. Fisheries Research,2013,147:399-403.
[17] Oehlenschläger J.Chemical composition of the flesh and other tissues of Antarctic fish species of the families Channichthyidae and Nototheniidae[J].Food Chemistry,1991,40(2):159-167.
[18] 国家技术监督局.GB 12763.1-7-1991海洋调查规范[S].北京:中国标准出版社,1991.
[19] Folch J,Lees M,Sloane Stanley G H,et al.A simple method for the isolation and purification of total lipids from animal tissues [J].Journal of Biological Chemistry,1957,226(1):497-509.
[20] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22223-2008食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)的测定 水解提取-气相色谱法[S].北京:中国标准出版社,2008.
[21] González M J,Gallardo J M,Brickle P,et al.Nutritional composition and safety of Patagonotothen ramsayi,a discard species from Patagonian Shelf[J].International Journal of Food Science and Technology,2007,42(10):1240-1248.
[22] Rainuzzo J R,Reitan K I,Olsen Y.The significance of lipids at early stages of marine fish:a review[J].Aquaculture,1997,155 (1-4):103-115.
[23] Owen J M,Adron J W,Middleton C,et al.Elongation and desaturation of dietary fatty acids in turbot Scophthalmus maximus L., and rainbow trout,Salmo gairdnerii Rich[J].Lipids,1975,10 (9):528-531.
[24] Nichols D S,Williams D,Dunstan G A,et al.Fatty acid composition of Antarctic and temperate fish of commercial interest[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1994,107(2):357-363.
[25] Pigott G M,Tucker B W.Seafood:Effects of Technology on Nutrition[M].Miami:CRC Press,1990:32-65.
[26] Simopoulos A P.Summary of the NATO advanced research workshop on dietary ω3 and ω6 fatty acids:biological effects and nutritional essentiality[J].The Journal of Nutrition,1989,119(4): 512-528.
[27] Strobel C,Jahreis G,Kuhnt K.Survey of n-3 and n-6 polyunsaturated fatty acids in fish and fish products[J].Lipids in Health and Disease,2012,11:144.
[28] Boltovskoy D,Gibbons M,Hutchings L,et al.General biological features of the South Atlantic[M]//Boltovskoy D.South Atlantic Zooplankton.Leiden:Backhuys Publishers,1999:1-42.
[29] Kock K H.Antarctic Fish and Fisheries[M].Cambridge,UK: Cambridge University Press,1992.
[30] Laptikhovsky V V.A comparative study of the diet in three sympatric populations of Patagonotothen species(Pisces:Nototheniidae)[J].Polar Biology,2004,27(4):202-205.
[31] Laptikhovsky V V,Fetisov A.Scavenging by fish of discards from the Patagonian squid fishery[J].Fisheries Research,1999,41 (1):93-97.
[32] 李烈英,于富才,李光友.几种海洋生物高度不饱和脂肪酸的比较研究[J].海洋学报,1994,16(1):105-113.
[33] Kayama M,Tsuchiya Y,Mead J F.A model experiment of aquatic food chain with special significance in fatty acid conversion[J]. Bulletin of the Japanese Society of Scientific Fisheries,1963,29 (5):452-458.
[34] Sargent J R,Whittle K J.Lipids and hydrocarbons in the marine food web[M]//Longhurst A R.Analysis of Marine Ecosystems. London:Academic Press,1981:491-533.
[35] Sargent J R,Parkes R J,Mueller-Harvey I,et al.Lipid biomark-ers in marine ecology[M]//Sleigh M A.Microbes in the Sea. Chichester:Ellis Horwood,1987:119-138.
[36] Schmidt K,Atkinson A,Petzke K J,et al.Protozoans as a food source for Antarctic krill,Euphausia superba:complementary insights from stomach content,fatty acids and stable isotopes[J]. Limnology and Oceanography,2006,51(5):2409-2427.
[37] Rossi S,Youngbluth M J,Jacoby C A,et al.Fatty acid trophic markers and trophic links among seston,crustacean zooplankton and the siphonophore Nanomia cara in Georges Basin and Oceanographer Canyon(NW Atlantic)[J].Scientia Marina,2008,72 (2):403-416.
[38] Copeman L A,Parrish C C,Gregory R S,et al.Fatty acid biomarkers in coldwater eelgrass meadows:elevated terrestrial input to the food web of age-0 Atlantic cod Gadus morhua[J].Marine E-cology Progress Series,2009,386:237-251.
[39] Stowasser G,Pond D W,Collins M A.Using fatty acid analysis to elucidate the feeding habits of Southern Ocean mesopelagic fish [J].Marine Biology,2009,156(11):2289-2302.
Fatty acid composition and feeding habit of rock cod Patagonotothen ramsayi in southwestern Atlantic Ocean
YANG Qing-yuan1,WANG Shao-qin1,2,ZHU Guo-ping1,2,3,SONG Qi1
(1.College of Marine Sciences,Shanghai Ocean University,Shanghai 201306,China;2.Polar Marine Ecosystem Laboratory,Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources,Ministry of Education,Shanghai Ocean University,Shanghai 201306,China;3.National Distant-water Fisheries Engineering Research Center,Shanghai 201306,China)
Muscular fatty acid composition and feeding habits were investigated in rock cod Patagonotothen ramsayi as an ecologically important and most abundant sub-Antarctic fish species in the family Notothenioidei in the southwestern Atlantic Ocean using fatty acid biomarker analysis to understand the trophic dynamics and ecological function of the rock cod.The results showed that 16 fatty acids were detected in the muscle,higher in C16:0,C18∶1n9, C20∶5n3(EPA)and C22∶6n3(DHA).There was significantly higher content of DHA than EPA(P<0.05).The significant relationship between content of several types of specific fatty acids and the body length was found,and the contents of saturated fatty acids,polyunsaturated fatty acids and 7 types of fatty acids showed significantly negative correlation with body length(P<0.05).The ratio of DHA/EPA,which implied the trophic level of food items, however,showed significantly positive correlation with body lengths(P<0.05).The specific fatty acid analysis revealed that the rock cod primarily fed on planktons and benthos,with carnivorous habit transformation with growth.
Patagonotothen ramsayi;fatty acid;feeding habit;southwestern Atlantic Ocean
S912;S931.1
A
10.16535/j.cnki.dlhyxb.2017.01.015
2095-1388(2017)01-0086-07
2016-05-18
教育部留学回国人员科研启动基金资助项目;国家公益性行业 (农业)科研专项 (201203018);国家科技支撑计划项目(2013BAD13B03)
杨清源 (1994—),女,本科生。E-mail:yuanzi_yang@yeah.net
朱国平 (1976—),男,博士,副教授。E-mail:gpzhu@shou.edu.cn

