南海北部陆坡水域尾明角灯鱼生物学特征的初步研究
杨雨燕,应一平,赵宪勇,王新良,张俊,陈作志,汤勇
(1.大连海洋大学海洋技术与环境学院,辽宁大连116023;2.中国水产科学研究院黄海水产研究所农业部海洋渔业可持续发展重点实验室,山东青岛266071;3.中国水产科学研究院南海水产研究所,广东广州510300)
南海北部陆坡水域尾明角灯鱼生物学特征的初步研究
杨雨燕1、2,应一平2,赵宪勇2,王新良2,张俊3,陈作志3,汤勇1
(1.大连海洋大学海洋技术与环境学院,辽宁大连116023;2.中国水产科学研究院黄海水产研究所农业部海洋渔业可持续发展重点实验室,山东青岛266071;3.中国水产科学研究院南海水产研究所,广东广州510300)
尾明角灯鱼Ceratoscopelus warmingii是南海北部陆坡水域中层鱼类的重要种类之一,本试验中根据2015年6月南海北部陆坡水域综合调查中的中层拖网数据,对尾明角灯鱼生物学特征及分布进行了初步研究。结果表明:夏季南海北部陆坡水域尾明角灯鱼的体长范围为30~64 mm,体长由3个股群组成,其体长平均值分别为 (37.52±2.39)、 (44.62±2.84)、 (49.80±3.17)mm,其体长与体质量关系式为W= 8.418×10-6L3.0985;性腺成熟度以Ⅱ期、Ⅲ期居多,50%性腺发育为Ⅱ期及以上的尾明角灯鱼体长为42.54 mm,雌、雄比为1∶0.7,较大个体中雌性居多;夜间其平均摄食等级随时间的延长逐渐增加,20:00、22:00、4:00时尾明角灯鱼的平均摄食等级分别为0.82、1.58、2.53;本次调查白天在600 m以浅水层多未捕获尾明角灯鱼,傍晚开始捕获少量样品,夜间在上层捕获的量较大,该现象反映了南海北部陆坡水域尾明角灯鱼昼夜垂直移动的习性,同时佐证了该鱼白天多分布于700 m以深水域的相关研究结果。本研究结果可为南海北部陆坡水域尾明角灯鱼的进一步研究提供基础参数及资料。
尾明角灯鱼;昼夜垂直移动;体长;繁殖;摄食习性;中层鱼类
尾明角灯鱼Ceratoscopelus warmingii隶属于灯笼鱼目Myctophiformes、灯笼鱼科Myctophidae、角灯鱼属Ceratoscopelus[1],广泛分布于全球各海域,是中国南海陆坡水域重要的中层鱼类之一[2-3]。近年来,随着研究方法和技术手段的不断进步,具有重要生态地位的中层鱼类逐渐引起国内外学者的广泛关注。部分中层鱼类有昼夜垂直移动的习性,昼间广泛分布于200~1000 m水层,夜间上升至200 m以浅水层[3-5]。中层鱼类的昼夜垂直移动对深海的物质循环和能量流动有着重要的作用,有研究认为,这种行为将大量有机碳转移至深海,从而驱动甚至加速有机碳的垂直通量,是海洋中连接中上层和底层的生物泵[6-8]。在深海食物链中,尾明角灯鱼等中层鱼类是连接浮游动物和更高一级乃至顶级捕食者的关键种类,对其他海洋生物的数量变动有着直接或间接的影响[9-10]。
对尾明角灯鱼等重要中层鱼类的生物学特征的研究,也是科学管理中国中层鱼类及探究其生态作用的基础。目前,外国学者对大西洋、地中海等海域尾明角灯鱼的分布、年龄、生长、繁殖和摄食等方面的特征已有一些研究[11-22],而尾明角灯鱼作为全球广泛分布的种类,上述特征可能会存在很大的区域差异。中国学者对尾明角灯鱼的形态分类有一定的研究,但尚在起步阶段,本研究中对南海北部陆坡海域尾明角灯鱼的体长组成、性腺发育特征、摄食习性和分布特征进行了初步分析,以期为其后续研究提供基础资料。
1 材料与方法
1.1 数据来源
样本数据均来自国家重点基础研究发展计划项目 “南海陆坡生态系统动力学与生物资源的可持续性利用”2015年夏季调查航次,调查范围及站位设置如图1所示,调查时间为2015年6月10—30日。
1.2 方法
1.2.1 采样方式 采用中层拖网进行采样,网具主尺寸为136.8 m×50.85 m(网衣全长×网口周长),上、下纲均为25 m,正方形4片网,网口高度为6.2~10.5 m(平均为8.6 m),网囊网目为1 cm。根据使用探鱼仪EK60探测的鱼群分布深度确定各调查站位的拖网水层,拖速保持在3.5~3.6 kn。采样站位的详细信息如表1所示,其中Ts01~Ts04为研究中层鱼类昼夜垂直移动、摄食等习性设置的时间序列站。生物学测定样本来自 L15、Ts01、Ts03站位随机取样后加水冷冻保存的样品。

表1 拖网取样站位及尾明角灯鱼渔获信息Tab.1 Information of station and trawl samples of lanternfish Ceratoscopelus warmingii
1.2.2 生物学指标的测定 将样品带回实验室解冻后分类、测定,L15、Ts01、Ts03 3个站位分别取得样本148、88和200尾,累计样本436尾。用量鱼板测定体长 (精确至1 mm),用电子天平测定体质量 (精度为0.01 g)。根据 《海洋水产资源调查手册》中的方法将性腺成熟度划分为Ⅰ~Ⅵ期,摄食等级划分为0~4级[23]。
1.2.3 渔获分布 根据下网时间、水层,将站位分为昼间中层DM(6:00~18:00,>200 m)、夜间中层NM(18:00~次日6:00,>200 m)、夜间上层NE(18:00~次日6:00,<200 m)和时间序列站 (Ts)4类。每站拖网时间均标准化为1 h,渔获量均转化为g/h,并以此表示相对密度分布。用Surfer软件绘制尾明角灯鱼渔获分布图。
1.2.4 生物学特征
(1)股群分析。依据 Snedecor体长组距法,体长组间距取近似值2 mm;体质量组间距取0.15 g。计算组成股群的平均值及方差,并统计体长、质量分布及其所占比例。
(2)体长与体质量的关系用幂指数拟合,即

其中:W为体质量 (g);L为体长 (mm);a、b为待估算参数。
(3)统计不同性别及不同性腺成熟度所占比例,并进行比较。用逻辑斯蒂方程,求得性腺发育(Ⅱ期以上)比例与体长的关系式为

其中:M为体长组Li对应的发育个体的比例;L50为发育个体比例为50%时的鱼体长度 (mm)。
(4)统计不同时间段的平均摄食等级,不同时间段不同体长组的平均摄食等级,以及不同摄食等级的平均值及其所占比例,并进行比较。
1.3 数据处理
数据统计及相关图表的制作使用Microsoft Office Excel软件,使用SPSS 17.0软件进行协方差分析,体长组成分析及其他关系式的建立及画图使用R软件完成。

图1 调查站位分布Fig.1 Distribution of survey stations
2 结果与分析
2.1 渔获分布
调查结果表明:区分时间、水层后,在夜间上层除1个站位未捕获到尾明角灯鱼外,其余站位夜间上层尾明角灯鱼的渔获量最大;18:00后,在中层尾明角灯鱼的相对密度随时间的延长而增加; 在600 m以浅水层昼间所有站位 (除Ts04站外)均未采集到尾明角灯鱼。在时间序列站位中,尾明角灯鱼的分布密度与上述结果基本一致;尾明角灯鱼的水平分布密度差异很大,且未表现出明显的水平分布规律。
2.2 体长、体质量组成
调查结果表明:2015年6月采集自南海北部陆坡水域的436尾尾明角灯鱼的体长范围30~64 mm,平均为48.5 mm,优势体长组为46~52 mm,占总尾数的61.28%(图2);体质量范围为0.29~2.98 g,优势体质量组为1.14~1.98 g,占总尾数的64.68% (图3)。股群分析 (图2、图3)表明,其体长由3个股群组成,体长平均值分别为(37.52±2.39)、(44.62±2.84)、(49.80±3.17) mm,体质量平均值分别为(0.60±0.11)、(1.16± 0.22)、(1.63±0.31)g。
2.3 体长与体质量的关系
用协方差分析法 (Ancova)检验尾明角灯鱼性别间体长与体质量关系无显著性差异 (P>0.05),因此,合并雌、雄以及不可辨认个体以拟合体长与体质量的关系。经拟合,尾明角灯鱼体长与体质量的关系式为 W=8.418×10-6L3.0985,R2= 0.9385(图4)。

图2 南海陆坡水域夏季尾明角灯鱼体长组成Fig.2 Body length composition of lanternfish Ceratoscopelus warmingii in the waters of northern slope in the South China Sea in summer

图3 南海陆坡水域夏季尾明角灯鱼体质量组成Fig.3 Body weight composition for lanternfish Ceratoscopelus warmingii in the waters of northern slope in the South China Sea in summer

图4 南海陆坡水域夏季尾明角灯鱼体长与体质量的关系Fig.4 Relationship between body length and body weight of lanternfish Ceratoscopelus warmingii in the waters of northern slope of the South China Sea in summer
2.4 性腺发育特征
6月南海北部陆坡水域尾明角灯鱼性腺成熟度处于Ⅰ~Ⅳ期的个体均存在,以Ⅱ期、Ⅲ期性腺成熟度的个体居多,占总尾数的64.22%。整体而言,雌性个体占39.6%,雄性个体占27.6%,不可辨认个体占32.8%,雌、雄比例为1∶0.7。
如图5所示:体长范围为33~46 mm的个体,性腺成熟度为Ⅰ期、Ⅲ期;体长范围为40~46 mm的个体,有少量性腺成熟度达到Ⅳ期;体长范围为47~60 mm的个体,性腺成熟度多为Ⅲ期、Ⅳ期,体长较大的个体中,性腺成熟度为Ⅱ期的仍占一定比例。

图5 南海陆坡水域尾明角灯鱼性腺成熟度-体长分布Fig.5 Maturity stage-body length relationship in lanternfish Ceratoscopelus warmingii in the waters of northern slope in the South China Sea
如图6所示,大于47 mm的尾明角灯鱼性比均大于等于1,体长小于47 mm的个体雄性居多。性腺发育 (Ⅱ期及以上)比例与体长的关系式为M=1/[1+e0.6146(L-42.54)], 50%性腺发育体长为42.54 mm(P<0.001)(图7)。

图6 南海陆坡水域尾明角灯鱼体长-性比分布Fig.6 Length-sex ratio distribution in lanternfish Ceratoscopelus warmingii in the northern slope in the South China Sea
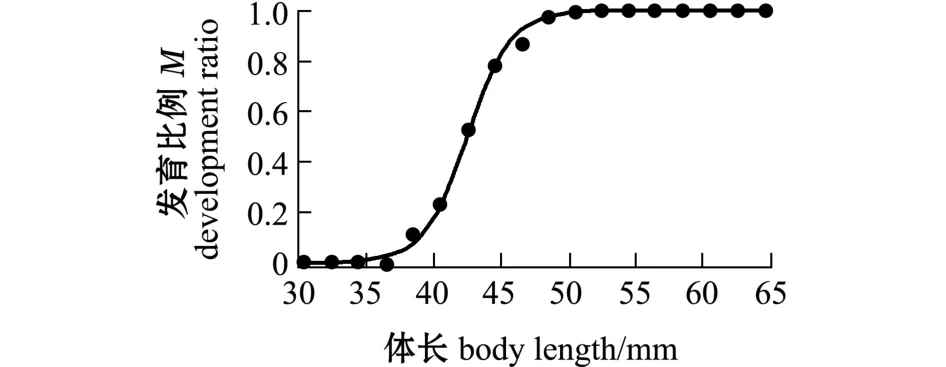
图7 南海陆坡水域尾明角灯鱼体长-性腺发育Fig.7 The gonadal development-body length relationship in lanternfish Ceratoscopelus warmingii in the waters of northern slope in the South China Sea
2.5 摄食等级组成
从图8可见,夜间尾明角灯鱼的摄食等级随时间的延长而上升,20:00、22:00、4:00时的平均摄食等级分别为0.82、1.58、2.53。从图9可见:夜间3个时间,不同体长的摄食等级亦有一定差异,20:00时平均摄食等级随体长的增大而升高,由小到大各体长组平均摄食等级分别为0、0.57、0.78、0.76、1.13、1.33;22:00时,较小个体摄食等级上升,较大、较小个体的摄食等级稍高于中等体长个体,由小到大各体长组平均摄食等级分别为 2.00、1.86、1.50、1.37、1.62、1.77;4:00时,平均摄食等级随体长的增大而降低,由小到大各体长组平均摄食等级分别为3.00、2.65、2.57、2.05、1.00。

图8 南海陆坡水域尾明角灯鱼不同时间的平均摄食等级Fig.8 Average degree of stomach fullness of lanternfish Ceratoscopelus warmingii at different time in the waters of northern slope of the South China Sea

图9 南海陆坡水域尾明角灯鱼不同时间的平均摄食等级-体长分布Fig.9 The stomach fullness-body length relationship in lanternfish Ceratoscopelus warmingii in the waters of northern slope in the South China Sea
3 讨论
由于样品采集范围、时间序均非常有限,本研究中对尾明角灯鱼的总体情况分析可能存在偏差,且尾明角灯鱼等中层鱼类生活习性与生活史,均与研究较为广泛的陆架、大洋经济鱼类存有一定差异,因此,研究方法、研究结果也相应有所不同。
3.1 渔获分布特点
本次调查采样过程中,采用的是非闭合式中层拖网,在拖网过程中网口始终张开。除Ts04站于16:00在600 m以浅水层捕获少量尾明角灯鱼外,昼间所有站位在600 m以浅水层均未捕获尾明角灯鱼,傍晚在该水层开始有样品捕获,夜间上层(除L02站外)捕获该样品较多。结合声学调查影像及相关研究结果,可认为对南海北部陆坡水域的尾明角灯鱼与中、北部大西洋和西北太平洋等海域的相关研究相符,具有昼间分布于200 m以深的水层、夜间上浮至上层的昼夜垂直移动习性[2-4,11-13]。
关于尾明角灯鱼昼间分布的水层,Kinzer 等[11]、Hulley[2]和 Badcock等[12]在对中、北部大西洋等海域的研究中认为,尾明角灯鱼昼间在400~1500 m水层广泛分布,主要栖息于700~1500 m深水层,而Watanabe等[13]在对西北太平洋海域0~700 m水深的研究结果中显示,尾明角灯鱼昼间分布于300~600 m水层。这进一步说明尾明角灯鱼等中层鱼类昼间分布水层及昼夜垂直移动模式,但仍需结合其他可闭合式分层拖网及相关研究,采用更系统、水深更深的分层采样进一步研究。
3.2 生物学特征
目前,对尾明角灯鱼及其他灯笼鱼科鱼类的研究表明,其具有生长较快、繁殖属多批产卵型且死亡率较高、主要捕食浮游动物等特点[14-17]。由于尾明角灯鱼为全球分布的种类,其繁殖季节、捕食对象等在不同海域可能存在一定的差异,因此,南海北部陆坡水域尾明角灯鱼的生物学特征需要更系统地进行研究。本研究中,根据本次调查数据及其他海域的相关研究,初步探讨了南海北部陆坡水域尾明角灯鱼的生物学特征。
3.2.1 体长、体质量分布及其关系 由于热带海域没有明显的季节,该水域鱼的年轮往往难以判定。但是对于生命周期短、生长快、没有年轮标志的低龄鱼类,可用体长频率初步分析其种群结构。根据体长分布大致存在3个峰,经分析后可能存在3个股群。3个股群是一年的不同生殖季节所产生,还是在一个较长的生殖季节中的年龄差异,还需通过对其日龄的进一步研究确定。通过分析其种群结构,并根据 Takagi等[17]在黑潮-亲潮过渡海域、Linkowski等[14]在东北大西洋得到的尾明角灯鱼年龄与体长的关系推算,40、50 mm体长对应的年龄前者分别为73、89 d,后者分别为6~9个月、10个月以上。根据不同的年龄-体长关系推算出相同体长的年龄差异,可能是该鱼在不同水域生长的差异,也有可能是研究方法的不同引起。此外,灯笼鱼类的较大个体逃逸率较高[18],故其体长成分分析在较大个体分布的研究中可能存在偏差。因此,南海北部陆坡水域尾明角灯鱼仍需通过对其年龄的研究进一步揭示其种群结构的特点,对此可考虑采用研究日龄的方法。热带鱼类的生长往往较快,加之其昼夜垂直移动的水层温度差异可形成日轮,经耳石的包埋打磨后可在显微镜下查看读取日龄,但该方法所花费的时间周期较长。
尾明角灯鱼的体长-体质量关系式中的b值约等于3,表明其在3个方向等速生长。与一般经济鱼类相比,灯笼鱼科的鱼类往往体长、体质量较小,因此,测量的体长、质量相对误差较大,R2较小。Gjøsaeter[19]对挪威海冰底灯鱼的研究表明,其体长-体质量关系式中参数a、b在不同季节有一定差异,R2为0.91~0.95。
3.2.2 繁殖特征 从图5可知,南海陆坡水域尾明角灯鱼在夏季已有一定比例的个体性腺发育程度处于Ⅳ期,这部分个体有可能在夏秋季产卵繁殖。而体长较大的性腺成熟度为Ⅱ期的个体性腺存在产卵后恢复至Ⅱ期的可能。Gartner[15]对东部墨西哥海湾灯笼鱼繁殖模式的研究显示,1月、5月尾明角灯鱼的性腺成熟度多为Ⅳ~Ⅴ期,且该水域的灯笼鱼类存在两种繁殖模式,一种繁殖季节可持续4~6个月,另一种则在一年中有一至两个更短的繁殖季节,而尾明角灯鱼属后者。不同种类的灯笼鱼类在不同海域的生殖季节有很大的差异,如冰底灯鱼在西北大西洋的产卵季节为1—4月[20],在东北大西洋为 6—7月[19],而在地中海则终年繁殖[21]。因此,仅根据本次研究无法判断其生殖季节。
南海陆坡水域,夏季尾明角灯鱼雌性略多于雄性,而Gartner[15]的研究结果为秋冬季雌、雄比例为1∶0.8,春夏季雌、雄比例为1∶1.33。这可能是地域差异造成的,也可能是采样范围小、时间序列短的结果。本次调查与 Gartner[15]、Linkowski 等[14]的研究结果一致,较大个体的尾明角灯鱼雌性较多。
由于尾明角灯鱼属多批次产卵类型,其繁殖季节较长甚至可能全年繁殖,本次采样并非南海北部陆坡水域尾明角灯鱼的繁殖季节,加之本研究中许多较大个体的性腺成熟度为Ⅱ期,这些个体的性腺有可能是产卵后恢复至Ⅱ期的。因此,本研究中将性腺Ⅱ期及以上个体视为已发育且具有繁殖能力的个体,并计算其性腺发育比例 (达到Ⅱ期及以上)与体长的关系式,与Gartner[15]根据Ⅲ期及以上计算的50%性成熟体长为55.28 mm比较,其结果较小。
3.2.3 摄食节律 对灯笼鱼类摄食的相关报道多见于其食物网关系的研究。在深海食物链中,尾明角灯鱼等中层鱼类是连接浮游动物和更高一级乃至顶级捕食者的关键种类,对其他海洋生物的数量变动有着直接或间接的影响[9-10]。它们的捕食行为往往依循机会主义策略,捕食其所分布水层的食物[16]。尾明角灯鱼主要捕食浮游动物,也会捕食小型鱼类,对樽海鞘的幼体表现出捕食偏好,在北太平洋的贫营养水域还会捕食藻类[11,16,22]。
关于灯笼鱼类摄食节律的相关研究较少,本研究中发现,尾明角灯鱼夜间上浮后持续捕食,在黎明下潜前平均摄食等级达到最高。目前,在夜间的3个时间点,不同体长组的摄食规律未见相关研究,该现象是由其不同大小个体摄食的差异引起,还是由其消化、昼夜垂直移动的差异引起,以及何者为主导因素,需根据系统采样及统计分析,同时结合多种研究方法加以论证。
综上所述,要明确南海陆坡水域尾明角灯鱼的分布、种群结构、繁殖特征、摄食节律等生物学特征仍需进一步研究。
[1] 陈素芝.中国动物志:硬骨鱼纲灯笼鱼目鲸口鱼目骨舌鱼目[M].北京:科学出版社,2002:5-113.
[2] Hulley P A.Order Myctophiformes[M]//Smith M M,Heemstra P C.Smiths'Sea Fishes.Berlin:Springer-Verlag,1986:282-322.
[3] Gjøsaeter J,Kawaguchi K.A review of the world's resources of mesopelagic fish[R].Rome:Food and Agriculture Organization of the United Nations,1980:1-151.
[4] Hulley P.Myctophidae[M]//Whitehead P J P,Bauchot M L,Hureau J C,et al.Fishes of the North-eastern Atlantic and the Mediterranean,Vol 1.United Kingdom:UNESCO,1984:429-483.
[5] Irigoien X,Klevjer T A,Røstad A,et al.Large mesopelagic fishes biomass and trophic efficiency in the open ocean[J].Nature Communications,2014,5:3271.
[6] Granata A,Brancato G,Sidoti O,et al.Energy flux in the South Tyrrhenian Deep-Sea ecosystem:role of mesopelagic fishes and squids[M]//Faranda F M,Guglielmo L,Spezie G.Mediterranean Ecosystems.Milan:Springer,2001:197-207.
[7] Radchenko V I.Mesopelagic fish community supplies biological pump[J].The Raffles Bulletin of Zoology,2007(S14):265-271.
[8] Sarant L.Little mesopelagic fish have big carbon capture impact [J].Nature Middle East,2014,doi:10.1038/nmiddleeast.2014. 57.
[9] Kozlov A N.A review of the trophic role of mesopelagic fish of the family Myctophidae in the Southern Ocean ecosystem[J].CCAMLR Science,1995,2:71-77.
[10] Smith A D M,Brown C J,Bulman C M,et al.Impacts of fishing low-trophic level species on marine ecosystems[J].Science, 2011,333:1147-1150.
[11] Kinzer J,Schulz K.Vertical distribution and feeding patterns of midwater fish in the central equatorial Atlantic II.Sternoptychidae [J].Marine Biology,1985,85(3):313-322.
[12] Badcock J,Merrett N R.Midwater fishes in the eastern North Atlantic I.Vertical distribution and associated biology in 30°N,23° W,with developmental notes on certain myctophids[J].Progress in Oceanography,1976,7(1):3-58.
[13] Watanabe H,Moku M,Kawaguchi K,et al.Diel vertical migration of myctophid fishes(Family Myctophidae)in the transitional waters of the western North Pacific[J].Fisheries Oceanography, 1999,8(2):115-127.
[14] Linkowski T B,Radtke R L,Lenz P H.Otolith microstructure,age and growth of two species of Ceratoscopelus(Oosteichthyes Myctophidae)from the eastern North Atlantic[J].Journal of Experimental Marine Biology and Ecology,1993,167(2):237-260.
[15] Gartner J V.Patterns of reproduction in the dominat lanternfish species(Pisces:Myctophidae)of the eastern Gulf of Mexico,with a review of reproduction among tropical-subtropical Myctophidae [J].Bulletin of Marine Science,1993,52(2):721-750.
[16] Bernal A,Olivar M P,Maynou F,et al.Diet and feeding strategies of mesopelagic fishes in the western Mediterranean[J].Progress in Oceanography,2015,135:1-17.
[17] Takagi K,Yatsu A,Moku M,et al.Age and growth of lanternfishes,Symbolophorus californiensis and Ceratoscopelus warmingii (Myctophidae),in the Kuroshio-Oyashio transition zone[J]. Ichthyological Research,2006,53(3):281-289.
[18] Kaartvedt S,Staby A,Aksnes D L.Efficient trawl avoidance by mesopelagic fishes causes large underestimation of their biomass[J].Marine Ecology Progress Series,2012,456:1-6.
[19] Gjøsæter J.Growth,production and reproduction of the myctophid fish Benthosema glaciale from western Norway and adjacent seas [J].Fiskeridirektoratets Skrifter,Serie Havundersøkelser,1981, 17(3):79-108.
[20] Mazhirina G P.Some information on the development of ovaries in Benthosema glaciale from different areas of the North Atlantic [R].NAFO Scientific Council Research Document 88/21(Serial No.N1457),1988:1-11.
[21] Tåning A V.Mediterranean Scopelidae(saurus,aulopus,chlorophthalmus and myctophum)[R].Report on the Danish Oceanographical Expeditions1908-1910 to the Mediterranean and Adjacent Seas,1918:8-45.
[22] Robison B H.Herbivory by the myctophid fish Ceratoscopelus warmingii[J].Marine Biology,1984,84(2):119-123.
[23] 夏世福,刘效舜.海洋水产资源调查手册[M].2版.上海:上海科学技术出版社,1981.
Biology of lanternfish Ceratoscopelus warmingii in waters of the northern slope in South China Sea
YANG Yu-yan1,2,YING Yi-ping2,ZHAO Xian-yong2,WANG Xin-liang2, ZHANG Jun3,CHEN Zuo-zhi3,TANG Yong1
(1.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China;2.Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China; 3.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China)
The distribution and biological characteristics of lanternfish Ceratoscopelus warmingii as an important species were studied based on the catches of mesopelagic fish survey conducted in the northern slope in the South China Sea during June of 2015.It was found that the lanternfish had body length from 30 mm to 64 mm and three cohorts with overlapping body length,(37.52±2.39),(44.62±2.84)and(49.80±3.17)mm.The relationship between body length and body weight was expressed as W=8.418×10-6L3.0985.Over half of the lanternfish with body length of 42.54 mm collected in June had gonads which developed into maturity at stageⅡand stageⅢ,with sex ratio of 1∶0.7(female∶male),smaller in male than in female.The average degree of stomach fullness (ADSF)of the lanternfish was found to be increased with time during night,with ADSF of 0.82 at 20:00,1.58 at 22:00,and 2.53 at 4:00.No lanternfish were collected at over 600 m depth during the daytime.However,a few lanternfish were caught during evening,and more fish were collected at night at over 650 m depth except one station,indicating that the diel vertical migration is one of important feature of lanternfish and that agrees with the other research results during day time most species aggregated in water deeper than 700 m depth.The findings will help to analyze the biology and distribution of the lanternfish in waters of the northern slope in South China Sea.
Ceratoscopelus warmingii;diurnal vertical migration;body length;reproduction;feeding habit;mesopelagic fish
Q954.4
A
10.16535/j.cnki.dlhyxb.2017.01.014
2095-1388(2017)01-0079-07
2016-04-15
国家重点基础研究发展计划项目 (2014CB44150)
杨雨燕 (1990—),女,硕士研究生。E-mail:cissylotus@163.com
赵宪勇 (1965—),男,博士,研究员。E-mail:zhaoxy@ysfri.ac.cn

