限制性酶解乳清蛋白功能性质研究
刘 颖,刘丽宅,于晓红,付 薇,张 丹,窦博鑫
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
限制性酶解乳清蛋白功能性质研究
刘 颖,刘丽宅,于晓红,付 薇,张 丹,窦博鑫
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
探究乳清蛋白在碱性蛋白酶限制性水解下功能性质变化。以乳清蛋白的溶解性,乳化性、乳化稳定性,起泡性、起泡稳定性为考察指标,确定乳清蛋白的等电点及分析不同水解度下乳清蛋白功能性质在pH调控下的变化。结果表明:乳清蛋白的等电点为4.8。乳清蛋白进行限制性酶解后功能性质有了很大提高,其中溶解性在DH14、pH10下达到最大值,较原蛋白提高了14.55%;起泡性在DH14、pH4下达到最大值,较原蛋白提高了107.5%;起泡稳定性在DH4、pH4下达到最大值,比原蛋白提高了8.66%;乳化性在DH14、pH12下达到最大值,比原蛋白提高了56.1%;乳化稳定性DH4、pH12下达到最大值,比原蛋白提高了50.42%。
乳清蛋白,限制性酶解,功能性质
乳清蛋白是利用现代生产工艺从牛奶中提取出来的蛋白质。乳清蛋白在牛奶中的含量仅为0.7%,可见其弥足珍贵,被称为蛋白之王[1]。乳清蛋白的主要成分是β-乳球蛋白(56%~60%)﹑α-乳白蛋白(18%~24%)﹑血清白蛋白(6%~12%)和免疫蛋白(6%~12%),此外还有少量的乳铁蛋白、过氧化物酶和生长因子等生物活性物质[2]。乳清蛋白是一种营养价值最全面的蛋白之一[3-5],它独特的氨基酸序列和三维结构[6-7]赋予它广泛的功能特性,而且营养功能极佳[8-10],这些性质对亚洲和中国的食品加工者来说是十分有益的。
国内外对乳清蛋白酶解的研究主要集中于乳清蛋白酶解条件优化[11-13],酶解物抗氧化活性[14],降低抗原性[15]等,而功能性质等问题的研究较少。所以,为了提高乳清蛋白的功能性质,并避免高水解度下苦味肽的大量产生和乳清蛋白结构被破坏,本文在较低的水解度下改性乳清蛋白,并研究乳清蛋白在pH调控下功能性质的变化,对不同水解度下的乳清蛋白的功能性质进行较全面的分析,为乳清蛋白在食品加工领域中的广泛应用奠定良好基础。
1 材料与方法
1.1 材料与仪器
WPI-9410乳清蛋白 美国HILMAR;碱性蛋白酶,测定酶活130480 U/g 诺维信(中国)公司北京办事处。
pHS-3C型精密pH计 上海雷磁仪器厂;SY-2-4型磁力恒温水浴锅 天津市欧诺仪器仪表有限公司;80-2型高速离心机 上海浦东物理光学仪器厂;LNK-871型凯氏定氮仪 上海贝特仪器有限公司;ALC-2100型电子分析天平 上海精密仪器仪表有限公司;721E型紫外可见分光光度 上海光谱仪器有限公司;DJ1C型増力搅拌器 金坛市三和仪器有限公司。
1.2 实验方法
1.2.1 乳清蛋白纯度测定 根据GB 5009.5-2010进行测定,进行3次平行实验。乳清蛋白纯度按式(1)计算。
乳清蛋白纯度(%)=样品中乳清蛋白含量(g)/称取样品质量(g)×100
式(1)
1.2.2 水解度的测定 采用pH-stat法[16-17]。自加入酶制剂始,用pH计连续监视逐滴加入0.1 mol·L-1NaOH溶液以保持反应体系pH不变,记录递加NaOH的时间和加入量。水解度的计算公式(2):
式(2)
式中:B碱液的体积(mL);Nb碱液的摩尔浓度(mol·L-1);α氨基的解离度,α=10(pH-pK)/(1+10pH-pK),其中pH是反应体系的pH,pK是反应条件下α-氨基酸解离常数(一般取7.0计算);Mp底物中蛋白质的含量(g);htot底物蛋白质中肽键总数(mmol·g-1),乳清蛋白htot=7.3477。
1.2.3 碱性蛋白酶限制性作用乳清蛋白 配制一定浓度的乳清蛋白溶液,在碱性蛋白酶最适反应条件pH9.0,50 ℃进行酶解,为了避免苦味肽大量产生,也同时提高乳清蛋白的功能性质,控制乳清蛋白的水解度小于15%,通过对添加到维持体系的0.1 mol·g-1NaOH添加量的控制对乳清蛋白的酶解过程进行控制,分别对水解度DH2、DH4、DH6、DH8、DH10、DH12、DH14下乳清蛋白的溶解性,起泡及起泡稳定性,乳化及乳化稳定性进行分析,并考察不同水解度下乳清蛋白酶解液在pH调控下功能性质变化。
1.2.4 乳清蛋白溶解性的测定 配制2%的蛋白液,25 ℃恒温振荡1 h,4000 r/min离心25 min,得上清液。采用福林酚法测定上清液中的蛋白含量[18]。每个样品重复实验3次,溶解性以NSI表示,按式(3)计算。
式(3)
1.2.5 乳清蛋白起泡性及起泡稳定性测定 配制2%的蛋白液,调节不同pH,放入250 mL的烧杯中,用高速分散器在10000 r/min转速下搅拌2 min,立即记录此时溶液上部体积(V0),静置30 min后再次记录泡沫体积[19](V1)。每个样品都重复三次实验。
式(4)
式中:FS起泡稳定性,%;V0起泡能力,mL;V1泡沫体积,mL。
1.2.6 乳清蛋白乳化性及乳化稳定性测定 乳化性及乳化稳定性的测定采用浊度法[20]。具体操作如下:
以2%(质量分数)的乳清蛋白溶液 21 mL,边搅拌边加入纯大豆色拉油 9 mL,然后以 8000~10000 r/min的速度高速匀浆 1 min制成乳状液,用微量注射器从底部抽取乳状液50 μL,放入试管中,与预先在试管中加5 mL,0.1%(质量分数)的十二烷基硫酸钠(SDS)溶液混合制成混合液,在500 nm的波长下测吸光值E0,该值为乳化活性指数(EAI),再过 10 min测吸光值Et,每个样品都重复三次实验,乳化稳定性指数(ESI)按公式(5)计算:
式(5)
式中:E0乳化活性指数;Et 10 min后的吸光度值;t 10 min。
1.2.7 数据统计与处理 在SPSS 17.0软件和Excel中进行数据处理和分析。
2 结果与分析
2.1 乳清蛋白纯度测定
经公式(1)计算后得:乳清蛋白的纯度为93.24%,试剂包装标注乳清蛋白>90%,测定值与乳清蛋白包装标注相同。
2.2 乳清蛋白溶解性及等电点测定
经过3次平行实验确定乳清蛋白的等电点为4.8,与陈静廷[21]等的结果一致,在等电点处乳清蛋白的溶解度为50.08%。
图1 福林酚法测定蛋白质标准曲线Fig.1 The Folin method for the determination of protein standard curve

图2 乳清蛋白等电点处溶解性曲线Fig.2 Whey protein solubility curve at isoelectric point
通过对不同pH下乳清蛋白各水解度下溶解性曲线图3所示,各水解度下乳清蛋白的溶解性随着pH的增加基本呈现上升趋势,当DH>8,pH>10时,乳清蛋白的溶解性下降,这是因为随着水解度的增加,不溶性乳清蛋白被分解成可溶性小分子蛋白,这些可溶的小分子蛋白在高pH下会发生变性,影响了乳清蛋白溶解性。

图3 不同pH下乳清蛋白各水解度下溶解性曲线Fig.3 Whey protein solubility curve under different degree of hydrolysis and pH
pH4处距离乳清蛋白的等电点接近,在此pH条件下碱性蛋白酶限制作用下的乳清蛋白的溶解性在分析水解度下有了很大提高,DH14时溶解性可达到83.14%,这是因为乳清蛋白在碱性蛋白酶作用下,结构发生变化,产生的一些可溶性蛋白的等电点较原来乳清蛋白发生一些偏移,使得等电点处的乳清蛋白溶解性增大。

图4 不同DH下乳清蛋白酶解物溶解性曲线Fig.4 Whey protein solubility curve under different degree of hydrolysis
在极端pH(pH2和pH12)下,乳清蛋白的溶解性随着水解度的增加呈现下降趋势,这是因为在此pH下乳清蛋白及水解作用产生的小分子可溶性蛋白会部分变性,影响其溶解性。
当DH达到14时,pH10下乳清蛋白的溶解性达到分析范围内的最大值为96.42%;较原蛋白在此pH下的溶解性提高了14.55%。
2.3 乳清蛋白起泡性测定
通过对不同pH下乳清蛋白各水解度下起泡性曲线图5可知,乳清蛋白的起泡性随着pH的变化呈现不同变化;当pH<4时在轻度水解下(DH0~DH2)下乳清蛋白因pH偏离等电点,起泡性增加;这是因为乳清蛋白结构相对其他水解度下较稳定,偏离等电点处会使乳清蛋白的溶解性大大提高,从而使可溶的乳清蛋白含量增加,起泡性增大。

图5 不同pH下乳清蛋白各水解度下起泡性曲线Fig.5 Whey protein foaming curve under different degree of hydrolysis and pH
随着水解程度的不断加大(DH4~DH14),在pH4即等电点附近,乳清蛋白的起泡性随着pH的降低呈现下降趋势,这是因为在等电点出一些可溶的乳清蛋白具有很好的溶解空气的能力,这些可溶的乳清蛋白分子提高了气-液界面的交互能力,从而提高了其起泡能力,当pH降低达到极端条件下,这些因水解作用而产生的可溶乳清蛋白分子特性受pH影响显著,发生改变,从而影响其起泡性。
当pH>4时,乳清蛋白随着水解度程度的增加起泡性呈现不同变化;在DH0~DH4之间,乳清蛋白的起泡性随着pH的增加呈现上升趋势,这是因为乳清蛋白随着pH的增加溶解性增大,而溶解性影响乳清蛋白的起泡性[18],此条件下溶解性的影响大于pH的影响;在DH6~DH8之间,乳清蛋白的起泡性随着pH的增加先增大后减少,当pH达到10时达到最大值,当pH达到12极端条件下,乳清蛋白的起泡性下降,且下降幅度大,这是因为随着水解度的增加,一些不溶的乳清蛋白分子在碱性蛋白酶的作用下变为可溶的小分子蛋白,这些小分子蛋白受pH的影响显著,极端pH下结构不稳定,从而影响其起泡性;当DH10~DH14之间,水解程度的增大使乳清蛋白在pH10处起泡性开始下降,当在极端pH下下降程度很大,说明了因碱性蛋白酶作用产生的小分子可溶蛋白受pH的影响显著。
在pH为4时,即等电点附近,乳清蛋白的起泡性随着碱性蛋白酶作用程度的增大提高幅度明显,且在分析范围内的水解度下起泡性一直在提高。这是说明碱性蛋白酶可以使乳清蛋白中不溶性蛋白变为可溶性蛋白,可溶性蛋白的提高直接影响乳清蛋白的起泡性。
通过对不同DH下乳清蛋白起泡性曲线图6可知,在酸性条件下(pH<7),乳清蛋白的起泡性随着酶作用程度的增加不断提高,但是当DH达到14时,在pH2下开始下降,下降趋势较小,这是因为水解程度加大,产生的小分子蛋白在极端pH下特性变化引起。当在碱性条件下(pH>7),当pH为8时,在DH12下乳清蛋白的起泡性达到分析范围内的最大值,随着水解程度的增加,起泡性降低;当pH为10时,在DH8下乳清蛋白的起泡性达到分析范围内的最大值,随着水解程度的增加,起泡性降低;当pH为12时,在DH4下乳清蛋白的起泡性达到分析范围内的最大值,随着水解程度的增加,起泡性降低,这说明了乳清蛋白随着碱性蛋白酶作用程度的加大,起泡性受pH影响越来越大。经过碱性蛋白酶作用后的乳清蛋白的起泡性有了很大提高,在DH14,pH4下乳清蛋白的起泡性能力达到最值83 mL。

图6 不同DH下乳清蛋白酶解物起泡性曲线Fig.6 Whey protein foaming curve under different degree of hydrolysis
2.4 乳清蛋白起泡稳定性性测定
通过对不同pH下乳清蛋白各个水解度下起泡稳定性曲线图7可知,乳清蛋白在pH为4下即等电点附近,起泡稳定性在分析范围内各个水解度下达到最大值,这是因为此处溶解的乳清蛋白在界面上锁形成的界面膜的稳定性最好,且此处乳清蛋白之间的静电排斥作用小,有利于泡沫的稳定。这与彭新颜在乳清蛋白的功能性质研究中的结果一致[20]。

图7 不同pH下乳清蛋白各水解度下起泡稳定性曲线Fig.7 Rice bran protein foam stability curve under differentdegree of hydrolysis and pH
在极端pH下乳清蛋白的泡沫稳定性下降程度大,在此条件下,随着水解程度的增大,起泡稳定性变差,这是因为经过碱性蛋白酶的作用后,产生的可溶的小分子蛋白在极端pH下所形成的界面膜的稳定能力弱,稳定泡沫的能力大幅度下降。
通过对不同DH下乳清蛋白起泡稳定性曲线图8可知,乳清蛋白经过碱性蛋白酶作用后起泡稳定性有了提高,在DH4下达到最大值。
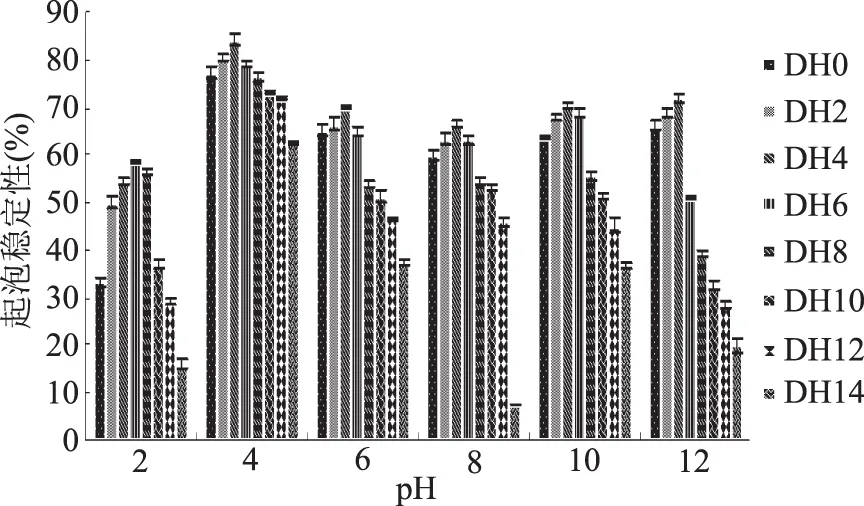
图8 不同DH下乳清蛋白起泡稳定性曲线Fig.8 Whey protein foam stability curve under different degree of hydrolysis
乳清蛋白的起泡稳定性随着水解程度的增加呈现先增后减的趋势,DH0~DH4之间,起泡稳定性在各个pH条件下均提高;DH6~DH14之间,起泡稳定性开始下降;这是因为水解度的增大,产生的小分子由于受pH的影响,特性发生变化,稳定泡沫的能力降低所致。综上所述,在DH4、pH4下乳清蛋白的起泡稳定性达到最大值为84.21%。
2.5 乳清蛋白乳化性测定
通过对不同pH下乳清蛋白乳化性曲线图9可知,乳清蛋白经过碱性蛋白酶作用后乳化活性在pH≥4下随着pH增加乳化活性增高,pH<4下,偏离等电点处,乳化活性提高,等电点处乳清蛋白在分析水解度的范围内乳化活性最低;这是因为一方面由于溶解性在蛋白质的乳化活性方面起着重要作用,随着溶解性的增加其乳化能力也在增强,但这不是绝对增加的;另一方面,乳清蛋白在酶水解后产生的小分子蛋白随着pH的增加其分子的空间结构发生变化,部分包埋在分子内部的疏水基团暴露出来,促进了蛋白分子亲水疏水性质的平衡,因此提高了乳化活性。
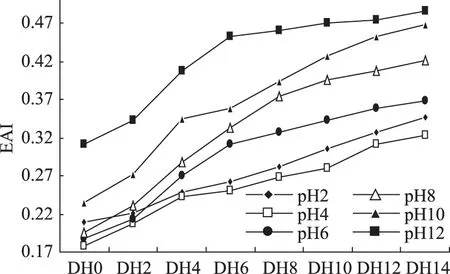
图9 不同pH下乳清蛋白各水解度下乳化活性曲线Fig.9 Whey protein emulsifying activity curve under different degree of hydrolysis and pH
通过对不同DH下乳清蛋白乳化稳定性曲线图10可知,乳清蛋白经过碱性蛋白酶限制作用下乳化活性不断提高;这是因为随着水解程度的增大,乳清蛋白质分子表面的疏水基团及分子大小发生变化,疏水基团逐渐暴露,有利于和油滴的结合,从而提高了乳清蛋白的乳化能力。在DH14,pH12时乳清蛋白的乳化活性达到最大值0.487,比原料蛋白在此pH下的乳化活性提高了56.1%。
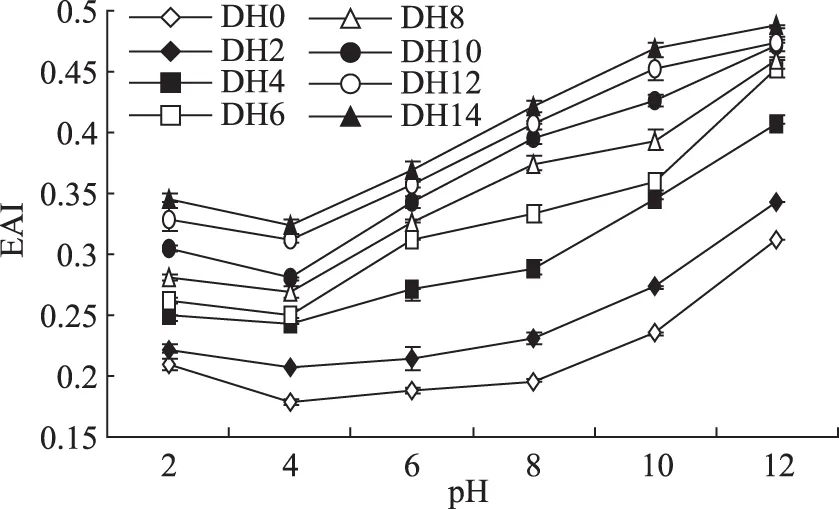
图10 不同DH下乳清蛋白乳化活性曲线Fig.10 Whey protein emulsifying activity curve under different degree of hydrolysis
2.6 乳清蛋白乳化稳定性测定
通过对不同pH下乳清蛋白各水解度下乳化稳定性曲线图11可知,乳清蛋白经过碱性蛋白酶作用在pH≥4时乳化稳定性不断提高,pH<4偏离乳清蛋白等电点时乳化稳定性增高;这说明了乳清蛋白的溶解性和乳化稳定性具有一定关系,碱性条件下,乳清蛋白的溶解性增加致使更多的蛋白分子在界面上结合油滴,形成更为稳定的油水两相蛋白质层,从未增加乳清蛋白的乳化稳定性。
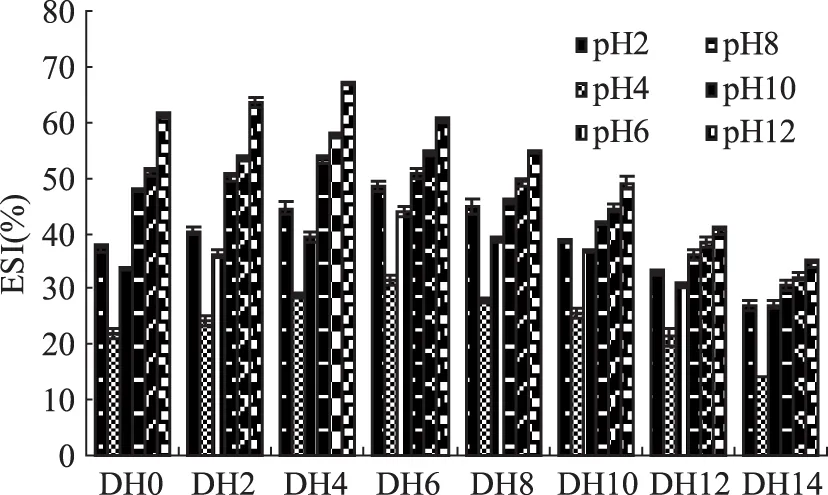
图11 不同pH下乳清蛋白各水解度下乳化稳定性曲线Fig.11 Whey protein emulsion stability curve under different degree of hydrolysis and pH
通过对不同DH下乳清蛋白乳化稳定性曲线图12可知,乳清蛋白经过碱性蛋白酶作用后乳化稳定性有了提高,随着水解程度的进行,乳化稳定性下降。当在酸性条件下(pH<7)时,乳清蛋白的乳化稳定性先增加后降低,在DH6下达到最高;在碱性条件下(pH>7)时,乳清蛋白的乳化稳定性先增加后降低,在DH4下达到最高;随着水解进程的加大,乳化稳定性开始下降,且随着水解进程的加大下将程度加大。在DH4、pH12时,乳化稳定性达到最大值66.89%。以上现象是因为乳清蛋白在碱性蛋白酶作用下分子的体积降低,导致离子化基团的数量增加同时使基团分布变广,在水解度较小时,随着水解度的增加乳清蛋白质中疏水基团外露,液珠中蛋白分子与油滴的吸引作用增强,从而使乳清蛋白乳状液的稳定性增加;但随着水解进程的增大,乳清蛋白分子中疏水区域的结构遭到破坏,乳清蛋白小分子中疏水区域比例相对减小,形成的乳状液稳定性降低。
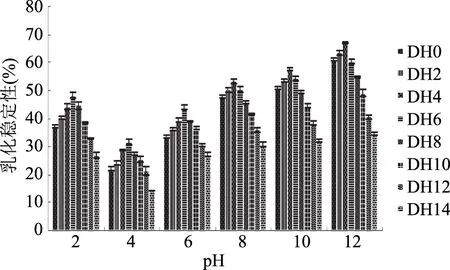
图12 不同DH下乳清蛋白乳化稳定性曲线Fig.12 Whey protein emulsion stability curve under different degree of hydrolysis
3 结论
乳清蛋白经过限制性酶解后溶解性较好,在DH14、pH10下达到最大值96.42%;起泡性在DH14,pH4下达到最大值83 mL,起泡稳定性在DH4、pH4下达到最大值84.21%;乳化活性在DH14、pH12下达到最大值0.487,乳化稳定性在DH4、pH12下达到最大值66.89%;乳清蛋白经过限制性酶解后功能性质较原蛋白均有很大提高。经过限制性酶解后的酶解物具有很高的泡沫膨胀性能,并对剪切变性有一定的耐受性。起泡性对于生产冷冻食品、蛋糕、饼干及奶糖等均有重要意义。酶解物乳化性能比原蛋白更易在在脂肪球和水滴之间形成一层界面膜从而防止乳状液分层及凝聚沉淀,因此其更易应用于人造黄油、海鲜食品、冰淇淋及蛋糕中。
[1]任雁,赵丹,张烨,等.乳清蛋白的功能成分及其主要应用[J].中国食品添加剂,2007(1):142-146.
[2]王国荣.优先降解乳清蛋白中β-乳球蛋白工艺的研究[D]. 北京:中国农业大学,2007.
[3]包怡红.功能性乳清的综合利用[J].食品与机械,2001(1):9-11.
[4]Rawdkuen S,Benjakul S. Whey protein concentrate:autolysisinhibition and effects on the gel properties of surimi prepared fromtropical fish[J]. Food Chemistry,2008,106(3):1077-1084.
[5]崔旭海,孔保华.自由基氧化的乳清蛋白在冰淇淋中的应用[J].食品科学,2009(20):160-164.
[6]美国乳品出口协会.美国乳清蛋白的应用研究和最新进展[J].中国食品添加剂,2008(3):26-32.
[7]Sakurai K,Konuma T,Vagi M,et al. Structural dynamics and folding of beta-lactoglobulin probed by heteronuclear NMR[J]. Biochimica Biophysica Acta,2009,l790:527-557.
[8]刘晶,韩清波.乳清蛋白的特性及应用[J].食品科学,2007(7):535-537.
[9]李飞,刘红娟,王龙.乳清蛋白功能活性的研究[J].中国酿造,2015(7):20-23.
[10]韩雪,孙冰.乳清蛋白的功能特性及应用[J].中国乳品工业,2003(3):28-30.
[11]孙洋,钱方,赵磊,等.乳清蛋白酶解条件优化[J].食品与机械,2015(1):199-203.
[12]包怡红,王振宇,王军,等.乳清蛋白的酶解及其性质研究[J].食品科学,2003(9):63-65.
[13]刘利军,赵征.酶法水解乳清蛋白过程的优化[J].天津科技大学学报,2005(3):9-11,16.
[14]彭新颜,孔保华,熊幼翎.由碱性蛋白酶制备的乳清蛋白水解物抗氧化活性的研究[J].中国乳品工业,2008(4):8-12,47.
[15]卞蓉霞.微波辅助酶解乳清蛋白的研究[D].无锡:江南大学,2013.
[16]K C Cheng,C C Lee,G Brown. Production and nutritional evaluation of high-protein rice flour[J]. J of Food Sci,2006(51):464-467.
[17]吴有炜.实验设计与数据处理[M].苏州:苏州大学出版社,2002.
[18]Willian J L. Enzymatic production of protein Hydrolysates for Food Use[J]. Food Tech,2004(10):68-71.
[19]Kato A,Nakai S. Hydrophobicity determined by a fluorescence probe methods and its correlation withsurface propertied of proteins[J]. Biochimica et Biophysica Acta,1980,624:13-20.
[20]陈静廷,卜登攀,马露,等.不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析[J].食品科学,2014,20:180-184
[21]奚海燕.大米蛋白质的提取及改性研究[D].无锡:江南大学,2008.
[22]刁静静,孔保华,彭新颜,等.乳清蛋白水解物功能性质的研究[J].食品科技,2010(35):89-93.
Study on limited enzymatic hydrolysis of whey protein and functional properties
LIU Ying,LIU Li-zhai,YU Xiao-hong,FU Wei,ZHANG Dan,DOU Bo-xin
(College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Explored the whey protein functional properties change under alkaline protease restrictive hydrolysis. Using whey protein solubility,emulsification and emulsion stability,foaming and foaming stability as indicators and determined the whey protein isoelectric point and analyzed different degree of hydrolysis of whey protein different functional properties under the pH. The results showed that whey protein isoelectric point was 4.8. Whey protein functional properties had greatly improved under limited enzymatic hydrolysis. Hydrolysis reached the maximum under DH14,pH10,higher than native protein 14.55%,foaming reached the maximum higher than native protein 107.5% under DH14,pH4,foaming stability reached the maximum under DH4,pH4 higher than native protein 8.66%;emulsifying reached the maximum under DH14,pH12 higher than native protein 56.1%,emulsion stability reached the maximum under DH4,pH12 higher than native protein 50.42%.
whey protein;limited enzymatic hydrolysis;functional properties
2016-07-20
刘颖(1968-),女,博士,教授,研究方向:食品生物技术,E-mail:18846169360@163.com。
黑龙江省应用技术研究与开发计划项目(GC13C112)。
TS252.1
A
:1002-0306(2017)04-0127-06
10.13386/j.issn1002-0306.2017.04.016

