转基因大豆DAS444066多重荧光定量PCR检测方法的建立
付 伟,任 娇,魏 霜,袁俊杰,周广彪,吴希阳,朱水芳,刘中勇,*
(1.中国检验检疫科学研究院,北京 100176;2.汕头出入境检验检疫局,广东汕头 515041;3.湛江出入境检验检疫局,广东湛江 835000;4.暨南大学理工学院食品科学与工程系,广东广州 510632)
付 伟1,任 娇2,魏 霜2,袁俊杰3,周广彪2,吴希阳4,朱水芳1,刘中勇2,*
(1.中国检验检疫科学研究院,北京 100176;2.汕头出入境检验检疫局,广东汕头 515041;3.湛江出入境检验检疫局,广东湛江 835000;4.暨南大学理工学院食品科学与工程系,广东广州 510632)
本文针对大豆内源基因Lectin和转基因大豆DAS44406-6品系的5′端插入位点序列,设计特异性引物及探针,建立同时检测转基因大豆DAS44406-6品系和大豆内源基因Lectin的多重荧光定量PCR方法,并运用15种转基因大豆、3种转基因玉米、1种转基因油菜、1种转基因水稻和非转基因大豆对该方法进行特异性评价,并分析该方法的灵敏度和稳定性。结果显示,该方法能准确从20种转基因样品和1种非转基因样品中检出靶目标,检测结果与待检样品信息一致,表明本方法具有良好的特异性;灵敏度高达0.01%;重复性实验表明DAS81419品系4种含量、9次重复反应Ct值的标准偏差介于0.050~0.222,相对标准偏差介于0.169%~0.677%,均在可接受范围内。该方法特异性强、灵敏度高、稳定性强,适用于各口岸实验室进行转基因大豆DAS44406-6的快速、准确的检测。
多重荧光定量PCR,转基因大豆DAS44406-6,检测
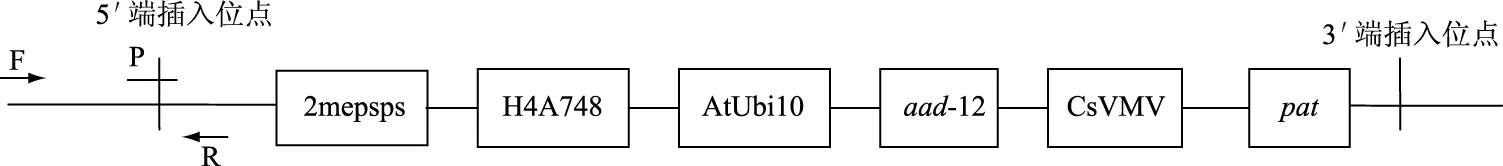
图1 转基因大豆DAS44406-6外源插入片段示意图及特异性引物探针位点Fig.1 Insertion scheme of GM soybean DAS44406-6 and the corresponding location of specific primer and probe
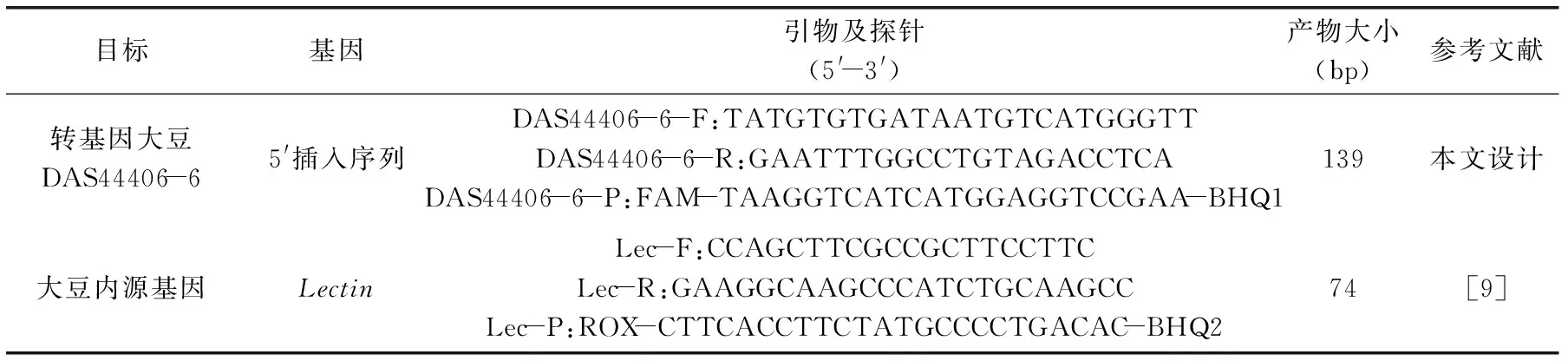
表1 引物探针序列Table 1 Sequence of primers and probes
自1996年转基因作物开始商业化种植以来,每年都以惊人的速度发展。2015年全球转基因作物的种植面积为1.797亿公顷,与1996年的170万公顷相比增加了100倍,而转基因大豆是种植面积最大的转基因作物[1]。中国是大豆和大豆产品进口国,国内需求量不断增加引起转基因大豆进口量屡创新高[2]。2002年,我国农业部发布《农业转基因生物标识管理办法》及卫生部出台《转基因食品卫生管理办法》,规定转基因食品必须强制性的进行转基因标识[3]。正因如此,对转基因大豆检测技术的要求也越来越高。
目前为止,被批准进入中国的转基因大豆品系只有10种(A2704-12、A5547-127、CV127、DP305423、DP305423×GTS40-3-2、DP356043、GTS40-3-2、MON87701、MON87701×MON89788、MON89788),转基因大豆DAS44406-6没有获得我国批准。转基因大豆DAS44406-6是美国陶氏益农公司研发的抗除草剂转基因大豆,主要含有3个抗除草剂基因2mepsps、pat、aad-12,能同时耐受草铵膦、草甘膦和2,4-D除草剂。然而,目前我国没有转基因大豆DAS44406-6的检测标准方法,不利于口岸实验室开展非法转基因品系的把关检测。因此,建立转基因大豆DAS44406-6的检测方法具有相当的意义。
转基因大豆的检测方法主要是基于核酸的检测技术,主要有PCR法[4-5]、多重PCR[6-7]、荧光定量PCR法[8]、数字PCR[9]、芯片法[10]、等温扩增法[11-13]等。其中荧光定量PCR技术具有快速、灵敏、准确、污染少、无需凝胶电泳等优点,被广泛应用于转基因大豆成分的定量检测,并且欧盟转基因标准及我国出入境检验检疫行业标准和国家标准也均采用该方法进行检测[14-15]。此外,转基因大豆成分DAS44406-6实际检测中,通常需要同时检测大豆内源基因,而多重PCR能在同一反应体系中复合扩增,可高效同时检测出多个基因,方便快捷。因此,本研究旨在建立一套同时检测转基因大豆DAS44406-6和大豆内源基因Lectin的单管多重荧光定量PCR,为出入境检验检疫口岸实验室转基因大豆检测提供新思路,为加强转基因产品监管力度提供技术支持。
1 材料与方法
1.1 材料与仪器
转基因大豆GTS40-3-2、A2704-12、MON89788、A5547-127、DP-356043-5、CV127、MON87708、FG72、DAS44406-6、DAS68416、MON87701、MON87705、DP-305423-1、MON87769、DAS81419,转基因玉米BT176、MON810、T25,转基因油菜GT73,转基因水稻TT51-5,非转基因大豆 上述样品均保存于中国检验检疫科学研究院;TaqMan® Universal PCR Master Mix 美国ABI公司。
Roche Lightcycler 480荧光定量PCR仪 瑞士Roche公司;NanoDrop核酸蛋白分析仪 美国Thermo公司。
1.2 实验方法
1.2.1 基因组DNA的提取 采用CTAB法[16]提取1.1中转基因和非转基因样品的基因组DNA,提取后取1 μL用核酸蛋白分析仪测定提取的基因组DNA的浓度和纯度,用TE将所有样品标定至100 ng/μL,保存于-20 ℃待用。
1.2.2 引物及探针 根据转基因大豆DAS44406-6的5′端插入序列设计引物和探针,引物和探针位点如图1所示,将设计的引物和探针在NCBI中进行比对,确定引物和探针的理论特异性,大豆内源基因引物和探针参考文献。上述所有引物及探针由生工生物工程(上海)股份有限公司合成(见表1)。
1.2.3 多重荧光定量PCR反应体系 多重荧光定量PCR反应体系包括2×TaqMan® Universal Master Mix 10 μL,各引物终浓度均为0.4 μmol/L,各探针终浓度均为0.2 μmol/L,DNA模板100 ng,ddH2O补足至20 μL。反应程序为:50 ℃ UNG酶处理2 min;95 ℃预变性10 min;95 ℃15 s,60 ℃ 1 min,40个循环,每个循环结束后收集荧光信号。
1.2.4 多重荧光定量PCR特异性实验 以1.2.1提取的15种转基因大豆、3种转基因玉米、1种转基因油菜、1种转基因水稻的基因组DNA为模板,并以非转基因大豆的基因组DNA为模板作为阴性对照,按照1.2.3的反应体系及程序进行荧光定量PCR扩增。同时以转基因大豆DAS44406-6欧盟标准方法[14]中的引物和探针作为特异性验证的阳性对照。
1.2.5 多重荧光定量PCR灵敏度测试 以1.2.1提取的转基因大豆DAS44406-6和非转基因大豆的基因组DNA为材料,按照一定的体系分数进行混合,分别配制成转基因大豆含量为100%、10%、1%、0.1%、0.01%、0.001%的样品,以1.2.3的反应体系进行多重荧光定量PCR,每个浓度梯度重复3次,以确定本方法检测方法的灵敏度。
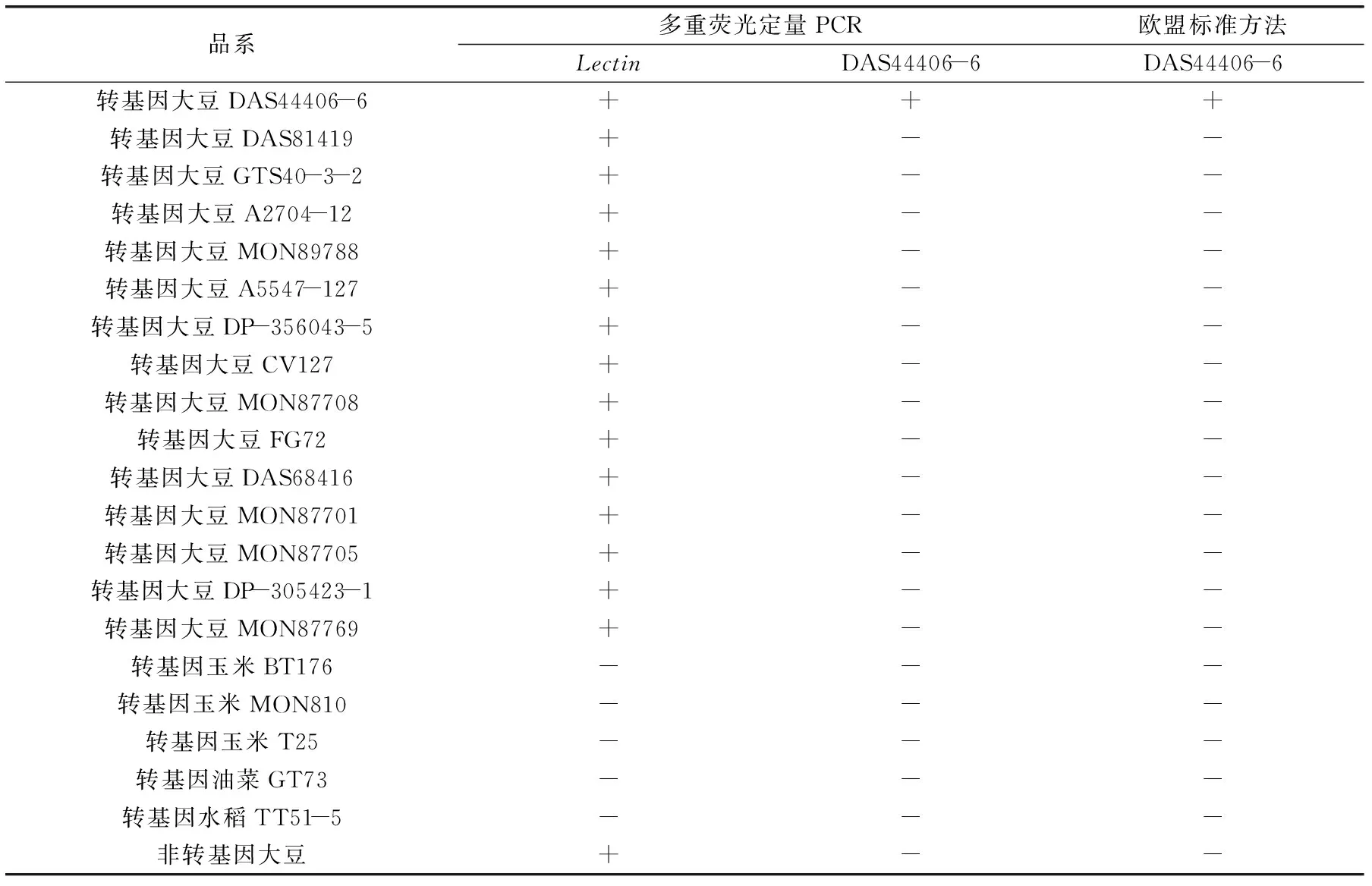
表2 多重荧光定量PCR特异性验证Table 2 Specificity test of the multiplex real-time PCR
注:+代表阳性,-代表阴性。
1.2.6 多重荧光定量PCR重复性实验 对1.2.5种配置成的转基因大豆含量为100%、10%、1%、0.1%的样品,以1.2.3的反应体系进行多次荧光定量PCR,每个浓度重复9次,计算这4个浓度、每个浓度9次重复的标准偏差(SD)和相对标准偏差(RSD),进行统计学分析。
2 结果与分析
2.1 多重荧光定量PCR的建立
调整2对引物和探针的浓度,引物浓度调整范围为0.5、0.4、0.3、0.2 μmol/L,探针浓度调整范围为0.2、0.15、0.1、0.05 μmol/L,最终确定2对引物的浓度均为0.4 μmol/L,2条探针的浓度均为0.1 μmol/L,建立了多重荧光定量PCR检测转基因大豆DAS44406-6,结果如图2所示,2个基因均顺利扩增,阴性对照无扩增。
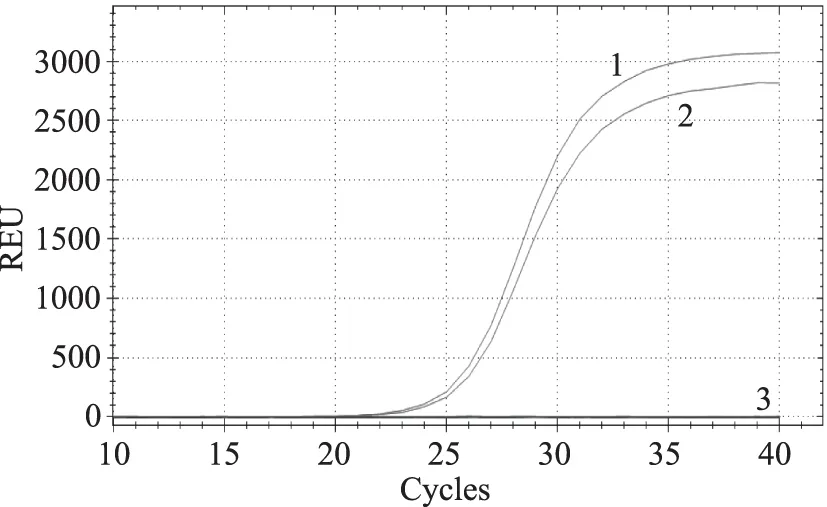
图2 多重荧光定量PCR的建立Fig.2 Establish of the multiplex real-time PCR
2.2 多重荧光PCR特异性实验
结果如表2所示,所有的转基因大豆和非转基因大豆样品Lectin基因结果均为阳性,其余样品Lectin基因结果均为阴性;仅有转基因大豆DAS44406-6样品出现DAS44406-6品系特异性阳性结果,其余样品均为阴性,品系特异性结果与欧盟标准方法一致。上述结果表明本研究建立的多重荧光定量PCR检测方法对大豆内源基因Lectin及转基因大豆DAS44406-6品系均表现高特异性。
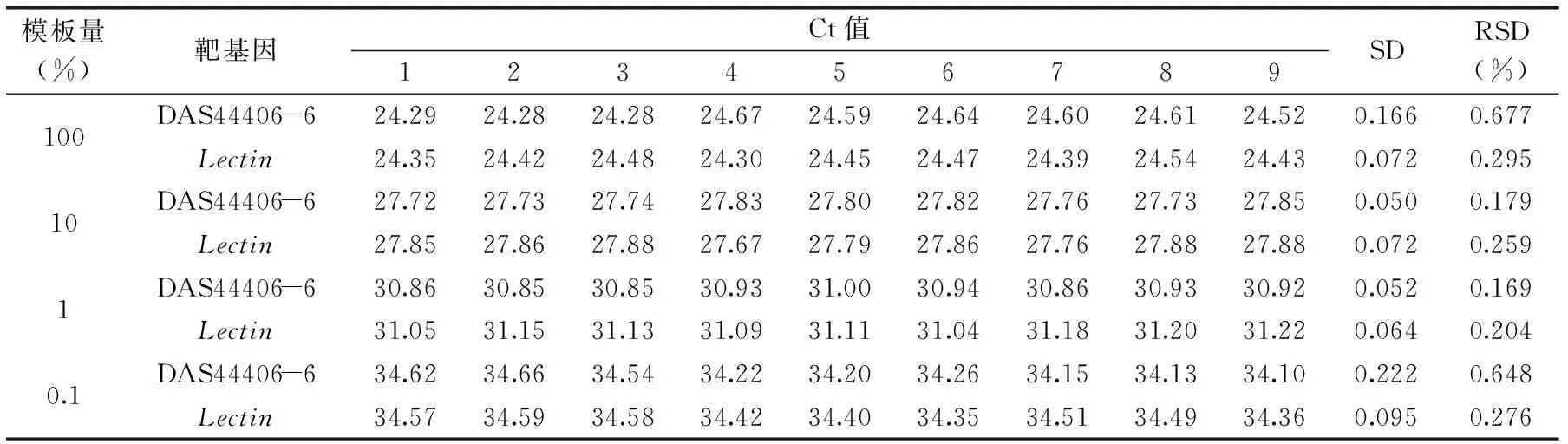
表3 多重荧光定量PCR体系的重复性实验Table 3 Reproducible test of the multiplex real-time PCR
2.3 多重荧光PCR灵敏度测试
如图3所示,当模板含量为100%~0.001%时,大豆内源基因Lectin以及转基因大豆DAS44406-6品系均可观察到扩增曲线,且模板含量与Ct值成比例关系,当模板含量为100%~0.01%时,每个含量的2个基因、3次重复均能顺利扩增,而当模板含量为0.001%时,均无扩增,因此本方法同时检出Lectin内源基因以及DAS44406-6品系的最低检出限为0.01%。许多国家实施转基因食品标识管理制度,将转基因食品和传统食品区分开来,从而保障消费者的知情权和选择权,并且规定食品中含有的转基因生物成分不能超过一定的阈值。不同国家对转基因标识阈值规定不同,例如欧盟为0.9%(转基因成分来源获得欧盟批准)和0.5%(转基因成分来源未获得欧盟批准)[17];巴西、澳大利亚、捷克、沙特阿拉伯、以色列为1%[18];瑞士、韩国为3%[19];日本、俄罗斯、泰国、中国台湾地区为5%[20]。标识管理制度能否有效实施依赖于转基因产品检测技术,这就要求对转基因产品的检测技术要能够进行精确定量。本研究中转基因大豆DAS44406-6和大豆内源基因Lectin的扩增条件一致,且检测灵敏度可以达到0.01%,完全可以满足国际上对转基因食品检测低限的要求。
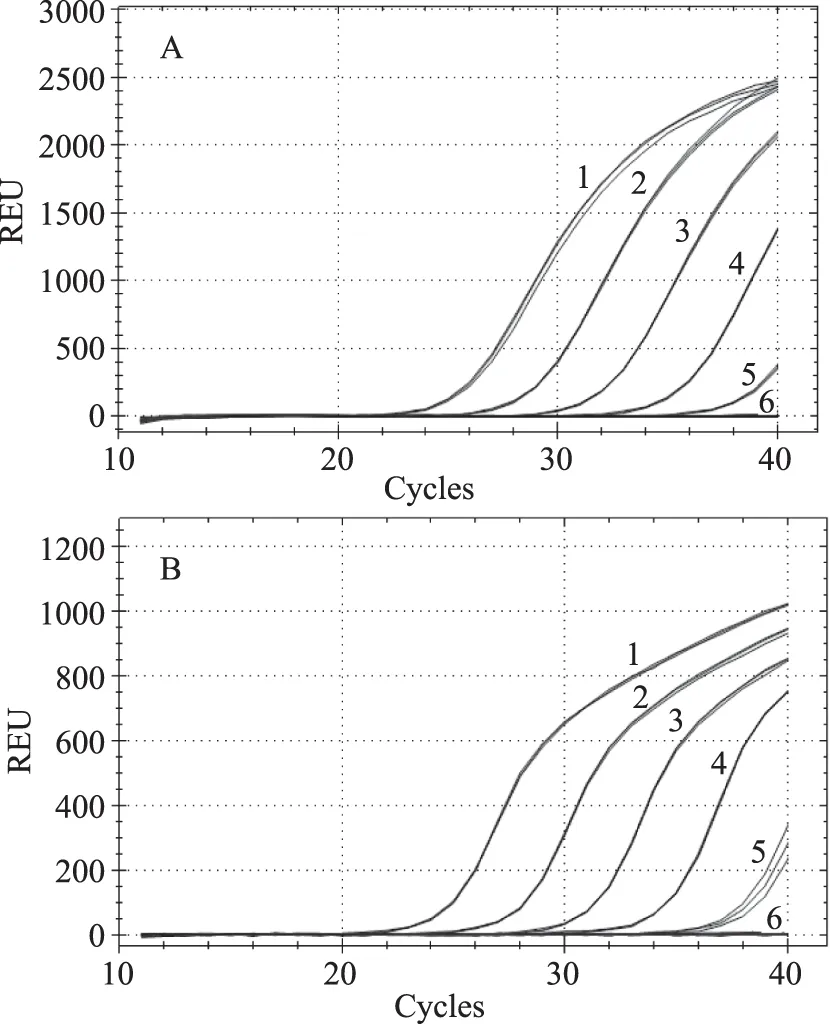
图3 多重荧光定量PCR灵敏度测试Fig.3 Sensitivity test of the multiplex real-time PCR
2.4 多重荧光PCR重复性测试
对100%、10%、1%、0.1%转基因大豆DAS44406-6共4个含量,每个浓度9次重复的扩增结果进行分析。结果表明,Lectin基因4种含量、9次重复反应Ct值的标准偏差介于0.064~0.095,相对标准偏差介于0.204%~0.295%;DAS81419品系4种含量、9次重复反应Ct值的标准偏差介于0.050~0.222,相对标准偏差介于0.169%~0.677%,均在可接受范围内[17-20],表明本研究建立检测方法具有比较好的可重复性。
3 结论
针对目前我国没有建立标准的转基因大豆DAS44406-6,采用大豆内源基因Lectin作为指示PCR反应假阳性的有效方式,针对大豆内源基因Lectin和转基因大豆DAS44406-6品系的5′端插入位点序列,设计特异性引物及探针,建立一种多重荧光定量PCR方法,在单一反应管内同时检测转基因大豆DAS44406-6和大豆内源基因Lectin两种基因,并运用15种转基因大豆、3种转基因玉米、1种转基因油菜、1种转基因水稻和非转基因大豆对该方法进行特异性评价,灵敏度高达0.01%,重复性实验表明DAS81419品系4种含量、9次重复反应Ct值的标准偏差介于0.050~0.222,相对标准偏差介于0.169%~0.677%,均在可接受范围内,该方法提高了转基因检测效率,有较好的推广和应用前景。
[1]Clive James. 2015年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2016,36(4):1-11.
[2]崔宁波,张正岩. 转基因大豆研究及应用进展[J]. 西北农业学报,2016,26(8):1-13.
[3]中华人民共和国农业部. 农业转基因生物标识管理办法[Z].北京:中华人民共和国农业部,2002.
[4]吕山花,常汝镇,陶波,等. 抗草甘膦转基因大豆PCR检测方法的建立与应用[J]. 中国农业科学,2003(8):883-887.
[5]Gachet E,Martin G G,Vigneau F,et al. Detection of genetically modified organisms(GMOs)by PCR:a brief review of methodologies available[J]. Trends in Food Science & Technology,1998,9(11):380-388.
[6]Sint D,Raso L,Traugott M. Advances in multiplex PCR:balancing primer efficiencies and improving detection success[J]. Methods in Ecology and Evolution,2012,3(5):898-905.
[7]魏霜,陈贞,芦春斌,等. 多重PCR检测转基因水稻的转基因成分[J]. 食品科学,2012(12):159-162.
[8]王渭霞,赖凤香,洪利英,等. 实时定量PCR检测转基因水稻科丰6号插入拷贝数和转基因含量[J]. 农业生物技术学报,2012(1):9-15.
[9]Fu W,Zhu P,Wang C,et al. A highly sensitive and specific method for the screening detection of genetically modified organisms based on digital PCR without pretreatment[J]. Scientific Reports,2015,5.
[10]Fu W,Wang H,Wang C,et al. A high-throughput liquid bead array-based screening technology for Bt presence in GMO manipulation[J]. Biosensors and Bioelectronics,2016,77:702-708.
[11]朱琳峰,彭焕,黄文坤,等. 抗草甘膦转基因大豆Cp4-epsps基因快速简便的LAMP检测方法[J]. 植物保护,2015(3):86-92.
[12]Huang S,Xu Y,Yan X,et al. Development and application of a quantitative loop-mediated isothermal amplification method for detecting genetically modified maize MON863[J]. Journal of the Science of Food and Agriculture,2015,95(2):253-259.
[13]Xu J,Zheng Q,Yu L,et al. Loop-mediated isothermal amplification(LAMP)method for detection of genetically modified maize T25[J]. Food Science & Nutrition,2013,1(6):432-438.
[14]http://gmo-crl.jrc.ec.europa.eu/summaries/EURL-VL-0112%20VR_Final.pdf[OL].
[15]中国检验检疫科学研究院. 植物及其加工产品中转基因成分实时荧光PCR定性检验方法[S].
[16]王永,兰青阔,张莉,等. 改良Chelex-100法和CTAB法用于转基因抗草甘膦大豆检测效果的比较[J]. 大豆科学,2008(5):898-901.
[17]The European Parliament and the Council of the European Union. Regulation(EC)No 1829/2003 of the European Parliament and of the Council of 22 September 2003 on genetically modified food and feed[J]. Official Journal of the European Communities,2003(L268):1-23.
[18]赵将,生吉萍. 转基因食品标识的问题与困惑[J]. 中国农业大学学报,2015,20(3):1-8.
[19]Chung S A,Francom M G,Ting K. 韩国农业生物技术年报(2011年)[J]. 生物技术进展,2013,1:15.
[20]金芜军,贾士荣,彭于发. 不同国家和地区转基因产品标识管理政策的比较[J]. 农业生物技术学报,2004,12(1):1-7.
Multiplex real-time PCR for the detection of genetically modified soybean DAS44406-6
FU Wei1,REN Jiao2,WEI Shuang2,YUAN Jun-jie3,ZHOU Guang-biao2,WU Xi-yang4,ZHU Shui-fang1,LIU Zhong-yong2,*
(1.Chinese Academy of Inspection and Quarantine,Beijing 100176,China;2.Shantou Entry-Exit Inspection and Quarantine Bureau,Shantou 515041,China;3.Department of Food Science and Engineering,College of Science and Technology,Jinan University,Zhanjiang 835000,China;4.Zhanjiang Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510632,China)
Specific primers and probes based on the 5′ flanking sequence of exogenous fragments of genetically modified(GM)soybean DAS44406-6 and endogenousLectingene of soybean were designed. A multiplex real-time PCR for the detection of GM soybean DAS44406-6 and endogenousLectingene of soybean simultaneously had been developed. The specificity,sensitivity and stability of this method had been tested by 15 GM soybean,3 GM maize,1 GM rape,1 GM rice and 1 non-GM soybean. Results indicated that this multiplex real-time PCR method could accurately detect target from 20 GM samples and 1 non-GM sample,which was in accordance to the predicted results.. The sensitivity of this method was 0.01%. The repeatability test showed that the standard deviation(SD)of the Ct value ranged from 0.050 to 0.222 and the relative standard deviation(RSD)ranged from 0.169% to 0.677% of the 9 replicates about 4 concentration DNA templates,which were all in acceptable range. In conclusion,this multiplex real-time PCR method was high specific,sensitive and reliable,and would be an effective tool for the detection of GM DAS44406-6 in the laboratory of CIQ(China entry-exit inspection and quarantine bureau,CIQ).
multiplex real-time PCR;genetically modified soybean DAS44406-6;detection
2016-08-09
付伟(1983-),女,博士,副研究员,研究方向:转基因生物安全,E-mail:fuwei0212@163.com。
*通讯作者:刘中勇(1962-),男,本科,研究员,研究方向:生物安全,E-mail:liuzy@cichk.com.hk。
广东省科技计划项目(2014A040401029);转基因产品抽制样和精准检测技术(2016ZX08012-001);广州市科技计划项目(2014J4100105)。
TS214
A
:1002-0306(2017)04-0063-05
10.13386/j.issn1002-0306.2017.04.003

