气相色谱-质谱联用法测定对甲苯磺酸脂类基因毒性杂质的方法学验证
李靖坤,王珊珊,林云良, 王晓利, 陈相峰
(山东省分析测试中心,山东 济南 250014)
气相色谱-质谱联用法测定对甲苯磺酸脂类基因毒性杂质的方法学验证
李靖坤,王珊珊,林云良, 王晓利, 陈相峰*
(山东省分析测试中心,山东 济南 250014)
用气相色谱-质谱联用法对吉非替尼中的对苯磺酸酯类(对甲苯磺酸甲酯、对甲苯磺酸乙酯、对甲苯磺酸异丙酯)的含量进行测定。该方法对对甲苯磺酸甲酯、对甲苯磺酸乙酯的检出限均为 0.50 mg/kg,对甲苯磺酸异丙酯的检出限为 1.2 mg/kg;三种化合物在 5~200 ng/mL 的浓度范围内均成良好的线性关系,相关系数 R2>0.99;回收率在 88.3%~111.6%之间;相对标准偏差(n=6)<4.67%,符合检测要求。该方法可以很好的应用于吉非替尼中对苯磺酸酯类杂质的检测。
气相色谱-质谱法;吉非替尼;对苯磺酸酯类
吉非替尼(易瑞沙)是一种表皮生长因子受体酪氨酸激酶抑制剂,它是一种新型抗癌药物,可以通过抑制肿瘤发生发展过程中细胞信号的传导来抑制恶性肿瘤细胞的增生,目前已在多个国家批准上市用于癌症的治疗[1]。然而,在药物生产制备过程中,容易造成痕量或微量的溶剂残留,这些具有一定的毒性和致癌作用的溶剂残留已引起医药界广泛的关注[2,3]。为保护患者免受药品中溶剂残留的伤害,对药品中溶剂的残留量进行准确测定非常必要[4]。
在吉非替尼药物的制备过程中涉及到对苯磺酸酯类。对苯磺酸酯类是一种潜在的基因毒性杂质[5,6],这些物质可与 DNA 发生烷基化反应[7,8]从而诱发癌症,因此对药物中该类杂质的毒理学关注阈值水平进行控制至关重要[9,10]。目前,已有用气质联用技术[11]和液相色谱串联质谱技术[12]对药物中对苯磺酸酯类杂质进行测定的报道。本文建立了用GC-MS 对吉非替尼中对甲苯磺酸乙酯类残留量的定量测定方法,并进行了相应方法学研究。
1 试验部分
1.1仪器与试剂
Agilent 7890A-7000B 气相色谱-质谱联用仪,KQ2202 型数控超声波清洗机,离心机,电子天平(0.0001g)。
吉非替尼,丙酮,甲苯磺酸甲酯,对甲苯磺酸乙酯,对甲苯磺酸异丙酯,均为色谱纯。
1.2 色谱质谱条件
色谱柱:毛细管柱( DB-624 30 m×0.25 mm× 1.4 μm),固定相为 6% 氰丙基苯、94% 二甲基聚硅氧烷。
载气:氦气。流速:1.0 mL/min。
程序升温:起始温度为 80 ℃,维持 0 min,以30 ℃每分钟的速率升温至 210 ℃,维持 10 min,20℃每分钟的速率升至 250 ℃,保持 1min。
进样口温度:260 ℃。分流模式:不分流进样。进样体积:1.0 μL。
离子源参数:电子轰击电离源(EI 源),电子能量为 70 eV,离子源温度为 230 ℃。扫描模式:选择离子扫描,各目标化合物的选择离子(m/z)为对甲苯磺酸甲酯(91、155、186),对甲苯磺酸乙酯(91、155、200),对甲苯磺酸异丙酯(91、172、214)。
1.3 溶液的配制
供试品溶液:取吉非替尼 40 mg,精密称定,置 10 mL 量瓶中,加丙酮稀释溶解并定容至刻度,摇匀,超声 2 min,作为供试品溶液。
对照品贮备液:取对甲苯磺酸甲酯 100.1mg,对甲苯磺酸乙酯 100.9 mg,对甲苯磺酸异丙酯 100.2 mg,精密称定,置 10 mL 量瓶中,加丙酮溶解并稀释至刻度,摇匀,作为贮备液 1。精密量取 1.0 mL贮备液 1,置 100 mL 量瓶中,加丙酮溶解并稀释至刻度,摇匀,贮备液 2。精密量取 1.0 mL 贮备液 2,置 100 mL 量瓶中,加丙酮溶解并稀释至刻度,作为对照品贮备液,浓度为 1.0 µg/mL。
对照品溶液:精密量取对照品贮备液 2.0 mL,置 100 mL 量瓶中,加丙酮溶解并稀释至刻度,作为对照品溶液,浓度为 20 ng/mL。
1.4 试验方法
待气相色谱-质谱仪开机稳定后,取供试品溶液、对照品贮备液、对照品溶液进行色谱分析,计算各组分的含量。
2 结果与讨论
2.1 专属性验证
单独进空白溶液,证明该溶液对被测物测试无干扰。取对照品贮备液 2,进样 0.5 µL,记录色谱图及质谱图。并取供试品含杂质的混合溶液进样。测定色谱图见图1。
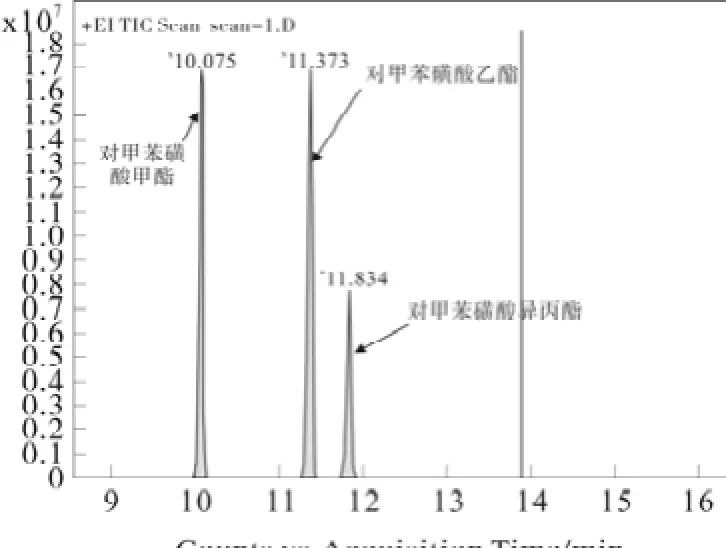
图1 全扫描色谱图Fig.1Chromatograms of full scan
结果表明:空白溶液对杂质检测无干扰,各目标化合物峰分离良好,供试品中其他杂质对目标化合物的检测无干扰,方法专属性强。
2.2 系统适用性验证
取对照品溶液 1µL,连续进样 6 针,记录各目标化合物的峰面积,并计算峰面积的相对标准偏差值(表 1)。
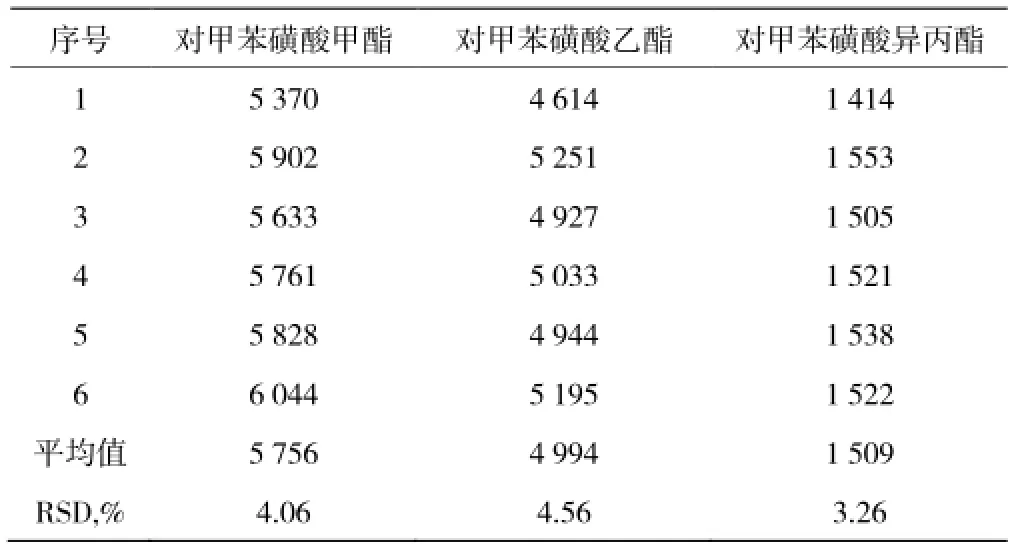
表1 系统适用性结果Table 1Results of the apparatus suitability test
结果表明:对甲苯磺酸甲酯、对甲苯磺酸乙酯、对甲苯磺酸异丙酯杂质峰面积的 RSD 值分别为4.06%、4.56%、3.26%,均小于 5.0%,系统适用性良好。
2.3 定量限及检测限
取对照品溶液适量逐级稀释成 10、5、2 ng/mL的溶液并进样,其信噪比(S/N)在 3~5 的样品浓度即为检测限浓度,检测限连续进 3针;信噪比在10~15 的样品的浓度即为定量限浓度,定量限连续进样6针;检测限浓度与样品理论浓度的比值即为检测限;定量限浓度与样品理论浓度的比值即为定量限。取空白溶液及上述溶液各 1.0 μL,分别注入气质色谱仪,记录离子流图。记录被测物峰高并计算定量限连续 6针峰高的 RSD。定量限和检测限测定结果见表 2、表 3。
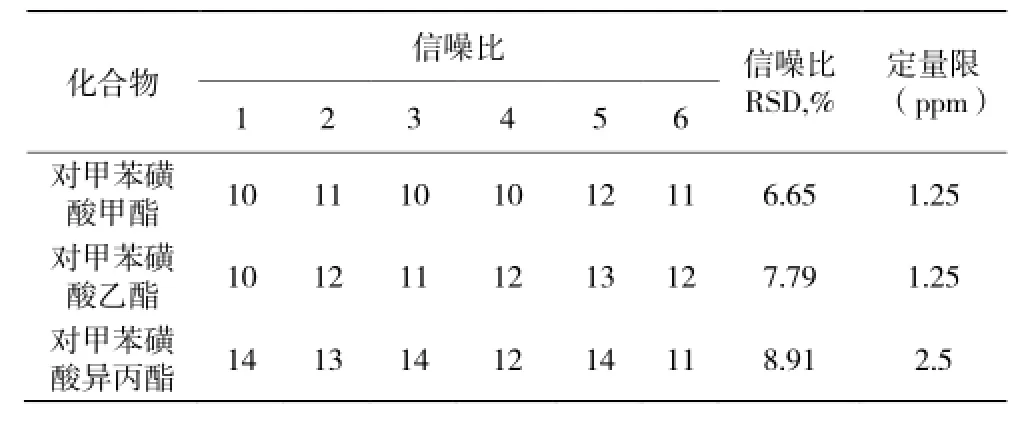
表2 定量限试验结果Table 2 Results of LOQ
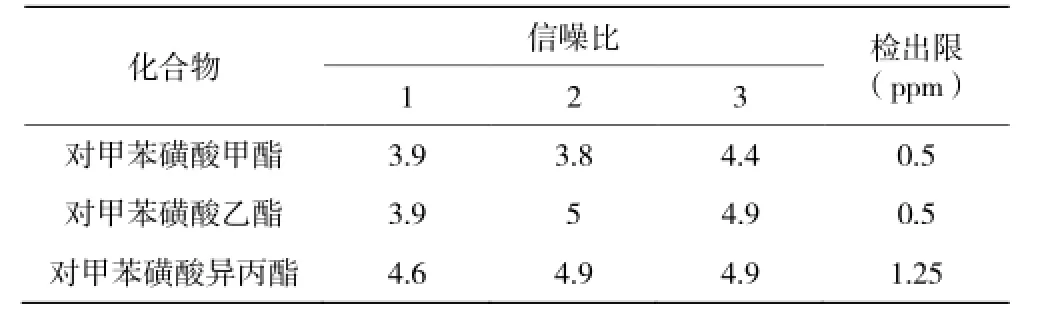
表3 检测限试验结果Table 3 Results of LOD
数据显示:对甲苯磺酸甲酯和对甲苯磺酸乙酯的检出限为 0.5ppm,对甲苯磺酸异丙酯的检出限为1.25ppm;对甲苯磺酸甲酯和对甲苯磺酸乙酯的定量限均为 1.25ppm,对甲苯磺酸异丙酯的定量限为2.5ppm;其 RSD 均小于 10%。
2.4 线性范围
分别精密量取对照品贮备液 0.05、 0.10、0.20、0.5、1.0、2.0 mL 于 10 mL 量瓶中,用稀释剂稀释至刻度,摇匀,配置线性溶液。取上述线性溶液各 1µL进样,记录色谱图。三种化合物的线性结果见表 4。

表4 对甲苯磺酸酯类线性结果Table 4 The linear results ofp-toluenesulfonate acid esters
结果显示:在 5~200 ng/mL 的范围内,甲苯磺酸甲酯的线性方程为 y =185.73x-38.144,线性相关系数 R² = 0.998 2;对甲苯磺酸乙酯的线性方程为 y = 158.88x - 141.43 ,线性相关系数 R² = 0.997 4;对甲苯磺酸异丙酯的线性方程为 y = 28.713x - 73.955,线性相关系数 R² = 0.997 4;呈现出良好的线性相关关系。
2.5 方法精密度与准确度
取吉非替尼称样并配制成含各目标化合物100%的测试溶液,作为方法精密度测试溶液,共配制6份。计算各目标化合物的含量,回收率及回收率的 RSD%。确定该色谱方法的测定结果与真实值(加入量)的差异。从而确认是否该方法可以获得准确的测试结果。三种化合物的准确度测试结果分别见表5。
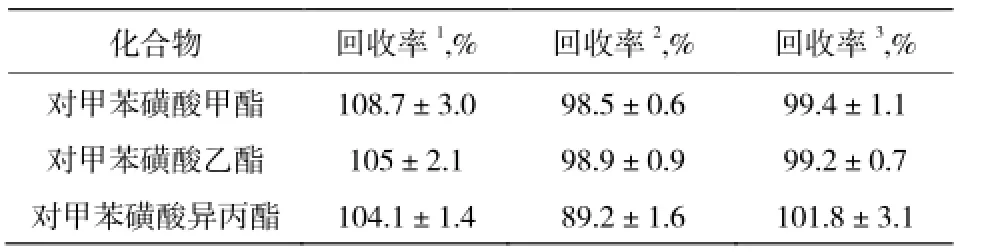
表5 对甲苯磺酸酯类准确度测试结果Table 5 Results of method accuracy ofp-toluenesulfonate acid esters
各基因毒性杂质的精密度结果分别为:对甲苯磺酸甲酯 1.60%,对甲苯磺酸乙酯 1.96%,对甲苯磺酸异丙酯 4.67%,测定结果的 RSD 均≤10.0%;各杂质的加标回收试验结果良好。该方法准确度和精密度良好。
2.6 实际样品检测
吉非替尼供试品溶液:精密称定样品 1~3 各 40 mg,置于 10 mL 的量瓶中,超声 2 min,摇匀,进样测试。结果见表6。

表6 样品检测结果Table 6 Results of sample test
结果表明:三种吉非替尼样品中均未检出对苯磺酸酯类基因毒性杂质残留。
3 结 论
本文用气相色谱-质谱联用法测定吉非替尼供试品中的对苯磺酸酯类,获得了理想的结果。该方法准确、可靠、操作便捷、符合基因毒性杂质的检测要求,可以广泛的应用于对苯磺酸酯类的检测中。
[1]管忠震,张力,李龙芸. 吉非替尼治疗局部晚期或转移性非小细胞肺癌在中国的临床研究[J]. 癌症,2005, 24(8):980-984.
[2]陈日南. 药物中有机溶剂残留量测定法评述[J]. 中国医药工业杂质,1997,28(6):275 -279.
[3]孙鹏. 药物中有机溶剂残的研究与检测[J]. 科技创新,2014,3:32.
[4]王卫. 药 品 中有机溶剂 残 留 量 及 其测定[J]. 天津药 学 ,2001,13(3):26-30.
[5]阮晓玲, 郑项元, 徐洁, 丁黎, 郑枫. 药物中基因毒性杂质分析方法的研究进展[J]. 中国药科大学学报,2016,47(3):267-274.
[6]王萍,徐彩虹,陈仙,胡爱玲.原料药中基因毒性杂质控制的研究进展[J].中国现代应用药学,2015,32(1):119-126.
[7]Stopper H,Lutz W K. Induction of micronuclei in human cell lines andprimary cells by combination treatment with Î3-radiation and ethyl methanesulfonate[J]. Mutagenesis,2002,17:177-181.
[8]Garcíaa A,Rupéreza F J,Ceppa F,et al.Development of chromatographic methods for the determination of genotoxic impurities in cloperastine fendizoate[J]. Jpharm Biomed Anal,2012,61:230-236
[9]European Medicines Agency.Evaluation of medicines for human use, guideline on the limits of genotoxic impurities[S].CPMP/SWP/ 5199/02,EMEA/CHMP/ QWP/251344/2006(2007).
[10]张园园,李银峰,王杰晶.药物中痕量磺酸酯类物质的检测技术研究进展[J].药物评价研究,2012:35(4):304-307.
[11]霍立,刘艳妮.气质联用技术检测对甲苯磺酸酯类杂质[J].中国新技术新产,2016,1:55.
[12]梁键谋,傅聪,陈悦.LC-MS/MS 测定草酸右旋西酞普兰中对甲苯磺酸酯类基因毒性杂质的含量[J].中国现代应用药学 ,2016,33(11):1436-1440.
Validation of GC-MS Method for Determining Genotoxic Impuritiesp-Toluene Sulfonic Acid Esters
LI Jing-kun, WANG Shan-shan, LIN Yun-liang, WANG Xiao-li, CHEN Xiang-feng*
(Shandong Analysis and Test Centre, Shandong Jinan 250014, China)
A gas chromatography-mass spectrometry method was developed to determinep-toluene sulfonic acid esters (methylp-toluenesulfonate, ethylp-toluenesulfonate and isopropylp-toluenesulfonate) in gefitinib. The test results show that developed method has good linearity (R2>0.99) in the range of 5~200 ng/mL and good repeatability (RSD%, <4.67%, n=6). The detection limit of methylp-benzenesulfonate and ethylp-toluenesulfonate is 0.50 mg/kg and the detection limit of isopropylp-toluenesulfonate is 1.25 mg/kg. The recoveries of spiked samples are between 88.3% and 111.6%. The developed method can be applied in detection ofp-benzenesulfonic acid esters in real samples.
GC-MS; gefitinib;p-benzenesulfonic acid esters
O 657
: A
: 1671-0460(2017)02-0378-03
2017-01-09
李靖坤(1991-),男,山东省聊城人,助理研究员,2014 年毕业于济南大学应用化学,研究方向:药物分析。
陈相峰(1981-),男,副研究员,博士,从事复杂体系质谱分析研究。E-mail:xiangfchensdas@163.com。

