规模猪场疫病防疫中存在的问题
——警惕防疫中的“破窗效应”
胡嘉欣,孟相秋,赵建增
(1.华威特(北京)生物科技有限公司北京100085;2.华威特(江苏)生物制药有限公司江苏泰州225300)
规模猪场疫病防疫中存在的问题
——警惕防疫中的“破窗效应”
胡嘉欣2,孟相秋1,赵建增1
(1.华威特(北京)生物科技有限公司北京100085;2.华威特(江苏)生物制药有限公司江苏泰州225300)
如果一间房子的一个窗户破了而不去修补,隔不久其它的窗户也会莫名其妙地被人打破,此为“破窗效应”。同样,猪场内如果发生某种疾病甚至对某单一疾病的防疫存在不足而未及时调整纠正,它就会引起连锁反应而产生一系列的防疫问题。当前国内多数猪场多种传染病长期并存,防疫管理多有不足,一病发作便会形成链索式问题。特别是在猪群免疫抑制的情况下,如果只关注到某一疾病、某一养殖阶段的问题,而忽视其他问题的存在,疫情就可能失控。本文从一个大型猪场防疫中遇到的问题论述系统防疫在猪场的重大意义。
1 猪场背景及疫病情况
华北地区一繁育基础母猪5 200头新建规模化养殖场;采用两点式饲养模式;母猪生产分空怀、配种及妊娠期、哺乳期四阶段,育肥猪分仔猪保育期和生长育肥期;单元式全进全出生产。
从2016年1月开始,场内繁育母猪群出现流产、产死胎、产木乃伊胎等繁殖障碍问题,比例达到11%左右。产房3日龄仔猪发生腹泻,伤亡率高,每窝出现2~4个弱仔,保育猪死淘率10%以上,育肥猪死淘率7%。进一步临床诊断发现,经产母猪有高烧、无乳、结膜炎等症状,保育猪表现明显神经症状、咳嗽、拉稀症状。为了找到猪场疫情发生的原因,对猪群重大病毒性传染病的病原、免疫接种及免疫应答等方面进行动态检验。
2 检验策略
借助基因诊断技术从血液和淋巴组织样品中检测猪繁殖与呼吸综合征病毒(PRRSV)RNA、从剖检病猪的淋巴组织检测伪狂犬病毒(PRV)DNA、从剖检仔猪的肠道组织检测流行性腹泻病毒(PEDV)RNA,以确定各自的感染情况。
借助ELISA检测各年龄阶段的血清中CSFV、PRRSV和PRV特异性抗体,以确定猪群的免疫状态。其中,针对PRV,同时检测gE和gB抗体,以考察猪只携带或暴露PRV野毒及对疫苗的免疫应答情况。

图1 PRV野毒检测结果

图2 PRRSV野毒检测结果
3 病原筛查检测
结果在检测的4头产房仔猪的淋巴组织中检测到PRV野毒核酸(如图1);在保育猪血清#3、繁育母猪血清(#1和#4)和产房仔猪淋巴样品#4中检测到PRRSV野毒RNA(如图2);在产房仔猪肠组织样品#1中检测到PEDV RNA(如图3)。
4 抗体检测分析
4.1 PRV 繁育公猪、繁育母猪和后备猪伪狂犬监测数据(见表1)。
依据近期连续6个月伪狂犬gE抗体检测结果,可以看出该场平均有75.2%的繁育公猪、42.7%的繁育母猪和3.3%的后备猪均有伪狂犬野毒感染或带毒状态。同时繁育公猪、繁育母猪、后备猪在不同时间gB抗体阳性率未达到100%,繁育公猪gB抗体阳性率最低为86.7%,繁育母猪gB抗体阳性率最低为96.7%,后备猪gB抗体阳性率最低为33.3%,这就造成伪狂犬野毒感染带毒猪不断向外排毒,感染免疫缺陷或无免疫保护力的猪只,导致伪狂犬gE抗体阳性率居高不下。
4.2 PRRSV

图3 PEDV检测结果

表1 种猪群伪狂犬免疫和感染抗体的动态监测数据
该场种猪在原种猪场均有接种PRRSV弱毒疫苗史,除繁育公猪未免疫外,全群在生产中定期接种PRRSV疫苗。对抗体监测发现,繁育母猪的免疫率在84%~100%间波动,后备母猪的免疫率在86%~100%,而繁育公猪的抗体阳性率53%~93%(如图4)。提示免疫不充分并有感染存在(例如公猪)。

图4 种猪群蓝耳免疫后抗体动态监测数据
4.3 CSFV抗体
生产猪群的猪瘟免疫合格率在83%左右(见表2),有一部分猪只处于易感状态,提示免疫不充分,可能受到猪瘟野毒感染。繁育母猪个体阻断率达到60%以上的免疫合格率为98%,符合当前的国家防疫标准,但不能保证生产仔猪的安全。该场公猪的免疫合格率为75%,后备母猪的免疫合格率仅为71.4%,如果以更高标准要求的话,均存在猪瘟防疫不足的隐患(见表3),也间接影响到繁育母猪和育肥猪的防疫。从表4的结果来看,上游种猪群的猪瘟免疫合格率也在70%左右,同时也存在一定的潜在风险。

表2 生产猪C S F V抗体状态
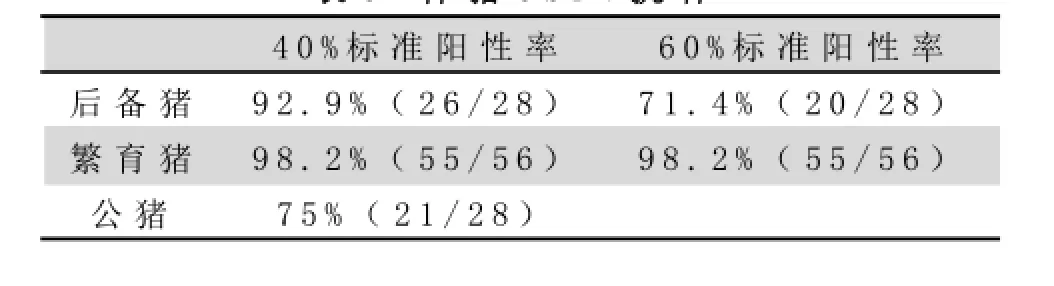
表3 种猪C S F V抗体

表4 上游种猪场C S F V抗体
综合分析以上检验数据,可以看出该场确有伪狂犬、蓝耳病、流行性腹泻等病毒性疾病感染。尽管未进行病原分析,由于有大量仔猪及种猪处于易感状态,不排除猪群有猪瘟流行。
5 该场主要疫病状态
从抗体检测结果可以看出,该场繁育猪群PRV带毒率极高,繁育公猪带毒阳性率甚至高达100%,这可能是造成繁育猪群的生产性能低下和仔猪呼吸道与肠道疾病频发的主要原因。尽管接种疫苗的频率不低(4次/年)但不能有效解决问题,最明显的是繁育猪群gB抗体始终达不到100%合格。回顾分析后备母猪,伪狂犬gB抗体合格率达不到100%,说明问题出现在更早期。除了接种Bartha-K61弱毒疫苗外,该场还给仔猪接种了PRV灭活疫苗,但由于其诱导细胞免疫能力弱,未明显改善防疫效果。
从不同年龄猪的组织和血清样品检验结果来看,该场的仔猪有较高比例的仔猪感染,繁育猪群有长期带毒现象;特别是繁育公猪未接种PRRS疫苗但却有不同程度的抗体,提示繁育公猪群有PRRSV感染史且可能持续排毒,应是该场蓝耳病控制的一个死角。在各个群都有带毒的情况下,蓝耳病疫苗的免疫效力打了折扣,不反复免疫难以消除带毒猪维系的免疫凹地。
6 猪场防疫中存在的风险
从以上检验结果可以看出,该场PRRSV、PRV、CSFV这三种主要病毒均在群内有明显流行。前期已做了密集免疫接种,但进一步分析可发现一些潜在问题。
6.1 PRRSV
由于对上游种猪场免疫和疫病背景关注不够,引进后备猪的PRRS免疫不规范,猪群带毒问题长期存在而影响到群体免疫力。此外,后备猪引进后的隔离时间短(未达2个月以上),疫苗免疫次数不够(少于2次)和免疫效果不达标(出现PRRSV抗体阴性猪),均不足以有效限制外源引入性PRRSV。其次,本场未给繁育公猪接种蓝耳病疫苗,该群猪长期带毒、持续排毒,俨然成为PRRSV重要传播的源头之一。繁育母猪和仔猪群的PRRSV感染、直接造成免疫抑制及多种继发感染,多种免疫失败可由此产生,应迅速调整免疫方案,及时有效阻止这种状态的发展。
6.2 PRV
尽管该场在各个环节都做了充分的PRV免疫,但免疫质量管理存在不足。首先后备猪在引种前PRV gE抗体虽为阴性,但部分猪无gB抗体应答,说明猪群存在免疫抑制现象,或者说未能做到PRV免疫,甚至可能隐性带毒。这些猪在混群后受到场内PRV野毒的攻击而迅速成为带毒者。其次繁育猪群免疫应答不充分(PRV gB抗体合格率未到达100%)且野毒感染严重(PRV gE抗体阳性率甚至达到100%),提示群体免疫状态不佳。由于繁育猪群的带毒猪向外排毒,仔猪出生后很快就可能被感染,所以不纠正PRRS状态,不提高PRV免疫强度及不提前仔猪的首免时间都不可避免地使PRV问题扩大化。
6.3 CSFV
首先后备猪要淘汰抗体水平低(个体抗体阻断率<70%)和免疫无应答猪(个体抗体阻断率<40%),这些猪可能存在猪瘟带毒的情况;其次繁育猪群应纠正猪瘟免疫状态,目标达到群体抗体合格率100%,个体抗体阻断率70%以上,及时淘汰免疫未达标和带毒猪,繁育母猪猪瘟带毒,持续感染、垂直传播,生产仔猪先天带毒、免疫耐受,造成猪瘟免疫失败;最后猪瘟免疫程序制定与受母源抗体的影响,免疫首免时间不宜过晚,如果存在免疫空白期,会造成母源保护力低下的仔猪受到猪瘟野毒感染。
7 猪场当前防疫的要点
针对该场的感染和防疫状态,需要对其免疫方案和策略做调整,要点如下:
1)PRRSV:许多PRRS弱毒疫苗存在安全隐患,种猪群使用这类疫苗可能导致其后代长期携带PRRSV。后备猪引种前要完全掌握其免疫背景,包括使用疫苗和防疫状态,严防引进带毒猪。引种后迅速接种安全无免疫抑制的PRRS弱毒疫苗,隔离2个月以上。在此期间检测PRRSV抗体,如果存在抗体应答不理想的猪只,就补充接种PRRS疫苗,到配种前至少加强PRRS免疫2次。同时对繁育公猪、母猪全群和育肥猪全群免疫无死角,切断潜在病毒的传播。
2)PRV:坚持使用PRV Bartha K-61株活疫苗,根据群体应答情况及时调整免疫方案。做好后备猪引种前和混群前监测,不引进不合格猪(gB抗体阴性/gE抗体阳性)。可在引种后强化免疫2次,免疫间隔1个月。繁育猪加大检测群体样品数量和监测频率,如果gE抗体阳性率<10%,可及时淘汰带毒猪;如果gE抗体阳性率高的繁育母猪,可分群隔离饲养带毒猪,加强免疫并跟踪监测,有目的淘汰以便快速净化病原。鉴于生长猪的带毒率较高,成年猪的感染情况严重,采用“3-3-7”强化免疫模式,减少感染机率。
3)CSFV:使用抗原剂量充足的猪瘟活疫苗;加强后备猪猪瘟免疫,淘汰无免疫应答或应答水平低的猪只(存在猪瘟带毒的情况);繁育猪群加强猪瘟防疫,目标达到群体抗体合格率100%,个体阻断率70%以上。生长猪猪瘟一免时间不宜过晚,受母源抗体影响,免疫空白期可能造成仔猪野毒感染,猪瘟疫苗免疫失败。
4)在免疫预防重大疫病的同时,要做好生物安全管理。①严格消毒,批次间栏舍的清洗-干燥-消毒-干燥-空栏;②严格灭鼠,严控周边村庄猫、狗等动物进入猪场。病死猪要及时淘汰、处理。③控制人员流动,禁止串岗工作。对运猪车和人员严格消毒;④严控引进后备猪隔离、免疫,检测阴性、合格后才可混群;自留种猪配种前检测阴性才可配种。
8 破窗效应给我们带来的启示
基于本案例可以发现:①猪群长期处在免疫抑制状态下,整体防疫水平随时都会出现“破窗户”现象;②任何一个单元的防疫不到位,都会给全群带来长期隐患;③对上游企业的标准应当有一个高标准要求,才可能把病原阻挡在场外;④对繁育猪群的防疫要有更标准要求,这有利于仔猪的防疫;⑤在没有得到科学结论前就改变或制订免疫方案,一般不会产生更好的效果,且还会贻误最佳防疫时机。
猪场防疫中“破窗效应”无处不在。不放过任何一处隐患、真正把免疫及生物安全的工作常态化落实到位,有效防疫、提高生产水平和经济效益并不难。■
10.3969/j.issn.1008-4754.2017.1.017

