DS-1226对慢性睡眠干扰所致小鼠抑郁行为的改善作用
张北月,石晋丽*,郑志全,范琳犀,吕静薇,刘新民*
(1. 北京中医药大学,北京 100029;2. 中国医学科学院药用植物研究所,北京 100193;3. 西南医科大学,四川 泸州 646000)
DS-1226对慢性睡眠干扰所致小鼠抑郁行为的改善作用
张北月1,石晋丽1*,郑志全1,范琳犀2,3,吕静薇2,刘新民2*
(1. 北京中医药大学,北京 100029;2. 中国医学科学院药用植物研究所,北京 100193;3. 西南医科大学,四川 泸州 646000)
目的 研究人参皂苷水解产物DS-1226对慢性睡眠干扰小鼠的抗抑郁作用,为抗抑郁药物的研发提供科学依据。方法 将72 只雄性 ICR小鼠分为空白对照组、模型组、阳性对照组(盐酸帕罗西汀,10 mg/kg)、DS-1226低剂量组(20 mg/kg)、中剂量组(40 mg/kg)、高剂量组(80 mg/kg)。除空白组外,其他组小鼠先进行3 d的滚筒适应,然后连续进行14 d睡眠干扰。采用体重监测、自主活动实验、悬尾实验、强迫游泳实验等实验方法,评价DS-1226的抗抑郁作用。结果 连续进行14 d睡眠干扰后,与空白对照组相比,模型组体重显著下降,悬尾和强迫游泳不动时间显著增长。与模型组相比,DS-1226中剂量组显著逆转睡眠干扰所致的体重下降,其他各给药组均未能显著逆转睡眠干扰所致的体重下降;阳性药组的悬尾不动时间极显著减少,强迫游泳不动时间有减少趋势;DS-1226中剂量悬尾不动时间显著减少,强迫游泳不动时间有明显减少趋势;DS-1226高剂量组悬尾和强迫游泳不动时间均显著减少。结论 DS-1226具有改善慢性睡眠干扰小鼠抑郁样行为的作用。
人参皂苷水解产物;DS- 1226;慢性睡眠干扰;抑郁;小鼠
抑郁症是一种常见的精神疾病,具有的高发病率、高复发率、高致残/死亡率等特点,严重威胁着人类的健康[1]。目前抑郁症主要通过药物治疗和心理治疗,而临床上治疗抑郁症的药物主要是西药,其存在依赖性、药物间相互作用和不良反应等缺陷,这使得抗抑郁中药的新药研发相当活跃。人参是我国传统名贵中药,被誉为“百草之王”,现代药理研究证明人参的多个成分和组方能明显改善抑郁样症状[2]。DS-1226是人参达玛烷型皂苷水解产物的有效组分,其组成是:原人参三醇[20 ( S )-aglycone protopanaxatriol,PPT] 23.85%,原人参二醇[20(S)-aglycone protopanaxadiol,PPD] 16.96%,人参皂苷Rh2(ginsenoside Rh2) 1.40%,人参皂苷Rh1(ginsenoside Rh1) 1.00%,研究表明其具有抗肿瘤和改善学习记忆的作用[3-4]。课题组前期研究发现DS- 1226在慢性束缚抑郁模型上具有很显著的抗抑郁作用[5],但未见DS- 1226对其他抑郁模型的抗抑郁作用的研究报道,有必要采用其他抑郁模型全面的评价DS- 1226的抗抑郁作用。长期的睡眠剥夺可引起焦虑和抑郁等情绪问题[6-7],近年来,慢性睡眠干扰抑郁模型被用于抗抑郁药物的药效学评价和机制研究[8-9]。本研究旨在通过采用睡眠干扰抑郁模型,综合评价DS- 1226的抗抑郁作用,以期为抗抑郁新药的研发提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
72 只SPF级ICR小鼠,体重(20±2)g,雄性,购自北京维通利华实验动物公司【SCXK(京)2012-0001】。动物饲养于中国医学科学院药用植物研究所的屏障环境【SYXK(京)2013-0023】,12 h照明/12 h黑暗(照明:8:00~20:00),饲养期间给予动物标准饲料和洁净饮水。本动物实验遵守国际实验动物伦理学要求。实验前动物适应环境5 d。
1.1.2 试剂与仪器
DS-1226(加拿大博新药业股份有限公司,加拿大);盐酸帕罗西汀(中国食品药品检定研究院,中国,产品批号:100357-201303)。
小鼠睡眠干扰仪、小鼠自主活动计算机图像实时检测分析处理系统、悬尾计算机实时检测分析处理系统、强迫游泳计算机图像实时分析处理系统,均由中国医学科学院药用植物研究所、中国航天员科研训练中心联合研制开发。
1.2 方法
1.2.1 实验动物分组
于造模前1 d,根据小鼠体重、活跃度随机分6 组,每组12 只,确保每组间无明显差异。分组情况如下:空白对照组、模型组、阳性对照组(盐酸帕罗西汀,10 mg/kg)、DS-1226低剂量组(20 mg/kg)、DS-1226中剂量组(40 mg/kg)、DS-1226低剂量组(80 mg/kg)。空白对照组、模型组以灌胃给予蒸馏水,DS-1226剂量组均按剂量灌胃给药,灌胃体积均为0.2 mL/10g体重,每天1次。
1.2.2 睡眠干扰致抑郁模型的建立[10-11]
使用小鼠睡眠干扰仪进行建模,小鼠睡眠干扰仪由滚筒和计算机控制系统两部分组成。自行设定控制参数,使干扰仪对滚筒内饲养动物进行睡眠干扰。模型建立分为两个阶段:①滚筒适应期:将除去空白对照组之外的动物放入滚筒中适应,连续3 d,每天3 h(滚筒参数:1 r/min,转1 min,间隔2 min)。先进行适应以避免动物突然接受高强度刺激产生过度反应;②建模:滚筒适应结束后开始正式造摸,将除去空白对照组之外的所有动物组放入滚筒内,进行连续14 d的睡眠干扰(滚筒参数:1 r/min,转1 min,间隔2 min)。滚筒内动物每天取出给予相应的受试药物,给药完毕后继续放入滚筒进行睡眠干扰。空白对照组饲养于动物房内,每天给予相应体积的蒸馏水。连续睡眠干扰14 d后进行行为学检测。每天检测结束后,将模型组动物放回滚筒继续干扰。
1.2.3 记录动物体重的变化
每间隔3 d称一次体重,记录各组小鼠体重的变化。
1.2.4 小鼠自主活动检测[12-13]
于检测当天灌胃给药1 h后,检测小鼠的自主活动。将小鼠面壁放入小鼠自主活动计算机图像实时检测分析处理系统的测试箱内适应3 min后开始进行检测,检测时长为10 min,检测时保持环境安静。计算机自动监测动物在测试箱内的运动路程、运动时间、运动速度等指标,以分析动物的自主活动情况。
1.2.5 小鼠悬尾实验(tail suspension test,TST)[14-15]
于检测当天灌胃给药1 h后,进行小鼠悬尾实验。距小鼠尾尖部约1 cm处用胶布固定于悬尾计算机实时检测分析处理系统的悬尾箱支架挂钩上,使小鼠成倒挂状态,其头部离箱底约5 cm。悬挂时间为6 min,统计小鼠后4 min内悬尾累积不动时间(不动状态即小鼠无任何活动或停止挣扎不动)。
1.2.6 小鼠强迫游泳实验(forced swim test,FST)[16-17]
于检测当天灌胃给药1 h后,进行小鼠强迫游泳实验。将小鼠放入强迫游泳计算机图像实时分析处理系统内,观察6 min内小鼠游泳情况,统计小鼠后4 min内游泳累积不动时间(不动状态即小鼠停止挣扎或呈漂浮状态,小鼠四肢有轻微摆动以保持头部在水面)。
1.2.7 统计学方法
2 实验结果
2.1 DS-1226对睡眠干扰小鼠体重的影响
如表1所示,造模5 d后,模型组与空白对照组比较,小鼠体重显著下降(P<0.05),且模型组体重显著下降的情况一直维持到实验结束;造模第5天,DS-1226中剂量组显著逆转睡眠干扰所致的体重下降(P<0.05);其他各给药组均未能显著逆转睡眠干扰所致的体重下降。
2.2 DS-1226对睡眠干扰小鼠自主活动实验的影响
由表2可知,模型组与空白组比较,自主活动各指标差异均无显著性;DS-1226剂量组与模型组相比,自主活动各指标差异均无显著性。
2.3 DS-1226对睡眠干扰小鼠TST和FST实验不动时间的影响
与空白对照组悬尾不动时间相比,模型组的悬尾不动时间极显著增加(P<0.01)。与模型组悬尾不动时间相比,阳性组悬尾不动时间极显著减少(P<0.001);DS-1226低剂量组悬尾不动时间有减少的趋势,而中剂量悬尾不动时间差异有极显著性 (P<0.01),高剂量组差异有显著性 (P<0.05)。与空白组强迫游泳不动时间相比,模型组的强迫游泳不动时间显著增多(P<0.01)。与模型组强迫游泳不动时间相比,阳性组的强迫游泳不动时间有减少趋势;DS-1226低剂量和中剂量组强迫游泳不动时间有减少的趋势;DS-1226高剂量组的强迫游泳不动时间显著减少(P<0.01)。见表3。
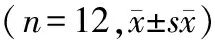
表1 DS-1226对睡眠干扰小鼠体重的影响
注:与空白对照组比较,#P<0.05;与模型组比较,*P<0.05。
Note. Compared with the control group,#P<0.05; Compared with the model group,*P<0.05.
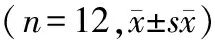
表2 DS-1226对睡眠干扰小鼠自主活动实验的影响
注:与空白对照组比较,#P<0.05;与模型组比较,*P<0.05。
Note. Compared with the control group,#P<0.05; Compared with the model group,*P<0.05.
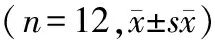
表3 DS-1226对睡眠干扰小鼠TST和FST实验不动时间的影响
注:与空白对照组比较,##P<0.01;与模型组比较,***P<0.01,**P<0.01,*P<0.05。不动时间减少比率均与模型组进行比较,故模型组无不动时间减少比率值。
Note. Compared with the control group,##P<0.01; Compared with the model group,***P<0.01,**P<0.01,*P<0.05.Immobility time reduction ratio was compared with the model group.
3 讨论
睡眠干扰模型表现出悬尾实验和强迫游泳实验不动时间增长、糖水偏好实验中糖水偏好指数下降、体重下降等显著的抑郁样行为[7,11]。睡眠干扰抑郁模型的一个主要特点是睡眠障碍和抑郁症的双向关系,即抑郁症的症状之一为睡眠障碍,而长期的睡眠干扰又可引起抑郁的发生[18-19],这使睡眠干扰抑郁模型对于研究抑郁症发病机制和抗抑郁药物筛选有重要意义。
TST和FST是两种经典的急性抑郁模型,均具有简便、快捷、敏感的特点,是抗抑郁药物筛选最常用的实验方法。其原理基本相同,即动物在被迫应激情况下,最初会剧烈挣扎逃脱,但多次逃脱失败后,便进入一种特征性的不动状态,即为“行为绝望”。抗抑郁药可减少其不动时间[20-21]。与空白对照组相比,模型组的悬尾不动时间和强迫游泳不动时间极显著增加(P<0.01),提示模型造模成功;与模型组相比,阳性对照组悬尾不动时间极显著减少(P<0.001),强迫游泳不动时间有减少趋势;DS-1226低剂量组悬尾和强迫游泳不动时间均有减少的趋势;DS-1226中剂量悬尾不动时间差异有极显著性(P<0.01),强迫游泳不动时间有减少趋势;DS-1226高剂量组差异有显著性(P<0.05),强迫游泳不动时间显著减少(P<0.01)。这表明DS-1226具有显著抗抑郁作用,且与阳性药帕罗西汀相比,DS-1226在强迫游泳实验中的表现更佳。
抑郁症的特点之一为体重下降,慢性睡眠干扰抑郁模型会导致动物体重下降[11]。本研究结果显示模型组与空白对照组比较,小鼠体重显著下降(P<0.05),提示小鼠睡眠干扰抑郁模型成功。但各给药组均未能显著逆转睡眠干扰所致的体重下降。
空场最早由Hall设计而用于研究大鼠的情绪反应[22]。动物在空场内的自主活动的区域特点能揭示动物处于镇静或兴奋的状态[23]。本研究中模型组与空白对照组比较,自主活动各指标均无显著性差异;给药组与模型组相比,自主活动各指标均无显著性差异。由此可说明所用造模方法不影响小鼠自主活动状态,DS-1226对睡眠干扰小鼠的自主活动无兴奋或镇静的作用。
综上,DS-1226在慢性睡眠干扰抑郁模型中,对悬尾不动时间和强迫游泳不动时间有明显改善作用,表明其具有显著抗抑郁作用,特别是DS-1226高剂量表现更为明显,但其抗抑郁作用的量效关系还需进一步实验研究。
[1] 薛敏. 抑郁症患者停药原因分析及心理健康教育[J]. 中国社区医师:医学专业, 2012, 14(2):79-79.
[2] 黄世敬. 人参抗抑郁研究进展[J]. 时珍国医国药, 2014, 25(01):175-177.
[3] 许秋霞. DS-1226对环磷酰胺所致骨髓抑制小鼠的保护作用[D]. 中国协和医科大学, 2010.
[4] 卜兰兰, 石哲, 武宏伟,等. 达玛烷苷元对睡眠干扰所致小鼠学习记忆障碍的改善作用[J]. 中国比较医学杂志, 2014, 24(10):48-53.
[5] 何怡然, 马静遥, 陈铃铃,等. DS-1226对慢性限制活动大鼠的抗抑郁作用[J]. 中国实验动物学报, 2013, 21(03):42-47.
[6] Solanki N, Atrooz F, Asghar S, et al. Tempol protects sleep-deprivation induced behavioral deficits in aggressive male Long-Evans rats[J]. Neurosci Lett, 2015, 612(Suppl 59):245-250.
[7] 陈璐,王震,王雪敏. 连续5d快速动眼睡眠剥夺诱发小鼠迟发性抑郁样行为[J]. 南方医科大学学报,2016,36(5):660-664.
[8] Mcguire M, Tartar J L, Cao Y, et al. Sleep fragmentation impairs ventilatory long-term facilitation via adenosine A1 receptors[J]. J Physiol, 2008, 586(Pt 21):5215-5229.
[9] 武宏伟. 人参皂苷水解产物对慢性应激所致学习记忆功能减退的改善作用[D]. 北京协和医学院中国医学科学院;北京协和医学院;清华大学医学部;中国医学科学院, 2015.
[10] Feng L, Wu H W, Song G Q, et al. Chronical sleep interruption-induced cognitive decline assessed by a metabolomics method.[J]. Behav Brain Res, 2015, 302:60-68.
[11] 高江晖, 卜兰兰, 石哲,等. 不同时间睡眠干扰所致小鼠的类抑郁样行为[J]. 中国实验动物学报, 2011, 19(05):405-409.
[12] 王琼,买文丽,李翊华,等.自主活动实时测试分析处理系统的建立与开心散镇静作用验证 [J].中草药,2009,40(11): 1773-1779.
[13] 翟俊乐,田欢,李孟秋,等. 黄花菜抗抑郁作用有效成分的筛选[J]. 中国食品添加剂2015, 10:93-97.
[14] Steru L, Chermat R, Thierry B, et al. The tail suspension test: A new method for screening antidepressants in mice[J]. Psychopharmacology, 1985, 85(85):367-370.
[15] 孙秀萍, 张晓萌, 卢聪,等. 悬尾实验实时检测分析处理系统的研制及初步应用[J]. 中国比较医学杂志, 2014, 24(05):66-71.
[16] Porsolt RD, Bertin A, Jalfre M. Behavioral despair in mice: a primary screening test for antidepressants[J]. Arch Int Pharmacodyn Ther, 1977, 229(2):327-336.
[17] Dang H, Chen Y, Liu X, et al. Antidepressant effects of ginseng total saponins in the forced swimming test and chronic mild stress models of depression[J]. Progress Neuro-psychopharmacol Biol Psychiatry, 2009, 33(8):1417-1424.
[18] Tempesta D, Curcio G, De G L, et al. Long-term impact of earthquakes on sleep quality[J]. PLoS One. 2013, 8(2): e55936
[19] Riemann D, Berger M, Voderholzer U. Sleep and depression-results from psychobiological studies: an overview[J]. Biol Psychol, 2001, 57(1-3):67-103.
[20] Petit-Demouliere B, Chenu F, Bourin M. Forced swimming test in mice: a review of antidepressant activity[J]. Psychopharmacology, 2005, 177(3):245-255.
[21] Cryan J F, Mombereau C, Vassout A. The tail suspension test as a model for assessing antidepressant activity: Review of pharmacological and genetic studies in mice[J]. Neurosci Biobehav Rev, 2005, 29(4-5):571-625.
[22] Hall CS. Emotional behavior in the rat. I. Defecation and urination as measures of individual differences in emotionality[J]. J Comp Physiol Psychol, 1934, 18(3):385-403.
[23] 买文丽, 王琼, 刘新民,等. 小鼠自主活动实验中的评价指标[J]. 中国实验动物学报, 2008, 16(03):172-175.
Antidepressant effects of DS-1226 on mouse models of depression induced by chronic sleep interruption
ZHANG Bei-yue1,SHI Jin-li1*,ZHENG Zhi-quan1,FAN Lin-xi2,3, LV Jing-wei2, LIU Xin-min2*
(1. Beijing University of Chinese Medicine, Beijing 100029,China; 2. Institute of Medicinal Plants, Chinese Academy of Medical Sciences, Beijing 100193; 3. Southwest Medical University, Luzhou 646000)
Objective To investigate the antidepressant effect of DS-1226, a hydrolysate of ginsenosides, on a mouse model of depression induced by chronic sleep interruption, and provide scientific evidence for the research and development of antidepressant drugs. Methods 72 male ICR mice were divided into control group, model group, positive control group (paroxetine hydrochloride, 10 mg/kg) and 3 treatment groups (20 mg/kg, 40 mg/kg, 80 mg/kg of DS-1226). Except the control group, the other mice were put into a rotary roller (parameter settings:1 min/rev;rest 2 min after 1 rev) for 3 days of drum adaptation, 3 h/d. Then making model for 14 days in the roller(parameter settings:1 min/rev;rest 2 min after 1 rev). The antidepressant effects of DS-1226 were evaluated by weight monitoring, open-field test, tail suspension test, and forced swimming test. Results After 14 d sleep disturbance, compared with the control group, the body weight, immobility time in tail suspension test and forced swimming test were significantly decreased in the model group. Compared with the model group, DS-1226(40 mg/kg)significantly reversed the weight loss caused by sleep disturbance. Paroxetine significantly reduced the immobility time of tail suspension test. DS-1226 (40 mg/kg, 80 mg/kg)significantly decreased the immobility time of tail suspension test, and DS-1226 (80 mg/kg) significantly decreased the immobility time of forced swimming test. Conclusion The hydrolysate of ginsenosides DS-1226 shows antidepressant effect on mouse model of depression induced by chronic sleep interruption.
DS-1226, a hydrolysate of ginsenoside;Chronic sleep interruption;Depression;Mice
SHI Jin-li,E-mail: shijl@vip.sina.com;LIU Xin-min, E-mail: liuxinmin@ hotmail.com
中国航天员科研训练中心人因工程重点室开放课题(SYFD150051808K);总装生物交叉预研项目(编号51326050501);新疆科技厅支疆项目(201491174)。
张北月( 1991- ), 女,硕士研究生,研究方向:创新药物研究。E-mail: 774156423@qq.com
石晋丽(1967-),女,博士生导师,研究方向:创新药物研究。E-mail: shijl@vip.sina.com;刘新民( 1962- ),男,博士生导师,研究方向:神经药理。E-mail: liuxinmin@ hotmail.com
Q95-33
A
1005-4847(2017) 01-0085-05
10.3969/j.issn.1005-4847.2017.01.016
2016-08-18

